2024-02-16 スイス連邦工科大学ローザンヌ校(EPFL)
◆新しい研究でEPFLの科学者たちは、タンパク質が細胞内で合成された後に起こる変化である「ポストトランスレーショナル修飾(PTM)」がこれらのアミロイドフィブリルの形成と病原性にどのように影響するかを理解する上で重要な進展を遂げた。
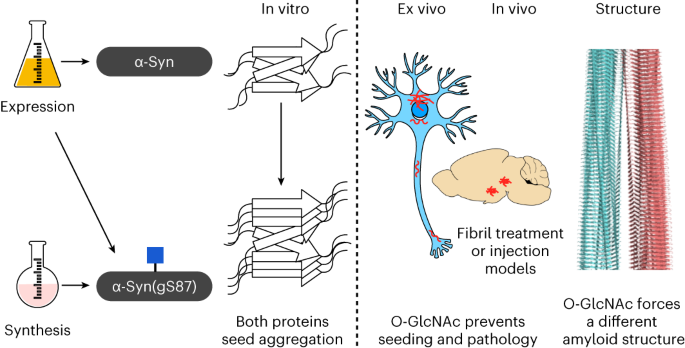
◆研究では、パーキンソン病でアミロイドフィブリルの形成に関連するα-シヌクレインというタンパク質を研究し、特定の修飾である「O-リンク型β-N-アセチルグルコサミン(O-GlcNAc)」に焦点を当てた。O-GlcNAcは、特定のセリンまたはスレオニン残基に単一の糖分子を添加する修飾であり、タンパク質の機能と特性を変化させる。これがアミロイド凝集や神経変性に関連していることが示唆されている。
◆研究は、この修飾を増加させることが神経変性疾患の早期段階で治療的な可能性を持つことを示唆しており、修飾されたアミロイドフィブリルが脳内での凝集と拡散を防いで病気の進行を遅らせる可能性がある。
<関連情報>
- https://actu.epfl.ch/news/protein-modifications-key-influencers-in-neurodege/
- https://www.nature.com/articles/s41589-024-01551-2
O-GlcNAcは、播種と病理学的変化を顕著に減少させたα-シヌクレインアミロイド株を形成させる O-GlcNAc forces an α-synuclein amyloid strain with notably diminished seeding and pathology
Aaron T. Balana,Anne-Laure Mahul-Mellier,Binh A. Nguyen,Mian Horvath,Afraah Javed,Eldon R. Hard,Yllza Jasiqi,Preeti Singh,Shumaila Afrin,Rose Pedretti,Virender Singh,Virginia M.-Y. Lee,Kelvin C. Luk,Lorena Saelices,Hilal A. Lashuel & Matthew R. Pratt
Nature Chemical Biology Published:12 February 2024
DOI:https://doi.org/10.1038/s41589-024-01551-2
Abstract
Amyloid-forming proteins such α-synuclein and tau, which are implicated in Alzheimer’s and Parkinson’s disease, can form different fibril structures or strains with distinct toxic properties, seeding activities and pathology. Understanding the determinants contributing to the formation of different amyloid features could open new avenues for developing disease-specific diagnostics and therapies. Here we report that O-GlcNAc modification of α-synuclein monomers results in the formation of amyloid fibril with distinct core structure, as revealed by cryogenic electron microscopy, and diminished seeding activity in seeding-based neuronal and rodent models of Parkinson’s disease. Although the mechanisms underpinning the seeding neutralization activity of the O-GlcNAc-modified fibrils remain unclear, our in vitro mechanistic studies indicate that heat shock proteins interactions with O-GlcNAc fibril inhibit their seeding activity, suggesting that the O-GlcNAc modification may alter the interactome of the α-synuclein fibrils in ways that lead to reduce seeding activity in vivo. Our results show that posttranslational modifications, such as O-GlcNAc modification, of α-synuclein are key determinants of α-synuclein amyloid strains and pathogenicity.