2024-02-29 京都大学iPS細胞研究所
ポイント
- ヒトiPS細胞由来の心筋細胞群から心房筋と心室筋細胞を効率よく純化できる細胞表面マーカーとしてCD151を同定した。
- Notchシグナルを阻害することで、心房筋細胞の分化誘導効率を高め、生体の心房筋に類似した薬剤への応答を再現することに成功した。
1. 要旨
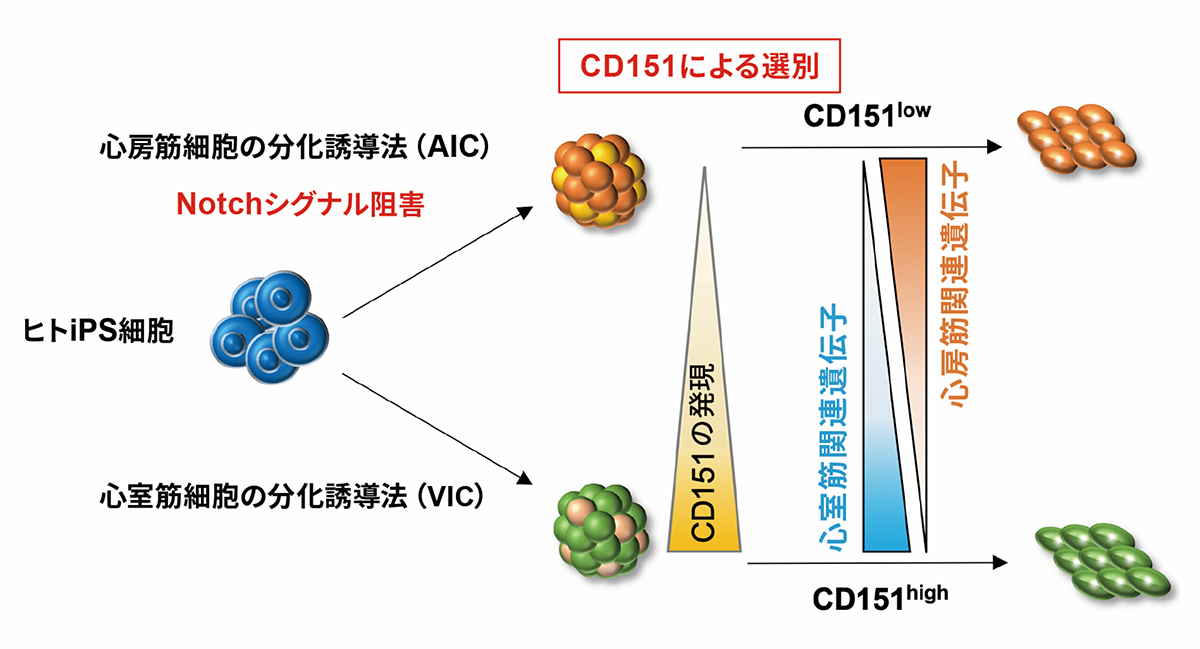
吉田善紀 准教授(CiRA増殖分化機構研究部門)らの研究グループは、ヒトiPS細胞から分化誘導した心筋細胞から、特性の異なる心室筋と心房筋を区別することのできるマーカーとしてCD151を見出しました。さらに、純化したヒトiPS細胞由来心房筋細胞を解析した結果、Notchシグナル注1)の阻害により従来よりも生体心臓組織の心筋細胞に近い機能をもつ心房筋細胞を誘導する方法を見出しました。
心筋細胞には、部位と電気生理学的な特性の異なるサブタイプが存在し、心室筋細胞、心房筋細胞、ペースメーカー細胞に分けられます。ヒトiPS細胞から心室筋や心房筋などの心筋細胞を分化誘導する既存の方法では、いずれも目的以外のサブタイプが混在した状態になることが課題となっていました。そこで、ヒトiPS細胞から分化誘導した心房と心室それぞれの心筋細胞を区別する目印(マーカー)となる細胞膜タンパク質を探索しました。
研究グループは、心室筋細胞の分化誘導法(VIC)と心房筋細胞の分化誘導法(AIC)のそれぞれで誘導した心筋細胞群(VIC-CMs, AIC-CMs)を比較し、細胞表面に存在するCD151の発現パターンが異なることを見出しました。また、遺伝子発現および電気生理学的な解析により、VICで分化誘導したCD151高発現細胞群(CD151highVIC-CMs)に心室筋細胞が多く存在し、一方、AICで分化誘導したCD151低発現細胞(CD151lowAIC-CMs)に心房筋細胞が存在することを明らかにしました。さらに、心房筋細胞を誘導するAICの過程でNotchシグナルを阻害することにより、CD151lowAIC-CMs中の心房筋細胞の割合を増やすことができ、作製した心房筋細胞は生体の心房筋に近い薬剤応答性を示しました。
本成果は、より純度と機能性の高い心房筋と心室筋細胞をヒトiPS細胞から作製することを可能にし、今後、創薬や疾患研究などに活用されることが期待されます。
この研究成果は、2024年2月28日に国際学術誌「Communications Biology」に掲載されました。
研究の概要図
2. 研究の背景
ヒトiPS細胞由来心筋細胞は、再生医療に加えて、薬剤の毒性検査や疾患研究、創薬などへの応用が期待されています。心筋細胞には、心室筋細胞や心房筋細胞、ペースメーカー細胞など、複数の種類(サブタイプ)が存在します。特に心筋への薬剤の毒性検査や疾患研究、創薬のためには、成人心臓組織に近い、成熟化した心筋細胞を作製することと、目的に応じたサブタイプの細胞を作製し使用することが重要です。
しかし、これまでに開発された心室筋細胞および心房筋細胞への分化誘導法は、どちらも他のサブタイプの細胞が混在してしまい、疾患研究や創薬などへの応用のための課題の一つとなっていました。そのため研究グループは、各心筋細胞への分化誘導後、心房筋細胞と心室筋細胞を効果的に分画できる細胞表面マーカーを探索し、ヒトiPS細胞からより純度の高い心筋細胞サブタイプを得るためのアプローチを検討しました。
3. 研究結果
1)ヒトiPS細胞から心房筋細胞と心室筋細胞を誘導する過程で発現パターンの異なるCD151の同定
研究グループはヒトiPS細胞から分化誘導した心房と心室それぞれの心筋細胞を区別する目印(マーカー)となる細胞膜タンパク質を探索しました。
その結果、細胞表面に存在するCD151が、心室筋細胞の分化誘導条件(VIC)による心筋細胞群(VIC-CMs)では高発現であるのに対して、心房筋細胞の分化誘導条件(AIC)による心筋細胞群(AIC-CMs)では発現が低いことを見出しました。そこで、CD151を心室筋と心房筋細胞を区別するマーカーの候補としてさらに解析を行いました。
VICによる心筋細胞群のうちCD151高発現細胞(CD151highVIC-CMs)では心室筋関連遺伝子の発現が高く、AICによる心筋細胞群のうちCD151低発現細胞(CD151lowAIC-CMs)では、心房筋関連遺伝子が高く発現していました(図1A)。また、電気生理学的な解析により、CD151highVIC-CMsは心室筋細胞に特徴的な活動電位注2)を示す細胞が多いことが明らかになりました。心房筋についてはCD151highAIC-CMsは心房筋細胞に特徴的な活動電位を示す細胞が認められなかったのに対して、CD151lowAIC-CMsは心房筋細胞の活動電位を示す細胞が35%存在することが明らかになりました。
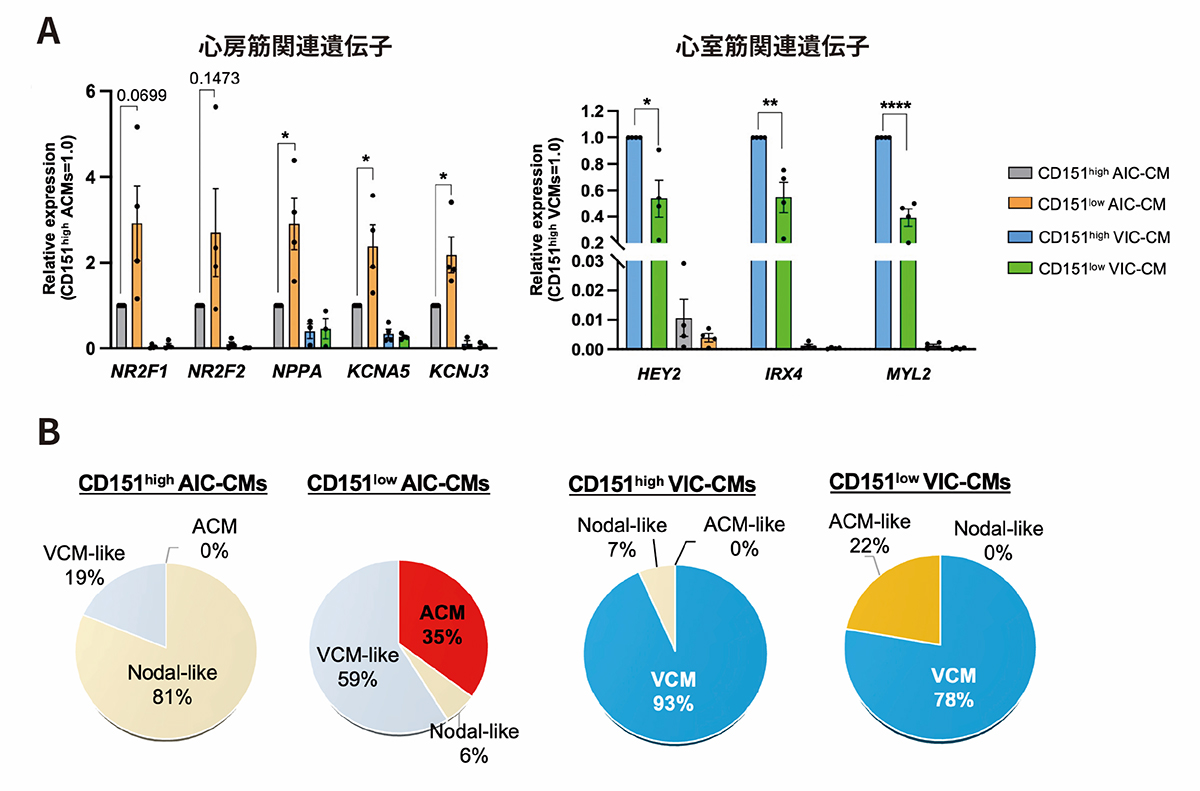
図1. CD151発現による心筋細胞の分画
A:心房筋関連遺伝子(左)および心室筋関連遺伝子(右)の発現
B:細胞の活動電位を測定し、各誘導条件(AICまたはVIC)、CD151発現ごと(高発現;CD151high、低発現;CD151low)の細胞群における心房筋細胞のサブタイプを分類した。ACM;心房筋細胞、VCM;心室筋細胞、Nodal-like;ペースメーカー細胞または未熟な心筋細胞
2)Notchシグナルの阻害による心房筋細胞誘導効率の向上
研究グループはさらに、CD151lowAIC-CMsとCD151highAIC-CMsの遺伝子発現パターンを比較し、Notchシグナルに関する遺伝子発現に多く違いがみられることを見出しました。そこで、Notch阻害剤であるLY411575を分化誘導時に添加した結果、心房筋関連遺伝子の発現が促進され、CD151lowAIC-CMsの心房筋細胞を80%にまで増やすことができました(図2A)。
また、Notchシグナルを阻害して作製したCD151lowAIC-CMs(LY/CD151lowAIC-CMs)と、CD151による分画とNotch阻害をしない従来のAIC-CMsに対して、カリウムチャネル遮断薬(4-AP)およびコリン作動薬(CCh)がどのように作用するかを調べました。その結果、従来法で作製した心房筋細胞ではこれらの薬剤に対する反応がほとんど認められなかったのに対して、LY/CD151lowAIC-CMsにおいて、どちらの薬剤の作用も確認されました(図2B,C)。この結果は、Notch阻害により作製したLY/CD151lowAIC-CMsが生体のヒト心房筋細胞の機能を再現していることを示しています。
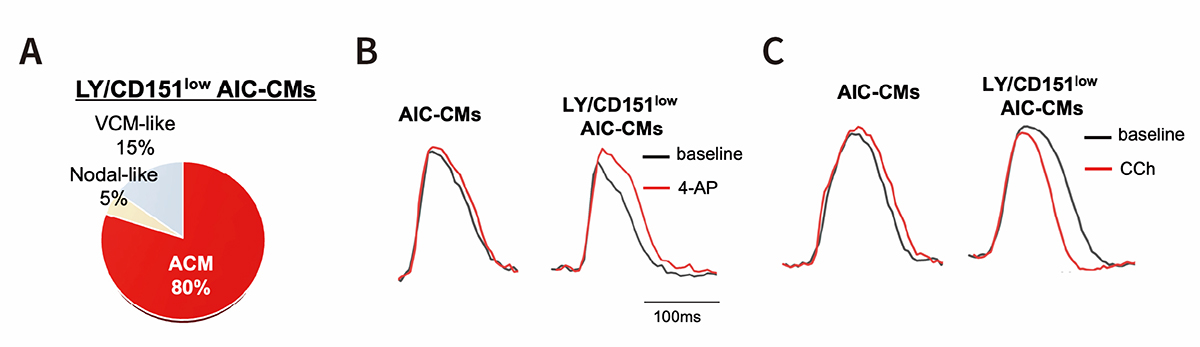
図2. Notch阻害による機能的な心房筋細胞の誘導
A:細胞の活動電位を測定し、LY/CD151lowAIC-CMsにおける心房筋細胞のサブタイプを分類した。ACM;心房筋細胞、VCM;心室筋細胞、Nodal-like;ペースメーカー細胞または未熟な心筋細胞
B:カリウムチャネル遮断薬(4-AP)を作用させたとき(赤線)、薬剤を作用していないとき(黒線)と比べてLY/CD151lowAIC-CMsの活動電位持続時間が長くなった。
C:コリン作動薬(CCh)を作用させたとき(赤線)、薬剤を作用していないとき(黒線)と比べて
LY/CD151lowAIC-CMsの活動電位持続時間が短くなった。
4. まとめと展望
今回、これまで困難であったヒトiPS細胞由来心筋細胞のサブタイプの純化に有用なマーカーを同定し、さらにその分画を比較することで、心房筋細胞の誘導効率を改善する手法を開発しました。今後、新規薬剤の心筋への毒性検査や、心筋のサブタイプ特異的な疾患などの研究や創薬に活用されることが期待されます。
5. 論文名と著者
- 論文名
CD151 expression marks atrial- and ventricular- differentiation from human induced pluripotent stem cells - ジャーナル名
Communications Biology - 著者
Misato Nakanishi-Koakutsu1,2,3, Kenji Miki1,4,5,*, Yuki Naka1,2, Masako Sasaki1,2, Takayuki Wakimizu1,2, Stephanie C Napier2,6, Chikako Okubo1, Megumi Narita1, Misato Nishikawa1, Reo Hata1, Kazuhisa Chonabayashi1,7, Akitsu Hotta1,2, Kenichi Imahashi2,6, Tomoyuki Nishimoto2,8, Yoshinori Yoshida1,2,*
*:共同責任著者 - 著者の所属機関
- 京都大学iPS細胞研究所(CiRA)
- タケダ-CiRA共同研究プログラム(T-CiRA)
- ジョンズ・ホプキンス大学医学部
- マサチューセッツ総合病院
- ハーバード大学医学部
- 武田薬品工業株式会社 リサーチ Global Advanced Platform
- 京都大学大学院 医学研究科 血液・腫瘍内科学
- オリヅルセラピューティクス株式会社
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
●タケダ-CiRA共同研究プログラム(T-CiRA)
●日本学術振興会科研費(JP18K15120, JP18KK0461, JPK16041, JP17H04176, JP21H02912)
●Leducq財団(18CVD05)
●日本医療研究開発機構(AMED)
○再生医療実現拠点ネットワークプログラム
(JP20bm0104001, JP21bm0204003, JP21bm0804008, JP21bm0804022)
○再生・細胞医療・遺伝子治療実現加速化プログラム(JP23bm1423011, JP23bm132300)
○医薬品等規制調和・評価研究事業(JP21mk0101189, JP220101241)
○橋渡し研究プログラム(JP22ym0126091)
○再生医療等実用化研究事業(JP21bk0104095)
●iPS細胞研究基金
7. 用語説明
注1)Notchシグナル
多くの多細胞生物で共通に持っている、発生過程や幹細胞における細胞運命決定を調節するシステム。特に神経や心臓、内分泌腺の発生などにおいて、細胞運命の決定に関わる多様な調節に関わっている。
注2)活動電位
心筋細胞膜では、細胞内外をナトリウムイオンやカルシウムイオン、カリウムイオンが透過するが、その透過性が刺激により変化し閾値を超えると、活動電位が発生し、それにより心臓が収縮する。