2024-04-26 帝京大学,新潟大学,国立がん研究センター,科学技術振興機構
発表のポイント
- 抗がん剤が効きにくい(抗がん剤抵抗性)難治性卵巣がん(明細胞がん)の手術検体を用いて、HIF-1陽性がん細胞とがん関連線維芽細胞(CAF)が協調して抗がん剤抵抗性を引き起こすことを発見しました。
- HIF-1陽性がん細胞が放出する増殖因子(PDGF)によりCAFが活性化し、そのCAFがHIF-1陽性 がん細胞の抗がん剤抵抗性を誘導するフィードバック制御機構の存在を明らかにしました。
- 受容体型チロシンキナーゼの阻害剤が、CAF抑制に働くこと、既存の抗がん剤との併用により明細胞がんの増殖を相乗的に阻害することを見出しました。
- 今後、この研究成果に基づき、CAFを標的としたがん治療法の開発が期待されます。
概要
帝京大学先端総合研究機構の岡本康司教授は、JST戦略的創造研究推進事業CRESTにおいて、新潟大学の森裕太郎助教、吉原弘祐教授、国立がん研究センター研究所の濱田哲暢分野長らとの共同研究で、難治性卵巣がんの治療抵抗性を、がん細胞とは異なる「がん関連線維芽細胞」(Cancer-Associated Fibroblast、CAF)注1)が引き起こしていることを発見しました。
卵巣がんはsilent killerとも呼ばれ早期発見の難しいがんです。卵巣がんはいくつかの種類に分けられますが、その中でも明細胞がんは抗がん剤が効かないことが多く、効果的な治療法の開発が強く望まれています。
本研究グループは、シングルセル解析注2)、空間的トランスクリプトーム注3)、多重抗体染色注4)、オルガノイド・スフェロイド培養注5)などの先端的解析手法を組み合わせて、明細胞がんの手術検体を解析しました。その結果、HIF-1注6)陽性がん細胞とCAFとの協調作用が抗がん剤抵抗性を引き起こしていること、がん細胞が放出する増殖因子(PDGF)注7)が、CAFの活性化を介して抗がん剤抵抗性を促進することを発見しました。さらに、受容体型チロシンキナーゼ阻害剤注8)がCAFの活性化を抑えることにより、従来の抗がん剤の抑制効果を増強することを明らかにしました。
本研究により、今後はCAFを標的とした新しい治療法の発展、および難治性卵巣がんに対する新規抗がん剤の開発が期待されます。本研究成果は、2024年4月26日(日本時間AM0時)に米国科学誌「Cell Reports Medicine」のオンライン版に掲載されました。
本成果は、以下の事業・研究領域・研究課題によって得られました。
科学技術振興機構(JST) 戦略的創造研究推進事業 チーム型研究CREST
研究領域:「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出」(研究総括:松田道行)
研究課題:「マルチオミクス1細胞解析による難治がん組織空間の数理的再構成」(グラント番号JPMJCR2122)
研究代表者:帝京大学先端総合研究機構教授 岡本康司
研究期間:2021(令和3)年10月~2027(令和9)年3月
背景
人生100年とも言われますが、国民の平均寿命が伸びるとともに、国民の二人に一人が「がん」に罹患する時代になっています。このような状況において、がんを根治する革新的な治療法の開発が待ち望まれています。多くの難治がんは従来の抗がん剤では十分に抑えることができませんが、このような抗がん剤抵抗性は再発や転移に繋がるため、がん患者の生命予後と深く関連しています。そのため、抗がん剤抵抗性が生じるメカニズムの解明が強く望まれています。
岡本教授らの研究グループは、新潟大学大学院医歯学総合研究科産科婦人科学分野の森裕太郎助教、吉原弘祐教授、榎本隆之前教授らとの共同研究で、卵巣がんの抗がん剤抵抗性メカニズムを明らかにすることを目指しました。卵巣がんは、漿液性がん、明細胞がん、粘液性がん、類内膜がんの4種類に大別されますが、その中でも日本で比較的頻度が高く抗がん剤が効きにくい明細胞がんを対象として研究を行いました。岡本教授はこれまでの研究で、シングルセル解析と呼ばれる手法を用いて、抗がん剤抵抗性を引き起こす細胞群を1細胞レベルで解析し、その特性を明らかにしてきました注9)。そこで本研究でも、シングルセル解析で抗がん剤抵抗性がんを構成する細胞組織の特性を解明することで、抗がん剤抵抗性メカニズム解明の糸口を探りました。
研究内容
明細胞がんの手術検体でシングルセル解析を行った結果、抗がん剤の効果が高い症例に比べ、効果の低い症例ではHIF-1(a型アイソフォーム)発現が上昇しているがん細胞群が増加していることが明らかになりました。得られた知見に基づき、図1に示した統合解析を行なったところ、以下のことが解明されました。
- 明細胞がん手術検体を用いて空間的トランスクリプトーム解析を行なったところ、HIF-1陽性の抵抗性がん細胞群はCAFと同じ場所に存在していることがわかりました。
- 国立がん研究センター研究所の濱田哲暢分野長との共同研究でがん細胞とCAFマーカーの多重 免疫染色解析を行い、HIF-1陽性がん細胞とCAFの増加が予後増悪と関連していることを見出しました。
- 明細胞がんの手術検体を用いてがんオルガノイド・スフェロイド培養を行い、CAFと一緒に培養(共培養)を行なって機能的に検証したところ、がん細胞が放出するPDGFが、CAFの活性化を介して抗がん剤抵抗性を促進することを発見しました。
- 共培養モデルおよび移植腫瘍モデルを用いた検証を行い、CAFの活性化は、受容体型チロシンキナーゼ阻害剤(Ripretinib)で抑えられること、さらにRipretinibは、標準治療抗がん剤(Carboplatin)のがん細胞増殖抑制効果を増強することを明らかにしました。これらの結果より明細胞がんでは、図2のような抗がん剤抵抗性を示すがん微小環境が存在し、CAFが有効な治療標的となりうると考えられました。
図1 卵巣明細胞がんの手術検体を対象にした統合解析(論文より抜粋)
シングルセル解析、空間的トランスクリプトーム、多重抗体染色、オルガノイド共培養などの統合解析を行なった。
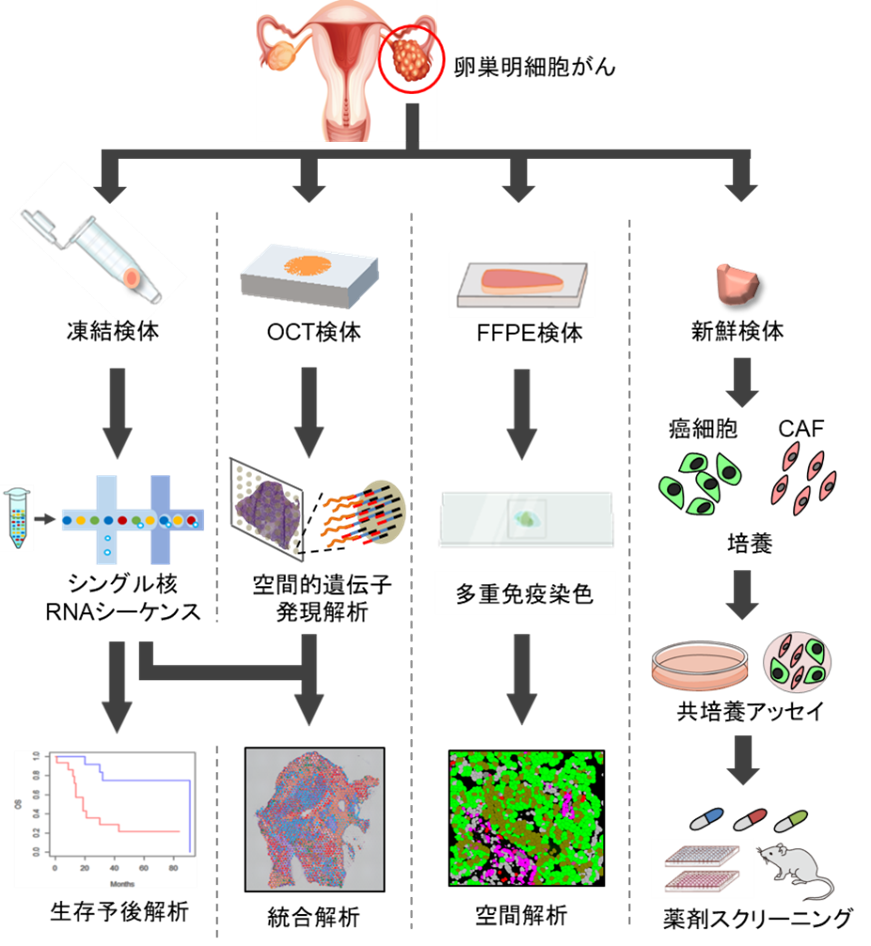
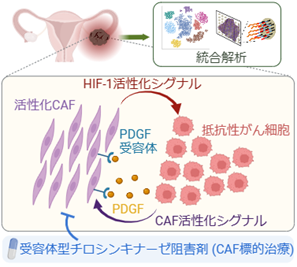
図2 抗がん剤治療抵抗性を引き起こす、卵巣明細胞がんの微小環境(論文より抜粋)
抵抗性がん細胞群より、PDGFが放出される。
がん細胞由来のPDGFは、CAFの活性化を誘導する。
活性化CAFはがん細胞のHIF-1上昇および治療抵抗性の亢進をもたらす。
受容体型チロシンキナーゼ阻害剤によるCAF活性化抑制は、既存の抗がん剤によるがん抑制効果を促進する。
展望
本研究により、今後はCAFを標的とした新しい治療法の発展、および難治性卵巣がんに対する新規抗がん剤の開発などの臨床応用への展開が期待されます。
発表論文
雑誌名
Cell Reports Medicine
タイトル
Targeting PDGF signaling of cancer-associated fibroblasts blocks feedback activation of HIF-1a and tumor progression of ovarian clear cell carcinoma
著者
Yutaro Mori, Yoshie Okimoto, Hiroaki Sakai, Yusuke Kanda, Hirokazu Ohata, Daisuke Shiokawa, Mikiko Suzuki, Hiroshi Yoshida, Haruka Ueda, Tomoyuki Sekizuka, Ryo Tamura, Kaoru Yamawaki, Tatsuya Ishiguro, Raul Nicolas Mateos, Yuichi Shiraishi, Yasushi Yatabe, Akinobu Hamada, Kosuke Yoshihara, Takayuki Enomoto, Koji Okamoto
DOI
10.1016/j.xcrm.2024.101532
掲載日
2024年4月26日 日本時間0時(オンライン)
URL
https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00201-5
用語説明
注1 がん関連線維芽細胞(Cancer-Associated Fibroblast、CAF)
CAFは、がん組織内に存在する線維芽細胞であり、がんの進行や治療への応答に影響を与えると考えられる。CAFにはいくつかのサブタイプが存在することが知られているが、これらの細胞のがん特性に与える影響は個々のがん微小環境に大きく依存する。がん促進的に働くCAFを抑制することで、新しい治療法開発に繋がることが期待されている。
注2 シングルセル解析
がん組織などの細胞多様性に富む組織を対象として、一つ一つの細胞レベルで遺伝子発現を詳細に調べる技術。この方法により、細胞集団内の多様性や個々の細胞の特性を明らかにすることが可能になった。病気の診断や新たな治療法の開発において重要な役割を果たしている。
注3 空間的トランスクリプトーム
組織や細胞サンプル内の各細胞の遺伝子発現情報をその空間的な位置情報と組み合わせて解析する技術。これにより、細胞の空間的な配置と機能の関係を明らかにし、組織の構造と遺伝子発現パターンの相関を理解することが可能になった。疾患の研究や組織の微細な構造解析において重要な役割を果たしている。
注4 多重抗体染色
特異的抗体を用いて、複数のタンパク質の発現を同一組織切片上で検証する蛍光多重免疫組織化学技術。本研究では、Vectra Polaris(Akoya Biosciences社)による多光スペクトルイメージングシステムが用いられた。
注5 オルガノイド・スフェロイド培養
実際の臓器の構造や機能を模倣する微小な3D細胞集合体を実験室内で育てる培養技術であり、特定の臓器に特有の細胞や組織構造を再現しうると考えられている。がんを含めた疾患モデルの作成、薬剤スクリーニング、再生医療などの研究に利用されている。
注6 HIF-1(Hypoxia-Inducible Factor 1)
低酸素状態に反応して活性化し、遺伝子の発現を調節する転写因子として発見された。HIF-1の活性化は、がんの進行や虚血性疾患など、さまざまな病態の発生と深く関連する。本研究においては、低酸素以外の要因による誘導の可能性も考えられている。
注7 PDGF(Platelet-Derived Growth Factor)
血小板由来成長因子と呼ばれ、細胞の増殖や分化を促進するタンパク質。傷の治癒、血管新生、線維芽細胞の活性化などの生理的プロセスに関与し、細胞膜レセプターへの結合を介して、さまざまな細胞タイプの成長と発達を調節する。過剰なPDGFシグナルはがん病態の進行に関与することも知られている。
注8 受容体型チロシンキナーゼ阻害剤
細胞表面にある特定の受容体型チロシンキナーゼの活性を阻害する薬剤であり、がん細胞の成長や 分裂を促進するシグナル伝達経路を遮断することで、さまざまながん腫の治療に用いられる。
注9
Shiokawa et al., 2020, Cancer Res., vol.80, 4451-4464, DOI: 10.1158/0008-5472.CAN-20-0378
Ohata et al., 2023, Cell Rep., vol.42, 112519, DOI: 10.1016/j.celrep.2023.112519. Epub 2023
お問い合わせ先
研究に関するお問合せ
学校法人帝京大学
帝京大学先端総合研究機構教授 岡本康司
JST事業に関するお問い合わせ
国立研究開発法人科学技術振興機構 戦略研究推進部ライフイノベーショングループ 保田睦子
広報窓口
学校法人帝京大学 本部広報課
国立大学法人新潟大学 広報事務室
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室
国立研究開発法人科学技術振興機構 広報課