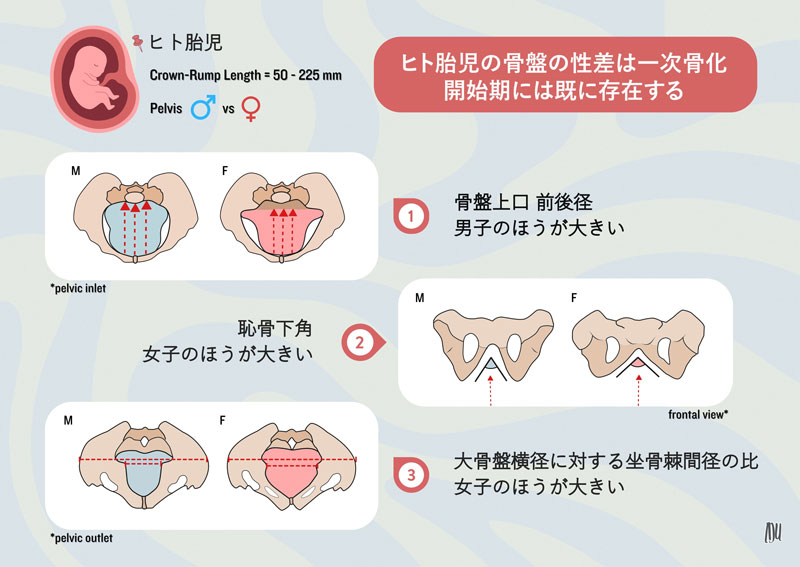
2024-05-17 理化学研究所,京都大学,科学技術振興機構
理化学研究所(理研)開拓研究本部の塩見 晃史 基礎科学特別研究員、金子 泰洸ポール 特別研究員(研究当時、現京都大学 医生物学研究所 助教)、西川 香里 テクニカルスタッフⅠ、新宅 博文 理研白眉研究チームリーダー(京都大学 医生物学研究所 教授)らの共同研究グループは、1細胞の力学的性質(細胞表面張力)と遺伝子発現を同時かつ大規模に測定する手法を開発しました。
本研究成果は、老化や細胞分化、がん細胞の浸潤といった細胞の力学的性質が関わるさまざまな生命現象・疾患に関与する遺伝子制御メカニズムの理解に貢献すると期待されます。
今回共同研究グループは、エレクトロポレーション[1]による細胞内への物質輸送技術と1細胞RNAシーケンシング[2]を組み合わせることにより、1細胞の機械特性と遺伝子発現を同時かつ大規模に測定する手法を開発し、この手法を「ELASTomics」と名付けました。また、ヒトTIG-1細胞[3]を用いて、RRAD[4]が、細胞老化における細胞表面張力の増加を誘導している因子である可能性を示しました。
本研究は、科学雑誌『Nature Communications』オンライン版(5月17日付:日本時間5月17日)に掲載されました。
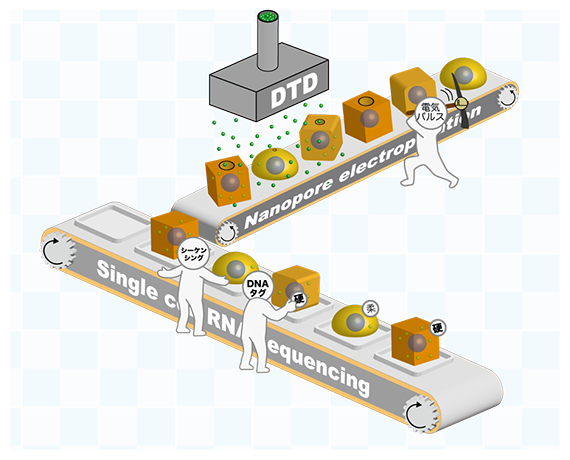
細胞の硬さ・柔らかさと遺伝子発現が同時に分かる測定手法「ELASTomics」
背景
近年、細胞の硬さ・柔らかさ、張り、変形しやすさ、といった細胞の力学的性質である機械特性は、さまざまな生命現象や病態につながる重要な因子であり、細胞生物学的な機能の理解に重要であることが明らかになってきました。例えば、老化に伴う細胞の硬化は、血管変性、心臓機能障害などの病状の発症に関連していることが分かっています注1)。そこで、細胞の機械特性と細胞の機能を制御する根幹である遺伝子発現を関連付けた情報の取得が強く求められていました。
細胞の機械特性の測定には原子間力顕微鏡(AFM)[5]が広く活用されていますが、機械特性を測定した細胞を遺伝子発現解析結果と関連付けることができないため、細胞の機械特性と遺伝子発現解析を同時に分析・比較することは困難でした。そのため、単一細胞の機械特性がどのように制御されているのか、遺伝子レベルで明らかになっていることは多くありません。
注1)Zieman, Susan J., Vojtech Melenovsky, and David A. Kass. “Mechanisms, pathophysiology, and therapy of arterial stiffness.” Arteriosclerosis, thrombosis, and vascular biology, 25.5 (2005): 932-943.
研究手法と成果
共同研究グループは、ナノポアエレクトロポレーションにより一時的に形成される10ナノメートル(nm、1nmは10億分の1メートル)前後の穴(ナノポア)から、DNAタグを付加したデキストラン[6](DTD)を細胞内に導入しました。その後、DTDが導入された細胞を1細胞RNAシーケンシングで分析して1細胞内のDNAタグを数えることで、細胞表面張力の大きさと遺伝子発現情報を同時かつ大規模に測定することに成功しました。その測定手法をELASTomics(Electroporation-based Lipid-bilayer Assay for cell Surface Tension and transcriptomics)と名付けました。
ナノポアの大きさは、細胞表面張力に依存し、細胞表面張力が低いと小さくなり、細胞表面張力が高いと大きくなります。また、細胞内に導入されるDTDの量は、ナノポアの大きさに依存し、ナノポアが小さいと少なく、ナノポアが大きいほど多くなります(図1)。つまり、細胞表面張力の大きさと1細胞内のDTDの量が相関しています。要するに、1細胞内のDTDの量が、少ないと細胞表面張力は弱く細胞が柔らかい一方、多いと細胞表面張力は強く細胞が硬いということです。
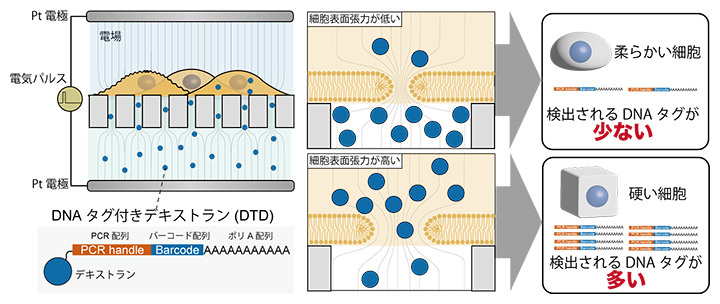
図1 ELASTomicsの概略図
直径100nmという微小な穴が空いた膜の上に細胞を貼り付け、5ミリ秒(ms)の短時間の電気パルスを細胞に照射する。すると、穴の直上にある細胞膜にだけ、一時的に数nm~18nmのさらに小さな穴(ナノポア)が形成される。その時、DNAタグが付いたデキストラン(DTD)をナノポアから細胞内へと輸送し、その後1細胞RNAシーケンシングを行うと、硬い(細胞表面張力が高い)細胞ほど多くのDNAタグが検出される。
まず、細胞膜の硬さ(膜張力)の異なる3種類のがん細胞(PC-3、MDA-MB-231、MCF7)と正常な乳房上皮細胞(MCF10A)に対してELASTomicsを行ったところ、DTDの輸送量は最も膜張力の高いMCF10Aが最大でした。次いでMCF7、MDA-MB-231、PC-3という順に各細胞株の平均膜張力が高いほど、検出されるDTDは増加していました。また、DTDの代替物(蛍光標識付きウシ血清アルブミン)をELASTomicsによりMCF10A細胞内へ輸送後、それぞれのMCF10A細胞の膜張力をAFMで測定したところ、輸送量と実際の細胞の膜張力には高い相関がありました。
これらの培養細胞を使った実験から、ELASTomicsは、細胞種ごとの細胞表面張力の違いだけでなく、個々の細胞の細胞表面張力の違いも検出できることが分かりました。さらに、老化研究でも広く用いられている培養細胞TIG-1を長期間培養して細胞老化を誘導し、ELASTomicsを用いて若いTIG-1細胞と老化したTIG-1細胞の細胞表面張力を比較して、細胞老化に伴う細胞の機械特性の変化の制御メカニズムを解析しました。その結果、老化により細胞表面張力が高くなっていました(図2)。
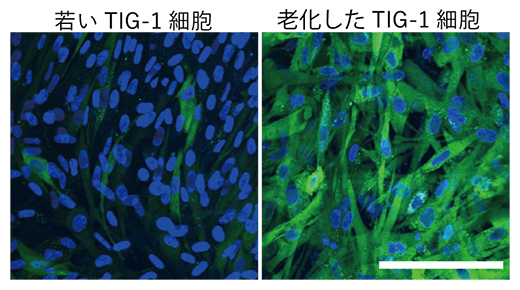
図2 細胞老化によるTIG-1細胞の硬化
ナノポアエレクトロポレーションによりTIG-1細胞にDTDの代わりに蛍光物質(FITC-BSA)を輸送したときの蛍光画像。青色が細胞の核、緑色が輸送された蛍光物質を示している。老化したTIG-1細胞では輸送された蛍光物質が多く、細胞表面張力が大きいことが分かる。スケールバーは0.1mm。
次に、ELASTomicsにより取得した細胞表面張力と遺伝子発現の相関情報を解析して、RRAD遺伝子の発現量と細胞表面張力の間に高い相関が認められました。RRADは、GLUT1と呼ばれる細胞がグルコースを細胞内に取り込むために必要なタンパク質の働きを妨げ、糖代謝を阻害する機能を持っていることが報告されており注2)、実際に若いTIG-1細胞の糖代謝を阻害すると、老化したTIG-1細胞と同様に細胞表面張力が上昇しました。これらの結果は、細胞老化による細胞表面張力の上昇に、RRADを介した糖代謝の抑制が関わっていることを示しています。
注2)Zhang, Cen, et al. “Tumor suppressor p53 negatively regulates glycolysis stimulated by hypoxia through its target RRAD.” Oncotarget, 5.14 (2014): 5535.
今後の期待
本研究では、細胞の機械特性と遺伝子発現情報を関連付けた情報を取得できるELASTomicsという測定手法を開発し、実際にELASTomicsを用いて細胞表面張力をシーケンシング情報として読み出すことに成功しました。この成果により、1細胞の表面張力と遺伝子発現を同時かつ大規模に測定することが可能となりました。また、ELASTomicsを用いることで、老化だけではなく、細胞分化やがん細胞の浸潤といった細胞の機械特性の関わるさまざまな生命現象・疾患に関与する遺伝子制御メカニズムが解明されることが期待されます。
例えば、悪性度の高いがん細胞は、組織の隙間に入り込めるよう非常に柔らかい(細胞表面張力が低い)ことが分かっています。今後、ELASTomicsを用いて、細胞の機械特性を特徴付ける遺伝子発現を探索することが可能となり、悪性度の高いがん細胞を選択的に攻撃できる治療薬の開発につながる可能性があります。共同研究グループは、そのような病態解析に基づく治療法の考案を目指して、ELASTomicsの技術実装を進めていきます。
補足説明
1.エレクトロポレーション
短パルスの電場を細胞に照射して、細胞膜にナノサイズの穴を一時的に形成し、この穴より蛍光物質やDNAやRNAなどの高分子を細胞内に導入する技術の一つで、電気穿孔(せんこう)法とも呼ばれる。ナノポアエレクトロポレーションは近年開発された技術で、従来の方法よりも安定的に細胞内への導入が可能。
2.1細胞RNAシーケンシング
一つの細胞に含まれるmRNAを包括的に検出する技術。細胞に含有されるmRNAの量は微量なため、以前は多量の細胞が必要だったが、近年の技術進展により1細胞レベルでの解析が実現している。
3.TIG-1細胞
東京都老人総合研究所(現:東京都健康長寿医療センター研究所)にて日本人の女性胎児の肺組織から単離された培養細胞。細胞増殖を繰り返すことで老化様の表現型が現れることから、老化研究のモデルとして用いられている。
4.RRAD
細胞内タンパク質の一つで、老化により発現が向上することが知られている。RRADはRas Related Glycolysis Inhibitor And Calcium Channel Regulatorの略。
5.原子間力顕微鏡(AFM)
カンチレバーの先端に備えられた探針で試料の表面をなでるように走査し、探針のたわみから細胞の弾性率や表面張力、試料表面の構造を画像として得る手法。AFMはAtomic-Force Microscopyの略。
6.デキストラン
多糖類の一種で、細胞に対する毒性と分解性が低い。
共同研究グループ
理化学研究所
開拓研究本部
新宅マイクロ流体工学理研白眉研究チーム
基礎科学特別研究員 塩見 晃史(シオミ・アキフミ)
特別研究員(研究当時)金子 泰洸ポール(カネコ・タイコウポール)
(現 京都大学 医生物学研究所 助教)
テクニカルスタッフⅠ 西川 香里(ニシカワ・カオリ)
テクニカルスタッフⅡ 土田 新(ツチダ・アラタ)
理研白眉研究チームリーダー 新宅 博文(シンタク・ヒロフミ)
(京都大学 医生物学研究所 教授)
伊藤ナノ医工学研究室(研究当時)
専任研究員(研究当時)礒島 隆史(イソシマ・タカシ)
(現 光量子工学研究センター 技術基盤支援チーム 専任研究員)
環境資源科学研究センター 質量分析・顕微鏡解析ユニット
上級技師 豊岡 公徳(トヨオカ・キミノリ)
技師 佐藤 繭子(サトウ・マユコ)
豊橋技術科学大学
教授 土井 謙太郎(ドイ・ケンタロウ)
筑波大学医学医療系血液内科
准教授 錦井 秀和(ニシキイ・ヒデカズ)
研究支援
本研究は、理化学研究所基礎科学特別研究員制度・独創的研究提案制度の支援により実施し、科学技術振興機構(JST)戦略的創造研究推進事業(CREST)「RNA movieによる多細胞運命分岐のダイナミクスアノテーション(研究代表者:新宅博文、JPMJCR2124)」、日本学術振興会(JSPS)科学研究費助成事業挑戦的研究(開拓)「ナノ電気穿孔を用いた1細胞ダイナミクス計測法の創成(研究代表者:新宅博文、JP21K18194)」、同若手研究「1細胞の機械特性と遺伝子発現解析の統合(研究代表者:塩見晃史、JP22K15113)」、同学術変革領域研究(A)「細胞の遺伝子発現と力学的境界条件が織りなすオルガノイドの生体秩序(研究代表者:塩見晃史、JP23H04724)」、同国際共同研究加速基金(国際共同研究強化(B))「脂質分子動態に基づく骨格筋再生機構の全容解明(研究分担者:塩見晃史、JP21KK0174)」の助成を受けて行われました。
原論文情報
Akifumi Shiomi, Taikopaul Kaneko, Kaori Nishikawa, Arata Tsuchida, Takashi Isoshima, Mayuko Sato, Kiminori Toyooka, Kentaro Doi, Hidekazu Nishikii, and Hirofumi Shintaku, “High-throughput mechanical phenotyping and transcriptomics of single cells”, Nature Communications, 10.1038/s41467-024-48088-5
発表者
理化学研究所 開拓研究本部 新宅マイクロ流体工学理研白眉研究チーム
基礎科学特別研究員 塩見 晃史(シオミ・アキフミ)
特別研究員(研究当時)金子 泰洸ポール(カネコ・タイコウポール)
(現 京都大学 医生物学研究所 助教)
テクニカルスタッフⅠ 西川 香里(ニシカワ・カオリ)
理研白眉研究チームリーダー 新宅 博文(シンタク・ヒロフミ)
(京都大学 医生物学研究所 教授)
報道担当
理化学研究所 広報室 報道担当
京都大学 渉外・産学連携部広報課国際広報室
科学技術振興機構 広報課
JST事業に関すること
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
保田 睦子(ヤスダ・ムツコ)