2024-06-27 東京大学
発表のポイント
- 大腸菌のゲノムに存在するIS621転移因子はIS621リコンビナーゼとブリッジRNAを産生する。
- IS621リコンビナーゼはブリッジRNAと複合体を形成し、ブリッジRNAと相補的なドナーDNAおよびターゲットDNAのあいだの組換え反応を触媒する。
- クライオ電子顕微鏡解析により、IS621リコンビナーゼ-ブリッジRNA-ドナーDNA-ターゲットDNA複合体の立体構造を決定し、RNA依存性DNA組換えメカニズムを解明した。
- IS621リコンビナーゼはこれまでの常識を覆す「プログラム可能な」DNA組換え酵素であり、次世代ゲノムデザインツールとしての利用が期待される。
ブリッジRNAが橋渡しするDNA組換え
概要
東京大学先端科学技術研究センターの西増弘志教授らのグループは、アーク研究所(Arc Institute)のパトリック スー(Patrick D. Hsu)博士らのグループとの共同研究により、大腸菌由来のIS621転移因子はIS621リコンビナーゼ(注1)とブリッジRNA(注2)を産生すること、および、IS621リコンビナーゼはブリッジRNAと複合体を形成し、ブリッジRNAと相補的なドナーDNA(注3)およびターゲットDNA(注4)のあいだの組換え反応を触媒することを明らかにしました(論文1)。さらに、クライオ電子顕微鏡解析(注5)により、IS621リコンビナーゼ-ブリッジRNA-ドナーDNA-ターゲットDNA複合体の立体構造を決定し、新規のDNA組換えメカニズムを解明しました(論文2)。IS621リコンビナーゼはこれまでの常識を覆す「プログラム可能な」DNA組換え酵素であり、次世代ゲノムデザインツールとしての利用が期待されます。本研究成果は、2024年6月26日(英国夏時間)に英国科学誌「Nature」に2報同時掲載されました。
-研究者からのひとこと-
IS621リコンビナーゼはブリッジRNAと協働してドナーDNAとターゲットDNAを認識し、4本のDNA鎖のうち2本の切断・交換・結合を触媒したのち、さらに残りの2本の切断と交換を触媒するという、これまでの常識を覆すRNA依存性DNA組換え酵素であることが明らかになりました。このような酵素が存在するとは、全く予想していませんでした。自然は驚きに満ちています!(東京大学先端科学技術研究センター西増弘志教授)
発表内容
挿入配列因子(注6)は原核生物のゲノムに存在する転移因子であり、自身の転移を触媒するトランスポザーゼ(注7)をコードする遺伝子、および、両末端の逆向き反復配列から構成されます。通常、挿入配列因子はトランスポザーゼによって切り出され、新たなゲノム領域に挿入されます。一方、IS110ファミリー因子は通常の挿入配列因子と異なり、環状DNA中間体としてゲノムDNAから切り出されたのち、特定のゲノム領域に転移します(図1)。IS110ファミリー因子の転移には、RuvCドメインとTnpドメインからなる特徴的なIS110リコンビナーゼが関与することが報告されていましたが、その転移メカニズムは不明でした。
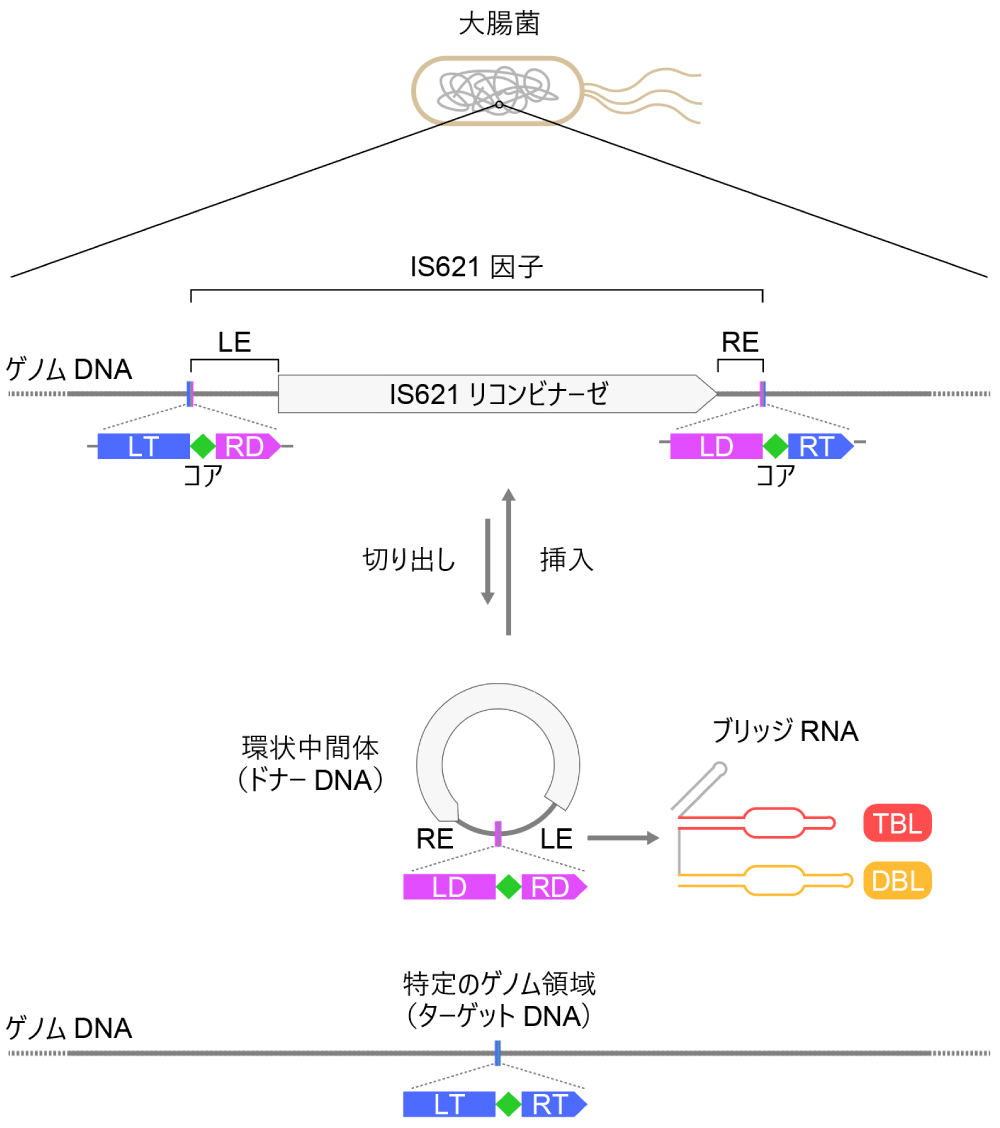
図1:IS621 因子の転移サイクル
大腸菌のゲノムに存在するIS621因子は、IS621リコンビナーゼ遺伝子、レフトエンド(LE)、ライトエンド(RE)からなる。IS621因子は環状DNA中間体(ドナーDNA)として切り出され、ゲノム中の特定の領域(ターゲットDNA)に組み込まれる。ドナーDNAとターゲットDNAのあいだの組換え反応は、それらに共通するコア配列(シトシン塩基とチミン塩基からなる2塩基)の付近で起こる。ドナーDNAはレフトドナー(LD)配列、コア配列、ライトドナー(RD)配列をもつ。一方、ターゲットDNAはレフトターゲット(LT)配列、コア配列、ライトターゲット(RT)配列をもつ。今回の研究から、環状DNA中間体のレフトエンドからブリッジRNAが産生されることが明らかになった。IS621因子のゲノムからの切り出しのメカニズムは不明である。
今回、本研究チームはバイオインフォマティクス解析、分子生物学的解析、および、生化学的解析を組み合わせることにより、IS110ファミリー因子に属する大腸菌由来IS621因子は、IS621リコンビナーゼに加え、非コードRNA(注8)を産生することを発見しました。さらに、この非コードRNAは、ドナーDNAと結合するドナー結合ループ(DBL)、および、ターゲットDNAと結合するターゲット結合ループ(TBL)をもち、IS621リコンビナーゼが触媒するDNA組換え反応において、ドナーDNAとターゲットDNAを橋渡しする役割を担うことが明らかになりました。したがって、この非コードRNAをブリッジRNAと命名しました。重要なことに、DBLとTBLのDNA結合領域の塩基配列は変更可能であるため、IS621リコンビナーゼとブリッジRNAを用いることにより、さまざまな塩基配列をもつドナーDNAとターゲットDNAのあいだの組換えが可能です(図2)。すなわち、IS621リコンビナーゼは前例のない「プログラム可能な」RNA依存性DNA組換え酵素であることが明らかになりました。したがって、IS621リコンビナーゼは遺伝子ノックインなどのゲノムエンジニアリングやゲノムデザインといった大規模なゲノム改変技術への応用が期待されます。
近年の研究から、原核生物に由来するCas9タンパク質はガイドRNAと複合体を形成し、ガイドRNAと相補的なターゲットDNAを切断する「プログラム可能な」RNA依存性DNA切断酵素であることが発見され、ゲノム編集などさまざまな新規技術に応用されています(2020年ノーベル化学賞)。既知のリコンビナーゼは自身のアミノ酸残基を用いてドナーDNAおよびターゲットDNAの塩基配列を認識し、それらのあいだの組換え反応を触媒します。Cas9が触媒するDNA切断反応に比べ、リコンビナーゼが触媒するDNA組換え反応は、4本のDNA鎖の切断、交換、再結合からなる極めて複雑な反応であるため、RNA依存性リコンビナーゼは存在しないと考えられていました。したがって、今回の研究成果は生物学の常識を覆す発見といえます。(論文1)
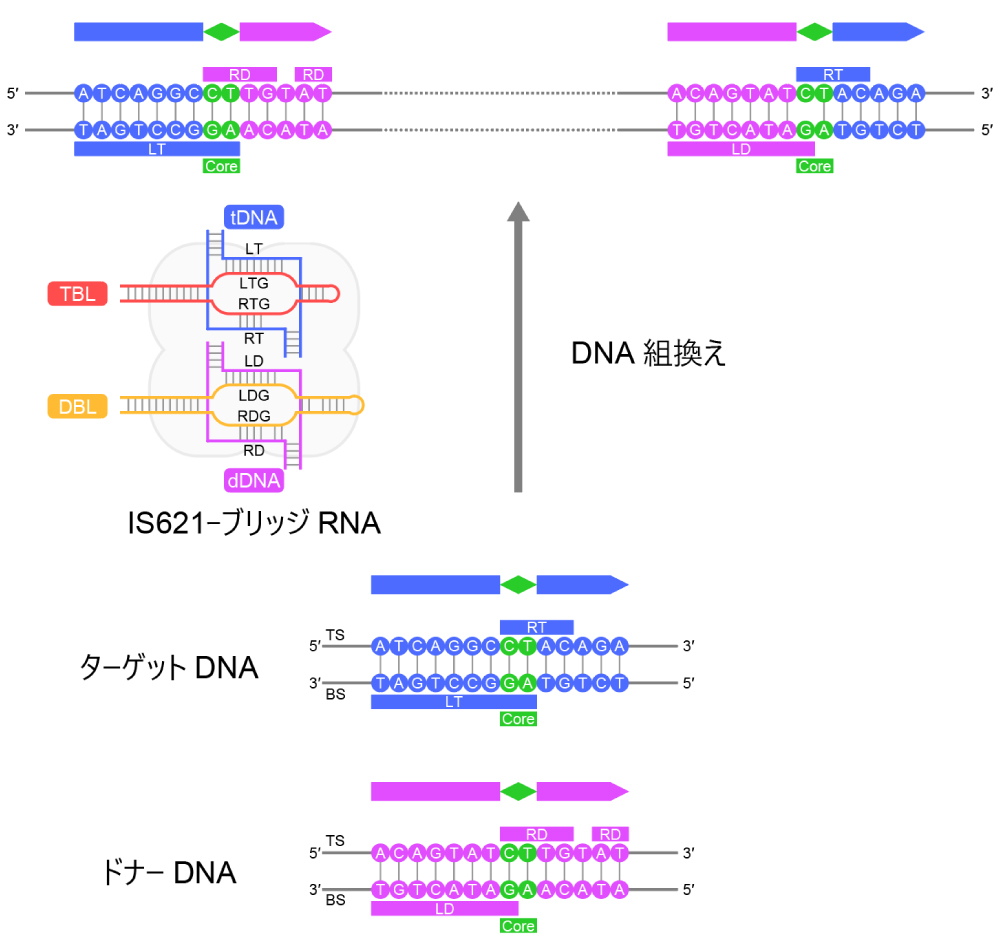
図2:IS621リコンビナーゼとブリッジRNAが触媒するDNA組換え反応
IS621リコンビナーゼはブリッジRNAと複合体を形成し、TBLおよびDBLと相補的なターゲットDNA(tDNA)およびドナーDNA(dDNA)のあいだの組換え反応を触媒する。TBLのレフトターゲットガイド(LTG)領域、ライトターゲットガイド(RTG)領域は、tDNAのボトム鎖(BS)に含まれるレフトターゲット(LT)領域、トップ鎖(TS)に含まれるライトターゲット(RT)領域とそれぞれ塩基相補性をもつ。同様に、DBLのレフトドナーガイド(LDG)領域、ライトドナーガイド(RDG)領域は、dDNAのレフトドナー(LD)領域、ライトドナー(RD)領域とそれぞれ塩基相補性をもつ。
次に、本研究チームは、クライオ電子顕微鏡解析を行い、IS621リコンビナーゼ-ブリッジRNA-ドナーDNA-ターゲットDNA複合体の立体構造を決定しました。その結果、4分子のIS621リコンビナーゼ(IS621.1~IS621.4)、TBL、DBL、ターゲットDNA、ドナーDNAが複合体を形成していることが明らかになりました(図3)。2分子のIS621リコンビナーゼ(IS621.1/IS621.2およびIS621.3/IS621.4)からなる二量体が、それぞれTBLおよびDBLに結合し、ターゲットDNAおよびドナーDNAを認識していました。
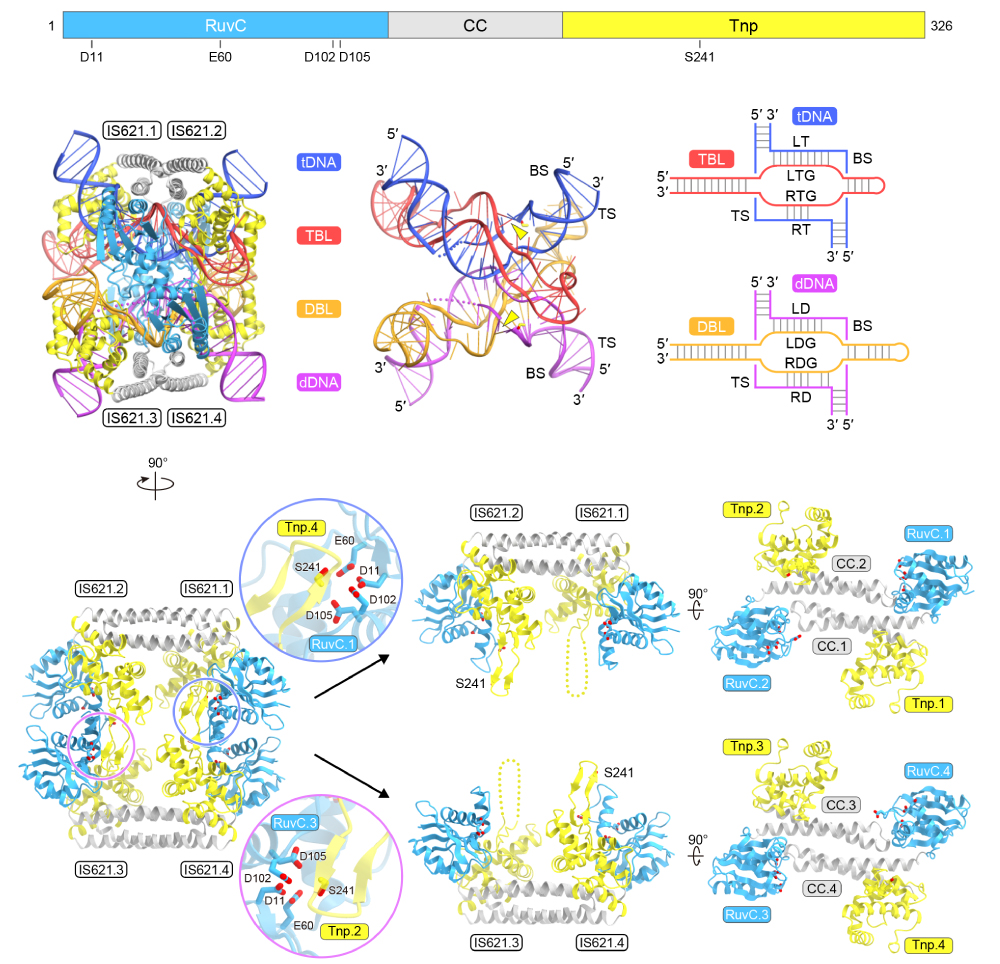
図3:IS621-ブリッジRNA-ドナーDNA-ターゲットDNA複合体の立体構造(トップ鎖交換前の状態)
IS621リコンビナーゼはRuvCドメイン、コイルドコイル(CC)ドメイン、Tnpドメインからなる。RuvCドメインは保存された4つのアミノ酸残基(D11、E60、D102、D105)を含み、Tnpドメインは触媒セリン残基S241を含む。IS621リコンビナーゼ-ブリッジRNA-ドナーDNA-ターゲットDNA複合体は、4分子のIS621リコンビナーゼ、TBL、DBL、ターゲットDNA(tDNA)、ドナーDNA(dDNA)からなる。IS621.1のRuvCドメインとIS621.4のTnpドメインが形成する酵素活性部位において、tDNAのトップ鎖が切断され、IS621.4のS241と共有結合中間体が形成される。同様に、IS621.2のTnpドメインとIS621.3のRuvCドメインが形成する酵素活性部位において、dDNAのトップ鎖が切断され、IS621.2のS241と共有結合中間体が形成される。
機能解析の結果と一致して、TBLはターゲットDNAの両鎖(トップ鎖とボトム鎖)と塩基対を形成していました(図4)。同様に、DBLはドナーDNAと塩基対を形成していました(図4)。IS621.1のRuvCドメインとIS621.4のTnpドメインが形成する酵素活性部位において、ターゲットDNAのトップ鎖が切断され、IS621.4の触媒セリン残基S241と共有結合中間体を形成していました。同様に、IS621.2のTnpドメインとIS621.3のRuvCドメインが形成する酵素活性部位において、ドナーDNAのトップ鎖が切断され、IS621.2のS241と共有結合中間体を形成していました。したがって、この複合体構造はターゲットDNAおよびドナーDNAのトップ鎖が交換される直前の状態をとらえたものであることがわかりました。
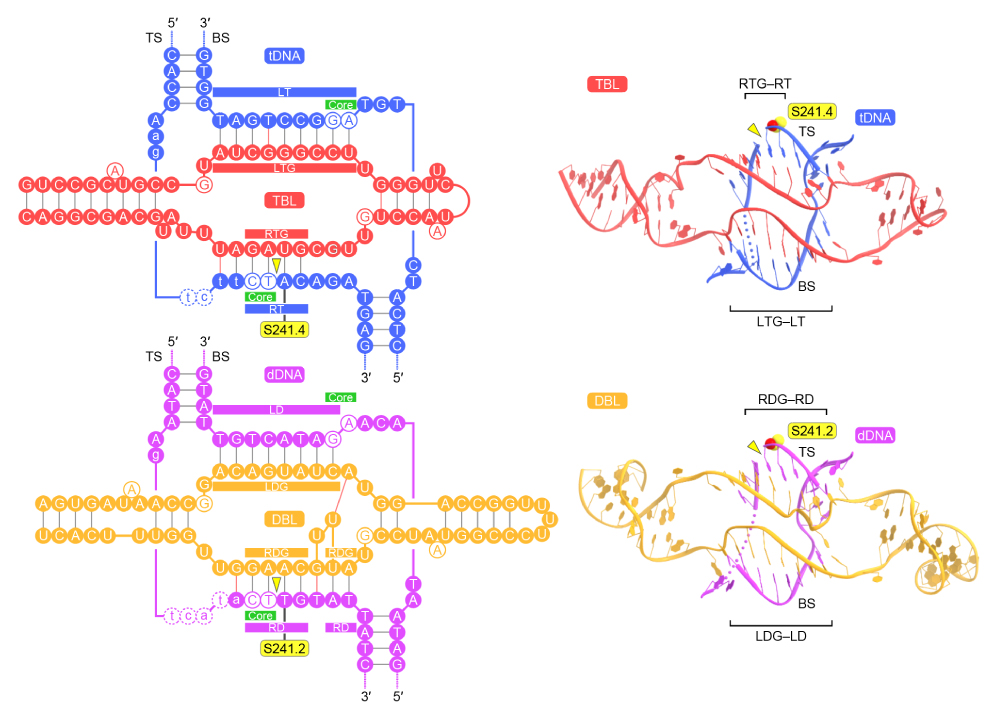
図4:ブリッジRNAによるドナー・ターゲットDNA認識機構
TBLのレフトターゲットガイド(LTG)領域、ライトターゲットガイド(RTG)領域は、ターゲットDNA(tDNA)のボトム鎖(BS)に含まれるレフトターゲット(LT)領域、トップ鎖(TS)に含まれるライトターゲット(RT)領域とそれぞれ塩基対を形成する。同様に、DBLのレフトドナーガイド(LDG)領域、ライトドナーガイド(RDG)領域は、ドナーDNA(dDNA)のBSに含まれるレフトドナー(LD)領域、TSに含まれるライトドナー(RD)領域とそれぞれ塩基対を形成する。DNA切断部位を黄色の三角形で示した。
さらに、トップ鎖交換後の構造を安定化する塩基配列をもつターゲットDNAおよびドナーDNAを用いてクライオ電子顕微鏡解析を行い、トップ鎖交換後の2つの状態(ボトム鎖切断前後の2状態)の立体構造の決定にも成功しました(図5)。
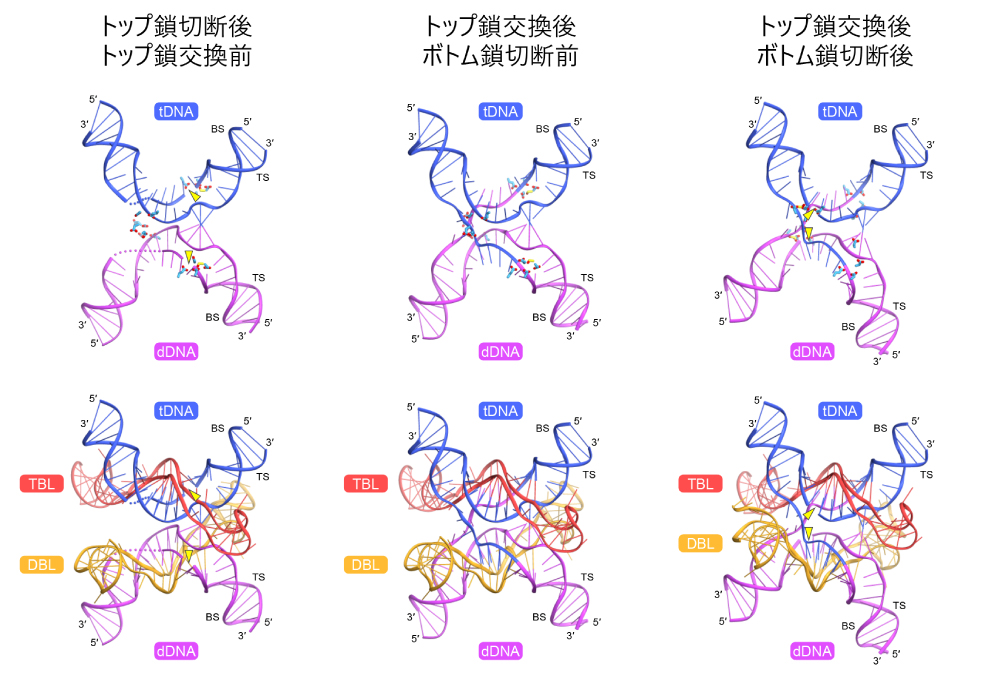
図5:IS621-ブリッジRNA-ドナーDNA-ターゲットDNA複合体の立体構造(トップ鎖交換前後の比較)
トップ鎖交換前の状態とは異なり、IS621.1のTnpドメインとIS621.4のRuvCドメインが形成する酵素活性部位において、dDNAのボトム鎖が切断され、IS621.1のS241と共有結合中間体が形成される。同様に、IS621.2のRuvCドメインとIS621.3のTnpドメインが形成する酵素活性部位において、dDNAのボトム鎖が切断され、IS621.3のS241と共有結合中間体が形成される。見やすさのため、IS621リコンビナーゼは表示していない。DNA切断部位を黄色の三角形で示した。
これら3つの反応中間体構造の比較から、IS621リコンビナーゼはブリッジRNAと協働し、ドナーDNAとターゲットDNAのあいだのDNA組換え反応を触媒する分子メカニズムが明らかになりました(図6)。(論文2)
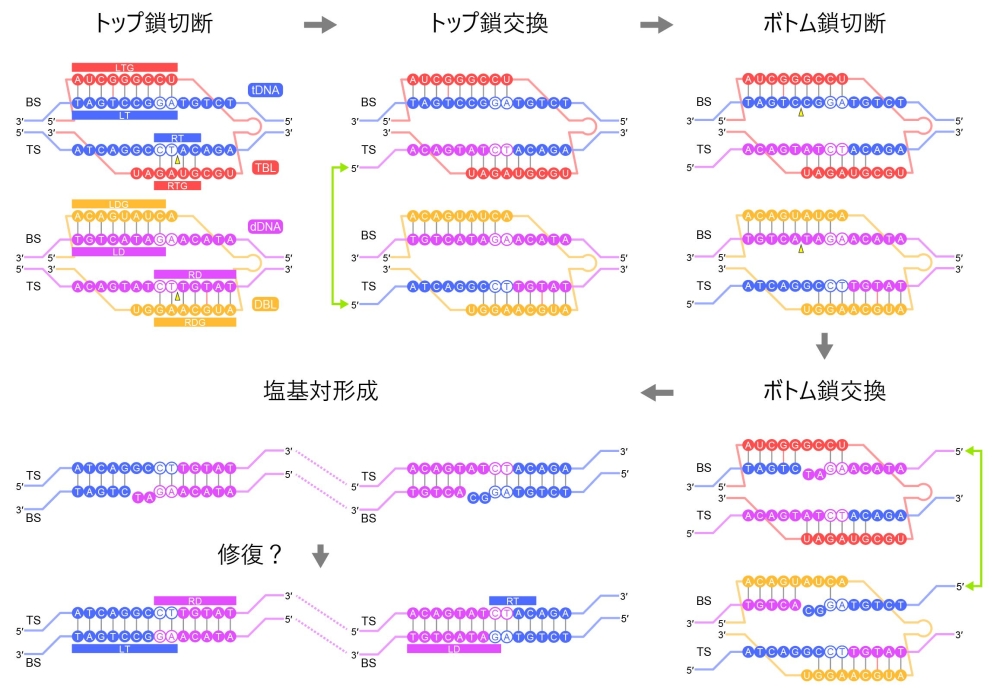
図6:IS621リコンビナーゼによるブリッジRNA依存的なDNA組換えメカニズム
ターゲットDNA(tDNA)およびドナーDNA(dDNA)のトップ鎖(TS)が切断され、S241と共有結合中間体が形成される。次に、tDNAおよびdDNAのTSの交換・再結合が起きたのち、ボトム鎖(BS)の切断・交換が起こる。最終的に、ミスマッチ塩基が修復され、組換え反応が完了すると考えられる。
IS110リコンビナーゼとブリッジRNAを用いたプログラム可能なDNA組換えシステムは、CRISPR-Cas9では不可能だった長鎖DNAノックインなどの大規模なゲノム改変を可能とする次世代ゲノムデザインツールとしての利用が期待されます(図7)。
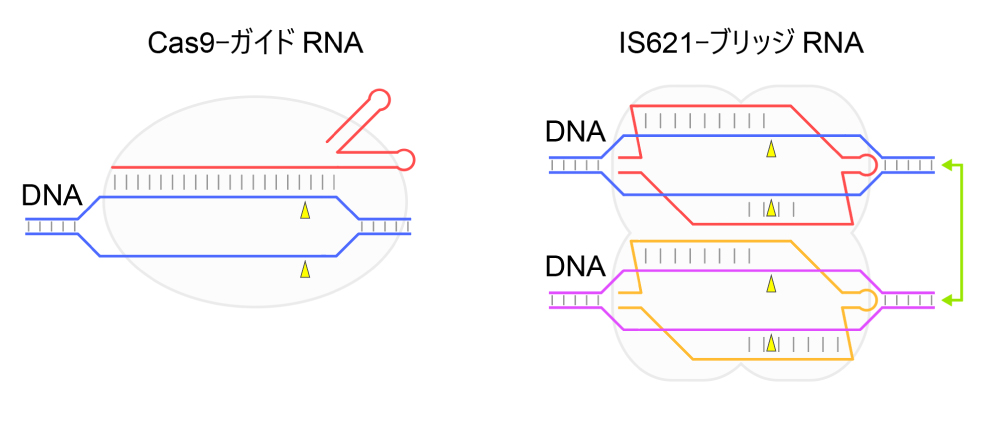
図7:Cas9とIS621の比較
Cas9はガイドRNAと複合体を形成し、ガイドRNAのガイド領域と相補的なDNAを切断するため、ゲノム編集などに利用されている。IS621リコンビナーゼはブリッジRNAと複合体を形成し、ブリッジRNA中のガイド領域と相補的な2分子のDNAのあいだの組換え反応を触媒する。Cas9のガイドRNAは1か所のガイド領域を含み、ターゲットDNAと1組のRNA-DNA二重らせんを形成する。一方、IS621のブリッジRNAは4か所のガイド領域を含み、ターゲットDNAおよびドナーDNAと4組のRNA-DNA二重らせんを形成する。Cas9はターゲットDNAの切断反応を触媒するのに対し、IS621はターゲットDNAおよびドナーDNAの切断・交換・再結合からなる複雑なDNA組換え反応を触媒する。DNA切断部位を黄色の三角形で示した。
関連情報:
「プレスリリース:Arc Institute(英語)」(2024/6/26)
URL:https://arcinstitute.org/news/news/bridge
IS110 システムの説明動画(英語)
URL:https://www.youtube.com/watch?v=hJ7zvZTxgT4
発表者・研究者等情報
東京大学大学院工学系研究科
平泉 将浩 助教
相馬 哲兵 修士課程
長畑 直人 博士課程
東京大学先端科学技術研究センター
岡崎 早恵 学術専門職員
山下 恵太郎 准教授
西増 弘志 教授
兼:東京大学大学院工学系研究科 教授
論文情報
- 【論文1】
雑誌名:「Nature」(6月26日) - 題名:Bridge RNAs direct programmable recombination of target and donor DNA
- 著者名:Matthew G. Durrant, Nicholas T. Perry, James J. Pai, Aditya R. Jangid, Januka S. Athukoralage, Masahiro Hiraizumi, John P. McSpedon, April Pawluk, Hiroshi Nishimasu, Silvana Konermann, Patrick D. Hsu*
- *責任著者
- DOI:10.1038/s41586-024-07552-4
- 【論文2】
雑誌名:「Nature」(6月26日) - 題名:Structural mechanism of bridge RNA-guided recombination
- 著者名:Masahiro Hiraizumi, Nicholas T. Perry, Matthew G. Durrant, Teppei Soma, Naoto Nagahata, Sae Okazaki, Januka S. Athukoralage, Yukari Isayama, James J. Pai, April Pawluk, Silvana Konermann, Keitaro Yamashita, Patrick D. Hsu*, Hiroshi Nishimasu*
- *責任著者
- DOI:10.1038/s41586-024-07570-2
研究助成
本研究は、科学技術振興機構(JST)戦略的創造研究推進事業「CREST(課題番号:JPMJCR23B6)」、「ACT-X(課題番号:JPMJAX232F)」、稲盛財団 InaRISフェローシップ、武田科学振興財団「武田報彰医学研究助成」、「ライフサイエンス研究助成」、科研費「基盤研究(A)(課題番号:22H00403)」、「学術変革領域研究(A)(課題番号:21H05281)」、「若手研究(課題番号:23K14133)」などの支援により実施されました。
用語解説
(注1)リコンビナーゼ
2分子の2本鎖DNAのあいだの組換え反応を触媒する酵素。リコンビナーゼは特定のDNA配列を認識し、それらのあいだの切断・再結合を触媒する。
(注2)ブリッジRNA
IS110ファミリー因子から転写される非コードRNA。ドナーDNAと結合するドナー結合ループ、および、ターゲットDNAと結合するターゲット結合ループをもち、IS621リコンビナーゼが触媒するDNA組換え反応において、ドナーDNAとターゲットDNAを橋渡しする役割を担う。ドナー結合ループ、ターゲット結合ループの塩基配列を変更することにより、ドナーDNA、ターゲットDNAに対する特異性を変更することができる。
(注3)ドナーDNA
DNA組換えにおいて、ターゲットDNAに組み込まれるDNA配列。
(注4)ターゲットDNA
DNA組換えにおいて、ドナーDNAが組み込まれるDNA配列。
(注5)クライオ電子顕微鏡解析
液体窒素冷却下でタンパク質などの分子に電子線を照射し、試料を観察することにより、タンパク質や核酸の立体構造を決定する解析技術。
(注6)挿入配列因子
動く遺伝子の一種であり、原核生物のゲノムに存在する。通常、自身の転移を触媒するトランスポザーゼ遺伝子および両末端の逆向き反復配列から構成される。
(注7)トランスポザーゼ
挿入配列因子などの転移因子の転移を触媒するDNA組換え酵素。トランスポザーゼは特定のDNA配列(ドナーDNA)を認識・切断し、ゲノム内の別の領域(ターゲットDNA)に組み込む。通常のトランスポザーゼはドナーDNAの特定の塩基配列(逆向き反復配列)を認識する一方、ターゲットDNAの配列に対する特異性は低い。
(注8)非コード RNA
タンパク質をコードしないRNA。一部の非コードRNAは、Cas9などのRNA依存性ヌクレアーゼのガイドRNAとして機能し、ターゲットDNAに対する配列特異性を規定する。
問合せ先
東京大学先端科学技術研究センター 構造生命科学分野
教授 西増 弘志(にします ひろし)