2024-07-19 理化学研究所
理化学研究所(理研)生命機能科学研究センター 染色体分配研究チームの竹之内 修 基礎科学特別研究員、榊原 揚悟 基礎科学特別研究員(研究当時)、北島 智也 チームリーダーの研究チームは、老化した卵子[1]において小さな染色体[2]の数が異常になりやすい原因を、分裂細胞の染色体を個々に追跡する新技術を用いて明らかにしました。
本研究成果は、卵子の染色体数の異常が原因となって起きるダウン症や流産などのメカニズムの解明に貢献すると期待できます。
卵母細胞[1]は、減数分裂[2]を経て卵子となります。卵子が受精後に正常に胚発生するためには、減数分裂で正しい数の染色体が卵子に分配されることが必要です。しかし、小さなサイズの染色体にはしばしば分配異常が見られ、流産やダウン症などのトリソミー[3]といった先天性疾患を引き起こします。老化した卵母細胞では小さな染色体ほど分配異常を起こしやすいことが知られていましたが、その原因は未解明でした。
今回、研究チームは、生きた細胞内で個々の染色体を可視化し、その動態を追跡する新しい解析技術”Chromosome tracking-and-identification法”を開発しました。この新技術で、生きたマウス卵母細胞の減数分裂中の任意の染色体を同定し、同時にその動態を追跡した結果、小さな染色体は紡錘体(ぼうすいたい)[4]の内側に配置されやすいことが分かりました。さらに、老化が進んだ卵母細胞では、小さな染色体が紡錘体内部に配置されることが、分配異常のリスクであると分かりました。
本研究は、科学雑誌『Science』オンライン版(7月18日付:日本時間7月19日)に掲載されました。
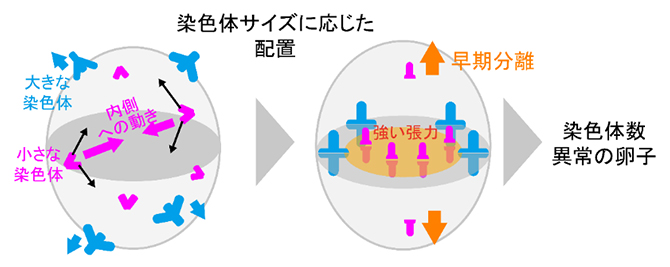
小さな染色体の紡錘体内部への動きによって高まる、染色体分配異常のリスク
背景
ヒトの卵母細胞の中には、体細胞と同じ23種46本の染色体(22対の常染色体と1対の性染色体)が含まれています。染色体の大きさはそれぞれ異なっており、コードされる遺伝子の数も異なります。卵母細胞は減数分裂により染色体を正確に分配することで、卵子に正常な数(23種23本)の染色体を持たせ、受精後の正常な胚発生を可能にします。染色体の分配に異常が起こると、卵子は染色体数異常となり、着床前の胚性致死、着床後の流産、もしくは先天性疾患を持つ子の出産に至ります。特に、比較的サイズが小さい染色体の分配の異常は、流産および先天性疾患の原因となります。このような染色体の分配異常による疾患には、ダウン症候群(21トリソミー)・エドワーズ症候群(18トリソミー)・パトー症候群(13トリソミー)などの先天性疾患が含まれます。統計的に、母体の加齢に伴って、小さな染色体の分配異常が起こる頻度が上昇することが知られています。
染色体の分配異常の原因を解明する上で、マウス卵母細胞をモデルに用いた染色体ライブイメージング[5]技術は有効な手段です。研究チームは、これまで共焦点顕微鏡を用いた4Dイメージング[5]によって、卵母細胞内の染色体分配異常を解析してきました。これまでの解析結果から、老化した卵母細胞では、減数分裂の途中で相同染色体のペア(二価染色体)が早期分離してしまうことが、染色体分配の異常の原因であることが明らかになっています注1)。
しかしこれまでのライブイメージング技術では、染色体を同定する(例えば、一つの画像内に20個の染色体が確認される中で、19番染色体がどれか同定する)ことは不可能で、特定の小さな染色体がどのような過程を経て分配異常へと至るのかを知ることはできませんでした。一方、既存の染色体同定技術であるFluorescent in situ hybridization (FISH) assay[6]などは、観察のため細胞を固定する(殺す)必要があり、生きた細胞内の染色体の動きをリアルタイムで解析することはできません。そこで、卵母細胞を殺すことなく染色体を同定し、動きを解析できる新しい技術を構築する必要がありました。
注1)2015年7月1日プレスリリース「加齢による卵子の染色体数異常の原因を特定」
研究手法と成果
研究チームは、生細胞内のDNA配列を蛍光標識する技術CRISPR-Sirius[7]をマウス卵母細胞に応用し、1種の染色体にのみ含まれるDNA配列を蛍光標識すれば、蛍光スポットを有する染色体を標的の染色体として同定できると考えました。まず、マウスのゲノム情報を基に、182,147種の標識候補となるDNA配列を選びました。その中で正確性などから優先順位を決め、一つ一つCRISPR-Siriusによって標識を行いました。強い蛍光スポットが観察されるDNA配列を選抜し、マウスの卵母細胞内の20種(常染色体19種とX染色体)全ての染色体を同定可能な蛍光プローブセットの開発に成功しました(図1)。
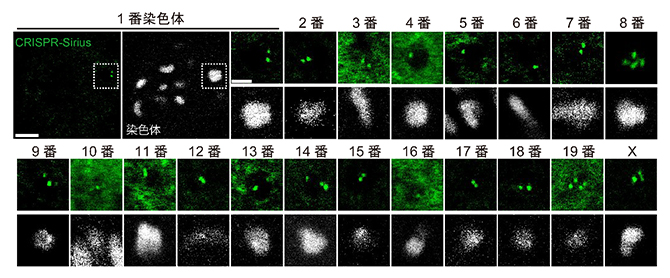
図1 CRISPR-Siriusによる染色体の同定
白色は染色体の形状を示し、緑色の蛍光スポットは個々の染色体に付けられた蛍光プローブのシグナルを示す。全ての染色体を含む視野の観察例を、1番染色体の例で示した(左上の2枚、スケールバーは5マイクロメートル(μm、1μmは100万分の1メートル))。個々の染色体の拡大観察像のスケールバーは3μm。減数第一分裂では四つの染色分体を含む二価染色体となっており、染色体の種類ごとに複数個の緑色の蛍光スポットが観察される。
さらに、研究チームがすでに開発していた、減数分裂の期間中に染色体の位置を自動追跡し、画像を取得する顕微鏡技術注1)と組み合わせ、この新規染色体解析技術を”Chromosome tracking-and-identification(染色体の追跡と同定)法”と名付けました。次に、Chromosome tracking-and-identification法によって、若いマウス(2月齢程度)から採取した卵母細胞の中の9種の染色体(大きな染色体:1~3番およびX染色体、中サイズの染色体:8~9番染色体、小さな染色体:17~19番染色体)の動的挙動をそれぞれ解析しました。その結果、分裂期前中期(減数第一分裂の開始から1~4時間の間)において、小さな染色体は紡錘体の内側に、大きな染色体は紡錘体の外側に動きやすいことが判明しました(図2)。この結果は、卵母細胞内の染色体は自身のサイズに基づく特有のダイナミクスを有するという、初めての発見です。
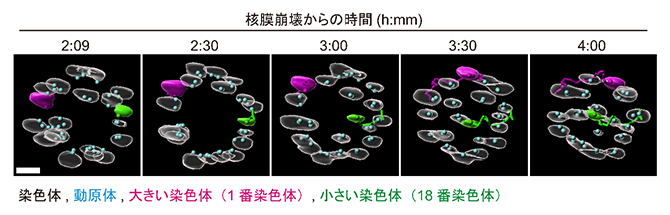
図2 小さな染色体の紡錘体内側へ向かう動き
卵母細胞の分裂をChromosome tracking-and-identification法で4D(4次元)観察し、紡錘体の極側(上)から見た平面像(赤道面の断面図)に再構成し、減数第一分裂開始後の時間経過に沿って並べた。図1と同様に、相同染色体がペアとなった二価染色体が20本観察される。スケールバーは5μm。減数第一分裂の開始からの時間経過で、以下の染色体ダイナミクスが観察された。
2:09~2:30:ほとんどの染色体が紡錘体の外側に移動し、円状に並ぶ。
3:00~4:00:大きな染色体が外側に移動し続けるのに対し、小さな染色体が内側に移動する。
小さな染色体が紡錘体の内側に移動する時期は、染色体が紡錘体軸に沿って伸長する時期と一致していました。そこで、この移動メカニズムを明らかにするために、各染色体の形状の変化を解析しました。その結果、紡錘体軸に沿って伸長するタイミングが、小さな染色体ほど早い傾向があることが判明しました。これらの結果は、卵母細胞が、染色体の伸長タイミングをサイズに応じて変化させることで、染色体のダイナミクスを調整していることを示唆しています。
次に研究チームは、加齢が進んだマウス(16~22月齢)の卵母細胞における小さな染色体の挙動に着目しました。解析の結果、老化した卵母細胞でも若い卵母細胞と同様に、小さな染色体が紡錘体の内側に局在しやすいことが分かりました。しかしその後、減数第一分裂の途中において、小さな染色体ほど高い頻度で早期分離してしまい、早期分離した染色体の6割は減数第一分裂後期において分配異常となったことが分かりました(図3)。この染色体の早期分離は、ほとんどの場合紡錘体の内側で起きていたことから、紡錘体の内側には染色体の早期分離を誘発する要因が存在する可能性が示唆されました。
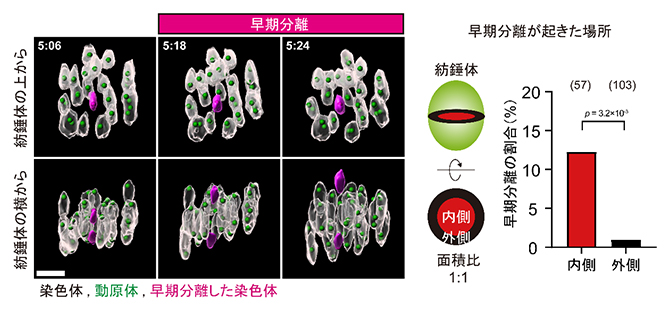
図3 老化した卵母細胞で染色体の早期分離が起こる場所
左)老化卵母細胞の染色体ダイナミクスの観察。紡錘体の上から見た図で内側に位置する小さな染色体(マゼンタ)は、他の染色体がまだ伸長中の時に早期分離した(横から見た図)。スケールバーは5μm。
右)紡錘体赤道面の円を外側と内側の面積が1:1となるように同心円で区分けすると、早期分離を起こした染色体のほとんどは内側に位置していた(棒グラフの上の数字は、解析した染色体の数を示す)。
染色体の早期分離は、微小管[4]が染色体を紡錘体の両極に引っ張る力で起こります。そこで、微小管から染色体にかかる力を推定するべく、各染色体の伸びを計測しました。その結果、紡錘体の内側に位置する染色体は、外側の染色体に比べて、より長く伸びていることが確認されました。これらの結果から、紡錘体の内側では染色体により強く引っ張る力がかかることで、染色体の早期分離が誘発されていると考えられました。
最後に、染色体が紡錘体の内側に位置することが、早期分離の原因であるかどうかを検証しました。染色体の位置を人為的に操作するため、研究チームが最近開発した人工動原体ビーズ[8]を、老化した卵母細胞へ導入しました。この人工動原体ビーズは卵母細胞の紡錘体の中心に局在し、本来の染色体を紡錘体の外側へと押し出す効果があります。染色体の早期分離を促進する薬剤で処理した卵母細胞で検証したところ、人工動原体ビーズで染色体を紡錘体の外側に押し出すことで、老化した卵母細胞における早期分離の頻度を有意に減少させることに成功しました(図4)。すなわち、強く引っ張られる力から逃れた染色体は早期分離が誘発されにくくなることが示されました。
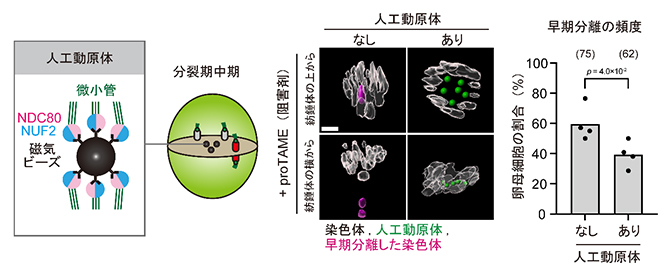
図4 人工動原体ビーズによる早期分離の抑制
左)人工動原体ビーズを用いた染色体の位置操作実験の模式図。人工動原体ビーズは、磁気ビーズに動原体を構成するタンパク質NDC80/NUF2二量体を結合させたもの。人工動原体ビーズは分裂期中期に紡錘体の中心部に集まり、本来の染色体を外側に追いやる。
中)老化した卵母細胞をproTAME(細胞分裂の進行阻害剤)で処理し、染色体が早期分離しやすい状況を人為的に再現した(写真左列)。一方、人工動原体ビーズが存在すると早期分離が抑制された(写真右列)。
右)人工動原体ビーズの有無による染色体早期分離の頻度の違い(棒グラフの上の数字は、解析した卵母細胞の数を示す)。
本研究から、卵母細胞は小さな染色体を紡錘体の内側に配置するメカニズムを有しており、紡錘体の内側は染色体の早期分離のリスクが高い位置であることが判明しました。老化した卵母細胞では、小さな染色体は紡錘体内側の強く引っ張られる力に耐えることができずに早期分離してしまうために、卵子で染色体数異常となりやすいと考えられます。
今後の期待
今回の研究を通じて、研究チームが開発したChromosome-identifying-and-tracking法が卵母細胞内の染色体の動きを解析するのに非常に有用であることが実証されました。近年、核内の染色体の配置が遺伝子の発現や細胞の分化と関連していることが報告されています。受精卵では、発生のステージごとに染色体の配置が変化しますが、その変化をつかさどるメカニズムや重要性は全く解明されていません。私たちの技術は、この謎を解明できる可能性があります。受精卵の中にある任意の染色体の動きを解析することで、発生をつかさどる重要なメカニズムを発見できると期待されます。
また、今回の研究により、小さな染色体の分配異常は、紡錘体内の局在が重要な因子であることが判明しました。もし、小さな染色体の局在を人為的にコントロールすることができれば、老化した卵母細胞の分配異常の頻度を低減できる可能性があります。人工動原体ビーズの改良を進めることによって、分配異常頻度の低減に向けた研究の進展が今後期待できます。
補足説明
1.卵子、卵母細胞
卵子は女性由来の受精可能な生殖細胞。卵母細胞は受精能を持たない発達前の生殖細胞で、女性の胎児期に形成され、卵巣内に蓄積される。卵母細胞が長期の休眠期を経て、排卵直前に減数第一分裂を行い、卵子となる。受精によって、減数第二分裂が起こり、受精卵として発生を開始する。
2.染色体、減数分裂
真核生物のDNAはヒストンタンパク質と結合して存在しており、細胞分裂時に凝縮して特徴的な形態をとったものを染色体と呼ぶ(ただし、間期の染色質も染色体と呼ぶことも多い)。減数分裂は、真核生物の生殖器官(精巣や卵巣)にある生殖細胞で見られ、配偶子(精子や卵子)を作るため、二つの分裂が連続して起きる特別な様式の細胞分裂。生殖細胞である卵母細胞の中の染色体は減数第一分裂に入ると凝集し、マウスにおいては20本の染色体になる。個々の染色体は4本の染色分体から成る二価染色体を形成する。分裂期中期になると、染色体の動原体に微小管が接合し、染色体は両極から張力を受ける。分裂期終期になると、二価染色体は分配され、一価染色体になる。20本の染色体は、19本の常染色体と1本の性染色体(X染色体)を含む。常染色体は、そのサイズに応じて番号が割り振られる(マウスの常染色体は、1番染色体~19番染色体、番号が大きいほど染色体のサイズは小さい)。ヒト卵母細胞は、22本の常染色体と1本の性染色体を含む。
3.トリソミー
細胞内に特定の染色体が3本存在する状態(正常時は2本)。染色体の種類に応じて、ダウン症候群(21染色体)・エドワーズ症候群(18染色体)・パトー症候群(13染色体)などと病名が異なる。16番染色体や22番染色体のトリソミーは、流産の原因であることが知られている。
4.紡錘体(ぼうすいたい)、微小管
紡錘体は、細胞分裂において染色体を分配するための構造体。微小管は、タンパク質が重合して管状構造を形成した細胞骨格の一種。紡錘体は微小管重合中心とそこから伸びてくる微小管で構成される。紡錘体の両極から伸びてきた微小管は、染色体上の動原体に接合し、染色体に張力をかけて分配へと導く。
5.ライブイメージング、4Dイメージング
試料を固定せず、生きた状態の細胞や組織を観察することをライブイメージングと呼ぶ。4Dイメージングは、4次元(空間3次元+時間1次元)データを取得できるライブイメージング技術。
6.Fluorescent in situ hybridization (FISH) assay
蛍光ラベルした核酸プローブを、染色体を構成しているDNAに結合(ハイブリダイズ)させて、蛍光顕微鏡によって蛍光シグナルとして検出する実験方法。
7.CRISPR-Sirius
特定のDNA配列を可視化する技術。ゲノム編集に用いるCRISPR-Cas9の原理を応用しており、アミノ酸変異によってDNA切断能を失活したCas9(dCas9)とアプタマー構造が付与されたsgRNAを用いる。sgRNAとdCas9が特定のDNA配列に結合し、蛍光タンパク質が結合したアプタマー結合タンパク質がsgRNAに結び付くことで、特定のDNA配列が蛍光スポットとして顕微鏡下で観察できる。
8.人工動原体ビーズ
抗GFP抗体が結合した磁気ビーズに動原体タンパク質NDC80およびNUF2を結合させたもの。染色体上の動原体の機能が再現される(Asai et al., bioRxivで公開中)。卵母細胞の中で人工動原体ビーズは、紡錘体の中期板に整列し、染色体よりも紡錘体の内側に入り込む。
研究チーム
理化学研究所 生命機能科学研究センター 染色体分配研究チーム
基礎特別科学研究員 竹之内 修(タケノウチ・オサム)
基礎特別科学研究員(研究当時)榊原 揚悟(サカキバラ・ヨウゴ)
チームリーダー 北島 智也(キタジマ・トモヤ)
(生命機能科学研究センター 副センター長)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、日本学術振興会(JSPS)科学研究費助成事業学術変革領域研究(A)「動的な生殖ライフスパン:変動する生殖細胞の機能と次世代へのリスク(領域代表者:北島智也)」、同新学術領域研究「染色体イメージングによる卵子インテグリティの予見(研究代表者:北島智也)」、同基盤研究(B)「哺乳類卵母細胞における紡錘体二極化の機構の解明(研究代表者:北島智也)」、同若手研究「新規染色体解析技術によって明らかとなる動原体-微小管接合の個別制御の重要性(研究代表者:竹之内修)」、同特別研究員奨励費「マウス卵子における全染色体識別ライブイメージング技術を用いた分配異常解析(研究代表者:竹之内修)」、および理研新領域開拓課題「長時間分子生物学(領域代表者:北島智也)」による助成を受けて行われました。また、竹之内修および榊原揚悟は、理化学研究所の基礎科学特別研究員制度の支援を受け、研究を遂行しました。
原論文情報
Osamu Takenouchi, Yogo Sakakibara, Tomoya S. Kitajima, “Live chromosome identifying and tracking reveals size-based spatial pathway of meiotic errors in oocytes”, Science, 10.1126/science.adn5529
発表者
理化学研究所
生命機能科学研究センター 染色体分配研究チーム
基礎科学特別研究員 竹之内 修(タケノウチ・オサム)
基礎科学特別研究員(研究当時)榊原 揚悟(サカキバラ・ヨウゴ)
チームリーダー 北島 智也(キタジマ・トモヤ)
報道担当
理化学研究所 広報室 報道担当