2024-07-19 理化学研究所,キッセイ薬品工業株式会社,筑波大学,横浜市立大学
理化学研究所(理研)生命医科学研究センター 免疫恒常性研究チームの秋山 泰身 チームリーダー、キッセイ薬品工業株式会社の丸山 祐哉 主任(理研 生命医科学研究センター 免疫恒常性研究チーム 研修生(研究当時)、横浜市立大学大学院 生命医科学研究科 免疫生物学研究室 大学院生(研究当時))、筑波大学 医学医療系 生命医科学域 ケミカルバイオロジー IT創薬研究室の広川 貴次 教授らの共同研究グループは、新たな免疫抑制化合物KSI-6666を発見し、その薬効が持続する機構を同定しました。
本研究成果は、自己免疫疾患[1]の治療に向けた医薬品の開発に貢献すると期待できます。
自己免疫疾患では、免疫細胞の一つTリンパ球[2]が患部へ移動して有害な免疫応答を引き起こします。今回、共同研究グループは、Tリンパ球の移動を抑制する低分子化合物KSI-6666を新たに同定しました。KSI-6666の薬効は持続性が高く、同じ薬効を持つ医薬品に比べて副作用が少ないことが判明しました。また、計算科学によるシミュレーション予測と検証実験により、KSI-6666の薬効の持続性を説明するメカニズムを解明しました。
本研究は、科学雑誌『Nature Communications』オンライン版(7月19日付:日本時間7月19日)に掲載されました。
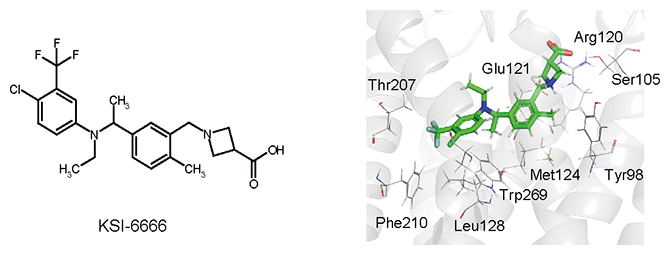
薬効が持続する新しい免疫抑制化合物KSI-6666
背景
自己免疫疾患は、自己の組織に対して免疫応答が起きる疾患です。その際、Tリンパ球はリンパ組織から免疫応答を起こす自己の組織に移動して傷害を与えます。このTリンパ球の移動には、スフィンゴシン1-リン酸レセプター1(S1PR1)[3]が必要です。つまり、S1PR1の機能を阻害すれば、Tリンパ球の移動を抑えることができ、自己免疫応答が抑制されます。そのためS1PR1の作用を抑制する化合物(S1PR1調節薬)が開発され、自己免疫疾患の治療薬として使われています。
これまでのS1PR1調節薬は、Tリンパ球だけでなく心臓の細胞にも影響するため、副作用として徐脈[4]を引き起こすことが問題となっています。この副作用は、S1PR1調節薬がS1PR1に結合する際、一時的にS1PR1が”活性化”することが原因でした。そのため、S1PR1を全く活性化させないS1PR1調節薬が開発されましたが、その多くは薬効が長続きしないのが欠点でした。
研究手法と成果
今回、共同研究グループは、これまでの知見を参考に化合物スクリーニングを行い、S1PR1の作用を抑制する新しい化合物としてKSI-6666を同定しました。一般に、S1PR1調節薬を投与すると血液中のリンパ球が減少することから、リンパ球が減少している時間の長さが薬効持続性の目安となります。KSI-6666ではラットのリンパ球の減少が48時間以上持続しました。さらにKSI-6666は、自己免疫疾患である多発性硬化症[5]や炎症性腸疾患[6]のマウスモデル実験で、これまでのS1PR1調節薬とほぼ同等の治療薬効を持つことが分かりました(図1)。そして、重要なことに、既存のS1PR1調節薬とは異なり、S1PR1を一時的に活性化させないため、徐脈の副作用がありませんでした。すなわち、KSI-6666は既存の医薬品とほぼ同様の薬効と持続性を持ち、しかも副作用の少ないS1PR1調節薬であると判明しました。
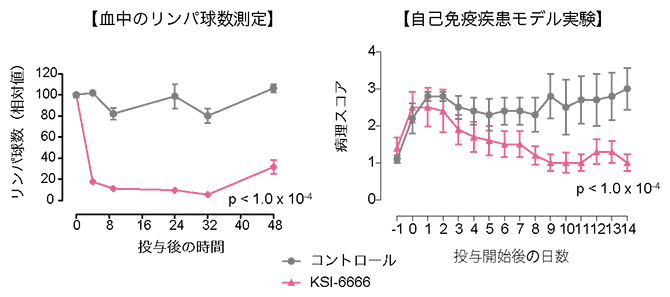
図1 KSI-6666の持続的な薬効と自己免疫疾患の治療成績
KSI-6666投与後のラット血中リンパ球数の減少(左)と多発性硬化症マウスモデル(実験的自己免疫性脳脊髄炎)の病態改善(右)。コントロールは薬物なし。pは統計学的有意差(二元配置分散分析)。代表的なデータとして示した。
そこで共同研究グループは、KSI-6666の薬効が持続性を示す機構の解明に挑みました。
まず、KSI-6666がどのような状態でS1PR1と結合しているのかを調べるために、KSI-6666とS1PR1の分子ドッキング計算[7]を行いました。その結果から予測される構造や結合親和性は、持続性のない調節薬とほとんど違いがなく、KSI-6666の特長である薬効の持続性の説明には不十分でした。そこで、分子動力学計算[8]の一つであるメタダイナミクス法[9]を用いて、S1PR1に結合したKSI-6666が解離する過程をシミュレーションしました(図2上)。その結果から、KSI-6666は、薬効が持続しないS1PR1調節薬(対照薬)に比べ、S1PR1から解離しにくい、と予想しました。実際に、結合したKSI-6666がS1PR1から解離する半減期(解離半減期[10])を測定したところ、9.41時間であり、持続性のない調節薬の解離半減期(0.2時間)と比べて解離が遅いことが判明しました(図2下)。
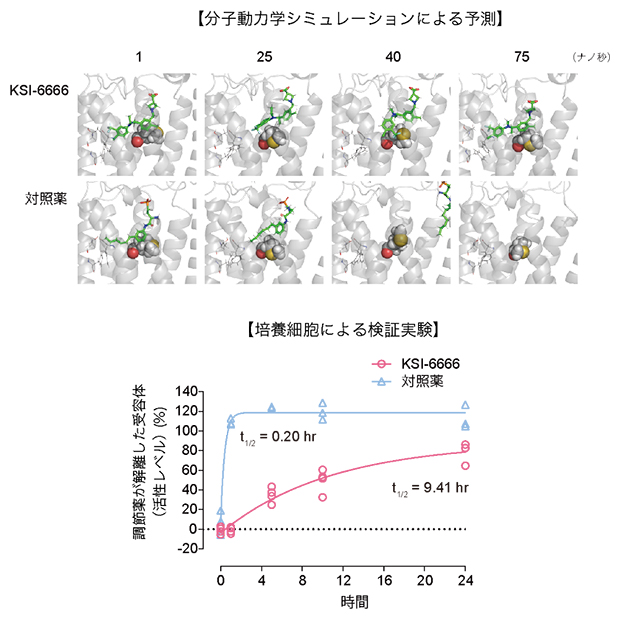
図2 KSI-6666がS1PR1から解離するシミュレーションと検証実験
分子動力学シミュレーションにより、KSI-6666と対照薬のスフィンゴシン1-リン酸レセプター1(S1PR1)からの解離動態を予想した(上)。おのおのの化合物を緑色の棒で示した。対照薬は円滑に解離するが、KSI-6666はS1PR1のメチオニン(球状の構造で示した)と相互作用することで解離しにくい。シミュレーションで予想した解離動態の違いを、培養細胞を用いた実験で確認した(下)。受容体からの調節薬の解離の程度は、受容体の活性を指標に測定した。t1/2は解離半減期。
次に、KSI-6666がS1PR1からの解離が遅い原因を調べるために、計算された解離のシミュレーション過程を観察し、KSI-6666はS1PR1の特定部位のメチオニン[11]と相互作用することで解離しにくいと予想しました。シミュレーションから予想された特定部位のメチオニンとKSI-6666の相互作用の重要性を検討するため、メチオニンを別のアミノ酸であるバリン[12]に換えたS1PR1を培養細胞に発現させ、KSI-6666の解離を検討しました。その結果、予想通り、KSI-6666はメチオニンをバリンに換えたS1PR1から早く解離することが確認できました。
さらに、KSI-6666が持つ薬効の持続性とS1PR1からの解離しにくさとの関連性を調べるためにシミュレーション過程を観察し、KSI-6666の分子構造に含まれる二つのベンゼン環(図3左)のうち末端側のベンゼン環とメチオニンが相互作用していると予想しました。そこで、KSI-6666のベンゼン環の置換基を取り除いた化合物(類似化合物)について、S1PR1からの解離を調べたところ、解離半減期が0.98時間であり、KSI-6666(9.41時間)と比べて早く解離することが明らかになりました。この化合物の薬効を調べたところ、薬効の最大活性はほぼ変わらないものの、48時間以上持続するKSI-6666に比べて、血中濃度がほぼ同じにもかかわらず持続性が低い(24時間)ことが判明しました(図3下)。
以上の結果から、KSI-6666は末端側のベンゼン環で、S1PR1のメチオニンと相互作用することで解離が遅くなり、その結果として薬効が持続すると結論付けました。
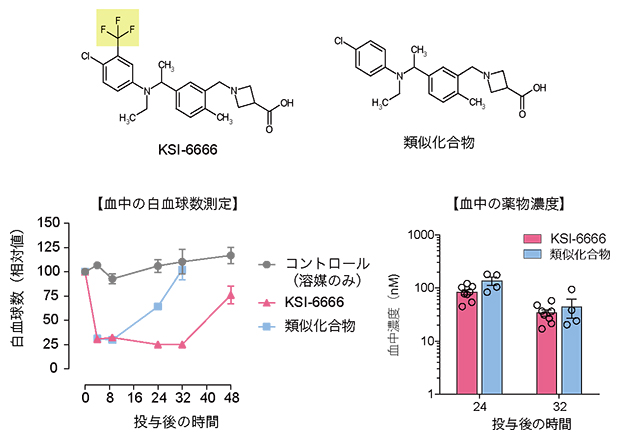
図3 解離の早いKSI-6666類似化合物の薬効
KSI-6666(左上)あるいは解離半減期の短い類似化合物(右上)をラットに投与後に血中の白血球減少を測定した(左下)。S1PR1調節薬をラットに投与するとリンパ球が減少して白血球が減少するため、白血球が減少している時間の長さが薬効持続性の目安となる。類似化合物の血中濃度は、KSI-6666の血中濃度とほぼ同じであるにもかかわらず(右下)、類似化合物の薬効持続性は、KSI-6666に比べて低い。
今後の期待
これまで医薬品の薬効の持続性は、薬物の血中濃度で説明されてきました。すなわち代謝などで血中から早く消失する医薬品は持続性が低いとの考え方です。一方、本研究から、KSI-6666の持続性には、血中からの減少速度だけでなく、標的であるS1PR1からの解離速度が重要なことが明らかとなりました。
つまり、持続的な薬効を持つ医薬品を開発するには、血中濃度の減少速度の測定に加えて、標的タンパク質からの解離速度の測定も重要です。また、分子動力学を利用したシミュレーション研究は、薬物解離のプロセスを予測するために有効な手段になります。
本研究成果は、自己免疫疾患の治療に向けた医薬品の開発へ貢献するとともに、これからのさまざまな医薬品開発における重要な知見になることが期待されます。
補足説明
1.自己免疫疾患
免疫系が自身の正常な細胞や組織に対して反応することで、体の機能異常を来す疾患の総称。
2.リンパ球
白血球の一種で、通常は病原体などに応答して体を防御するとともに、一度侵入してきた病原体を記憶する。血液中には主にTリンパ球、Bリンパ球、ナチュラルキラー細胞などが含まれる。自己免疫疾患では、主にTリンパ球とBリンパ球が自己の細胞や組織に応答する。
3.スフィンゴシン1-リン酸レセプター1(S1PR1)
細胞表面にある受容体タンパク質。リガンドであるスフィンゴシン-1-リン酸が結合することで細胞移動などの細胞応答を引き起こす。
4.徐脈
心臓の拍動が異常に遅いあるいは間隔が長くなる不整脈。
5.多発性硬化症
神経線維を覆っている髄鞘(ずいしょう)が変性・脱落することにより、神経系に異常が起きる疾患。
6.炎症性腸疾患
免疫細胞が腸の細胞に応答することで腸に炎症を来す疾患。
7.分子ドッキング計算
化合物とタンパク質などの生体分子の相互作用を予測するコンピュータシミュレーション。
8.分子動力学計算
物質を構成する個々の原子にニュートンの運動方程式を適用して、原子位置やエネルギーの時間変化を追跡する手法。
9.メタダイナミクス法
通常の分子動力学法では到達しにくい状態への移行を容易にすることで、すべての状態へのシミュレーションを短時間で可能にする方法。
10.解離半減期
リガンドとタンパク質など結合した状態から、両者が解離した状態になる反応において、結合状態が半減するまでに要する時間。
11.メチオニン
タンパク質を構成する20種類のアミノ酸のうち、動物が合成できない必須アミノ酸の一つ。疎水性アミノ酸であり側鎖に硫黄原子を含む。
12.バリン
タンパク質を構成する疎水性アミノ酸の一つ。メチオニンと異なり硫黄原子を含まない。
共同研究グループ
理化学研究所 生命医科学研究センター
免疫恒常性研究チーム
チームリーダー 秋山 泰身(アキヤマ・タイシン)
(横浜市立大学大学院 生命医科学研究科 免疫生物学研究室 大学院客員教授)
理研スチューデント・リサーチャーD 村松 航(ムラマツ・ワタル)
(横浜市立大学大学院 生命医科学研究科 免疫生物学研究室 大学院生)
研修生 並木 佳乃(ナミキ・カノ)
(横浜市立大学大学院 生命医科学研究科 免疫生物学研究室 大学院生)
客員研究員 石川 龍也(イシカワ・タツヤ)
(横浜市立大学大学院 生命医科学研究科 免疫生物学研究室 大学院生(研究当時))
大学院生リサーチ・アソシエイト 端山 美央(ハヤマ・ミオ)
(横浜市立大学大学院 生命医科学研究科 免疫生物学研究室 大学院生)
上級研究員 秋山 伸子(アキヤマ・ノブコ)
(横浜市立大学大学院 生命医科学研究科 免疫生物学研究室 大学院客員助教)
技師(研究当時、現 基礎科学特別研究員)宮尾 貴久(ミヤオ・タカヒサ)
テクニカルスタッフⅠ 宮内 真紀(ミヤウチ・マキ)
テクニカルスタッフⅡ 萩原 奈穂(ハギワラ・ナホ)
客員研究員 堀江 健太(ホリエ・ケンタ)
キッセイ薬品工業株式会社
主任 丸山 祐哉(マルヤマ・ユウヤ)
(理研 生命医科学研究センター 免疫恒常性研究チーム 研修生(研究当時)、横浜市立大学大学院 生命医科学研究科 免疫生物学研究室 大学院生(研究当時))
グループマネジャー 大澤 雄亮(オオサワ・ユウスケ)
主任 鈴木 孝幸(スズキ・タカユキ)
研究員 山内 裕子(ヤマウチ・ユウコ)
グループマネジャー 大野 孝介(オオノ・コウスケ)
グループマネジャー 井上 仁史(イノウエ・ヒトシ)
研究員 山本 明俊(ヤマモト・アキトシ)
部長 林 守道(ハヤシ・モリミチ)
グループマネジャー 奥原 裕次(オクハラ・ユウジ)
筑波大学 医学医療系 生命医科学域 ケミカルバイオロジー IT創薬研究室
教授 広川 貴次(ヒロカワ・タカツグ)
研究支援
本研究は日本医療研究開発機構(AMED)生命科学・創薬研究基盤事業「標的タンパク質の構造情報を駆使した創薬分子設計技術の高度化と創薬支援(研究代表者:広川貴次、JP23ama121029j0001)」、科学技術振興機構(JST)戦略的創造研究推進事業CREST「構造的・動力学的制約を活用した多元混合化学情報の解読とその応用(研究代表者:小林徹也、JPMJCR2011)」、日本学術振興会(JSPS)科学研究費助成事業基盤研究(B)「自己免疫疾患発症を抑制する胸腺上皮細胞の機能を制御する新規転写因子の解析(研究代表者:秋山泰身、17H04038)」「胸腺上皮細胞の多様性による自己免疫疾患の発症抑制(研究代表者:秋山泰身、20H03441)」、同基盤研究(C)「自己免疫寛容に必須な胸腺髄質上皮細胞へ分化決定する転写因子の同定と機能解析(研究代表者:秋山伸子、17K08622)」「自己免疫寛容を誘導する胸腺上皮細胞の分化・維持機構の解明(研究代表者:秋山伸子、20K07332)」の助成を受けたものです。
原論文情報
Yuya Maruyama, Yusuke Ohsawa, Takayuki Suzuki, Yuko Yamauchi, Kohsuke Ohno, Hitoshi Inoue, Akitoshi Yamamoto, Morimichi Hayashi, Yuji Okuhara, Wataru Muramatsu, Kano Namiki, Naho Hagiwara, Maki Miyauchi, Takahisa Miyao, Tatsuya Ishikawa, Kenta Horie, Mio Hayama, Nobuko Akiyama, Takatsugu Hirokawa and Taishin Akiyama, “Pseudoirreversible inhibition elicits persistent efficacy of a sphingosine 1-phosphate receptor 1 antagonist”, Nature Communications, 10.1038/s41467-024-49893-8
発表者
理化学研究所
生命医科学研究センター 免疫恒常性研究チーム
チームリーダー 秋山 泰身(アキヤマ・タイシン)
キッセイ薬品工業株式会社
主任 丸山 祐哉(マルヤマ・ユウヤ)
(理研 生命医科学研究センター 免疫恒常性研究チーム 研修生(研究当時)、横浜市立大学大学院 生命医科学研究科 免疫生物学研究室 大学院生(研究当時))
筑波大学 医学医療系 生命医科学域 ケミカルバイオロジー IT創薬研究室
教授 広川 貴次(ヒロカワ・タカツグ)
報道担当
理化学研究所 広報室 報道担当
キッセイ薬品工業株式会社 広報部
筑波大学広報局
横浜市立大学 広報担当
