2024-07-24 東京医科大学,国立がん研究センター
発表のポイント
- miR-891bを介したPSAT1の発現抑制によってがん細胞の細胞外小胞(Extracellular vesicle: EV)*1が制御されています。
- がん細胞においてセリンセラミド経路がEVの分泌に重要であることを示しました。
- PSAT1を介して上昇した骨転移性乳がん細胞に由来するEV分泌は破骨細胞*2を活性化させます。
- 動物実験においてEVを介したがん転移にPSAT1が寄与することを明らかにしました。
概要
東京医科大学(学長:林由起子/東京都新宿区)医学総合研究所未来医療研究センター分子細胞治療研究部門の落谷孝広特任教授、山元智史助教(特任)(現 国立医薬品食品衛生研究所)、西田奈央助教(特任)(現 早稲田大学高等研究所講師)、分子病理学黒田雅彦教授、国立がん研究センター研究所病態情報学ユニット山本雄介ユニット長、中山淳特任研究員(現 大阪国際がんセンター)、名古屋大学医学部産婦人科横井暁病院講師らの研究グループは様々な種類のがん細胞において、がんの悪性化に関わると報告がされている細胞外小胞(Extracellular vesicle: EV)の分泌を制御している因子としてmiR-891bとそのマイクロRNA*3のターゲットであるPhosphoserine aminotransferase 1: PSAT1を発見しました。PSAT1は大腸がん、肺がん、乳がんをはじめとして多くのがん種で発現が高くなっています。それらPSAT1の発現量を抑制することでEVの分泌量も抑制できたことから、多くのがん種においてPSAT1がEV分泌に関わることが明らかとなりました。またPSAT1の発現は高転移性のがん細胞株で上昇しており、PSAT1の発現を抑制すると乳がんの骨転移が抑制されました。この研究成果からPSAT1によるEVの分泌抑制が新たながんの治療戦略になる可能性が示唆されました。
この研究成果は、7月23日午前11時(米国東部時間)、オープンアクセスジャーナルの「Cell Reports」に掲載されました。
背景
エクソソーム*4を含む細胞外小胞(Extracellular vesicle: EV)は、あらゆるタイプの細胞から放出される脂質二重膜に包まれた約100nmほどの小さな粒子です。これらの小胞は、細胞からのタンパク質、メッセンジャーRNA、マイクロRNA、脂質のキャリアとして機能し、それによってEVを受け取る細胞におけるシグナル伝達を誘導することが知られています。がん細胞においては正常な細胞と比較してその放出されるEVの量が多いということが明らかとなっており、その分泌されたEVを使って、がん細胞が置かれた環境に存在する他の細胞に働きかけ、自身の生存に有利に環境を作り変えてしまいます。そのため、その分泌されるEVを止めることが新たな治療につながるのではないかと考えました。どのがん細胞においても正常細胞よりEVを出しているのであれば、がんの種類によらず、共通して活性化しているがん細胞特異的なEVの分泌経路が存在すると仮定してスクリーニングを行いました。
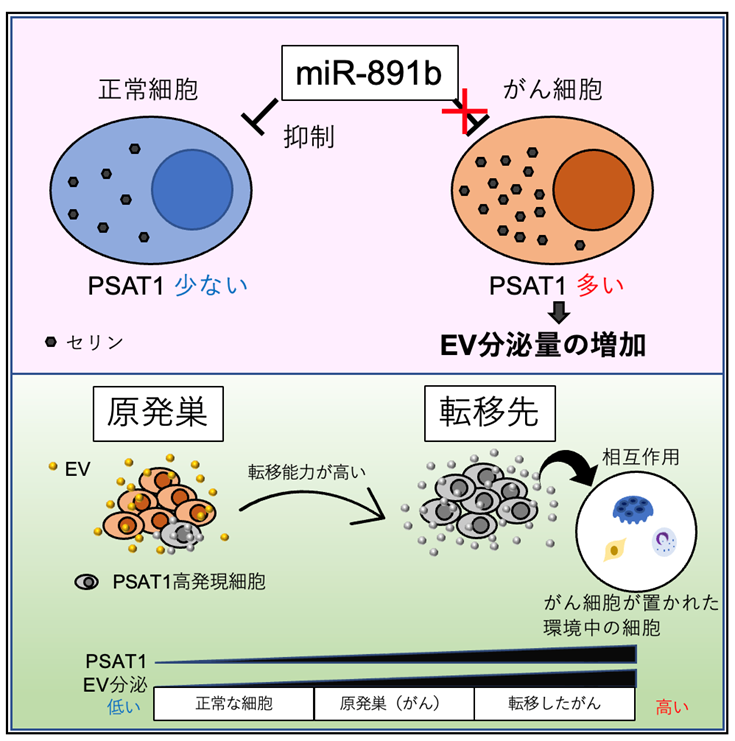
研究結果概略図(原著論文より改変)
研究成果
1. miR891bはPSAT1の発現量を制御することでEV分泌量を抑制しました
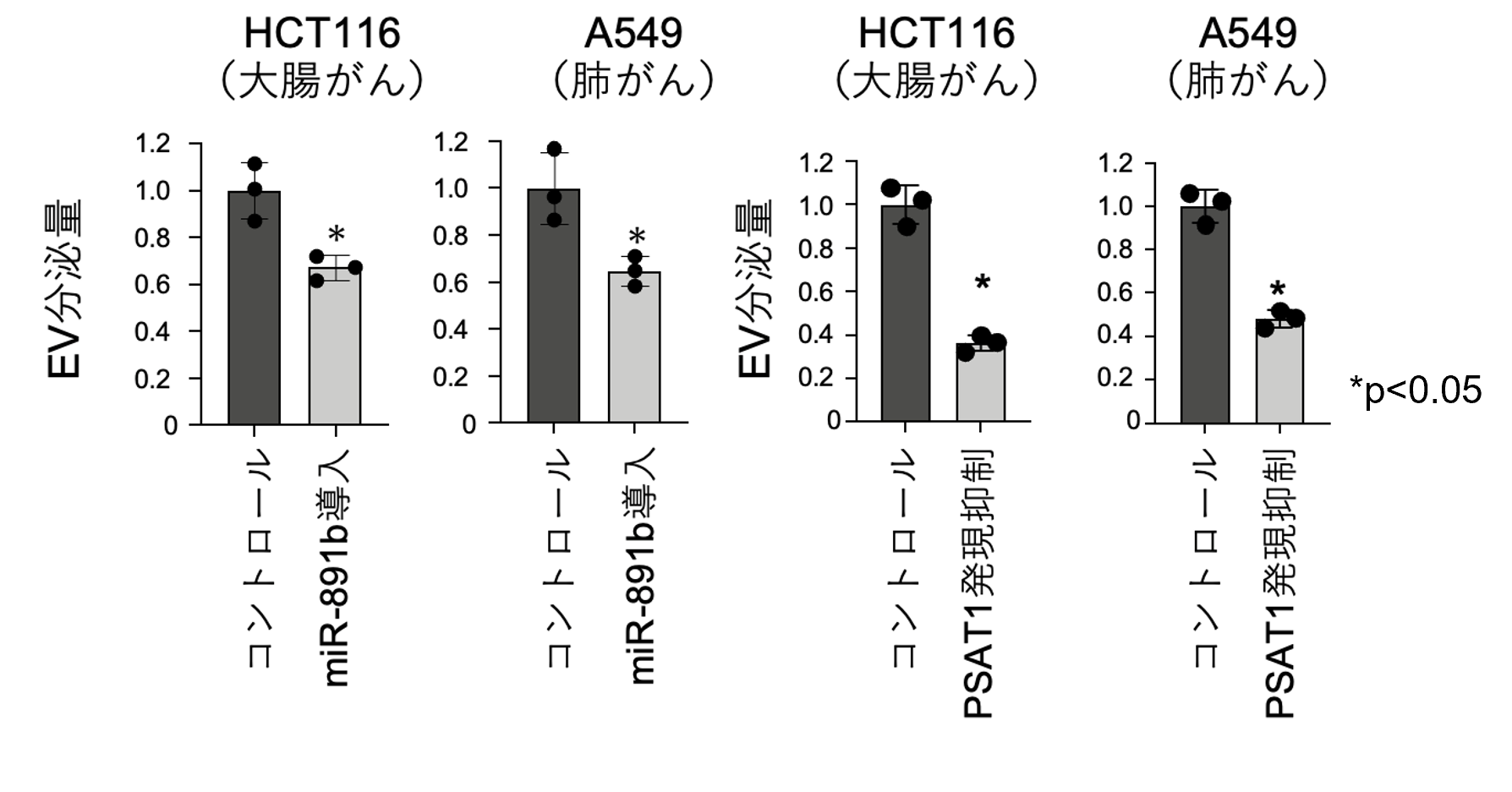
本研究ではがん細胞におけるエクソソームを含む細胞外小胞(EV)の分泌を制御する因子を同定するためにマイクロRNAライブラリーを用いて、網羅的な探索を行いました。その結果、miR-891bを導入した細胞でEVの分泌が抑制されることが明らかとなり、そのmiR-891bのターゲットとしてPSAT1を発見しました。細胞内のPSAT1をsiRNA*5を使用して抑制した際も同じようEVの分泌量が下がることが明らかとなりました(図1)。このことからmiR-891bとPSAT1ががん細胞においてEVの分泌に重要であることが判明いたしました。
図1 miR-891b導入細胞とPSAT1発現抑制細胞でのEV分泌量の比較
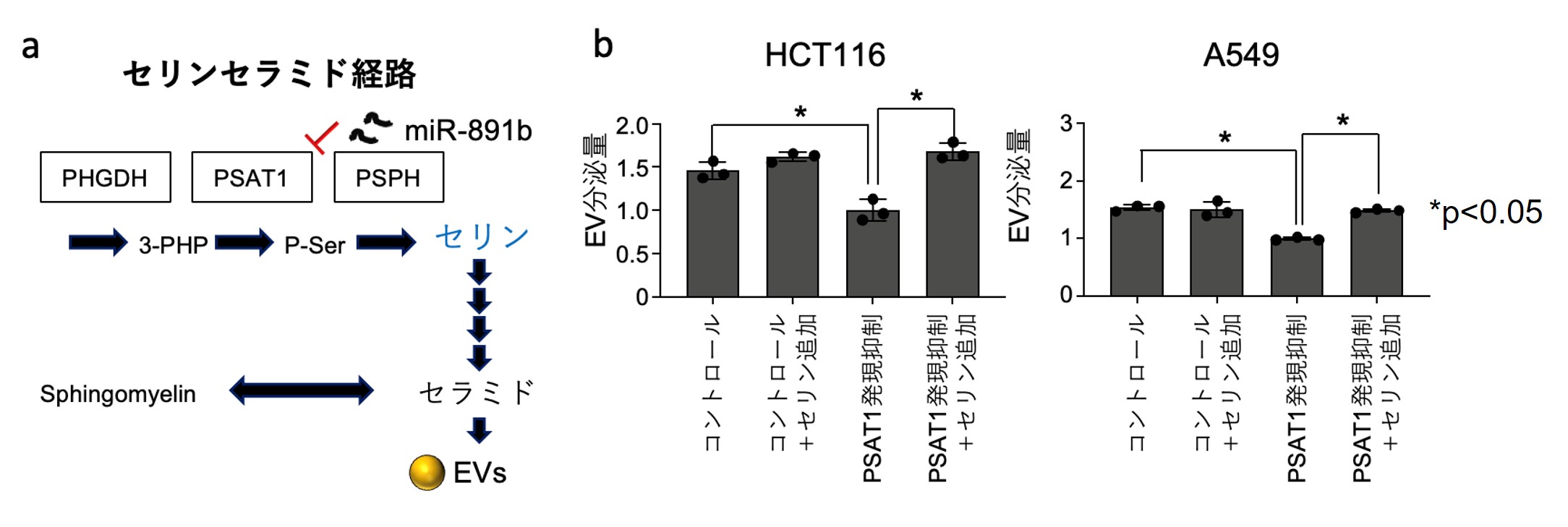
2. がん細胞におけるEV分泌にセリンセラミド経路が重要であると明らかにしました
PSAT1はセリン合成経路の酵素の1つであり、4つの反応を経てEVの重要な構成因子であるセラミドになるため(図2a)、PSAT1の発現を抑制した際に、細胞内のセリン量が低下すること、さらにセリンを外因的に添加することでEVの分泌量が回復するのか検討しました。結果としてPSAT1の発現を抑制することで低下していたEV分泌量がセリンを補充することでコントロールと同じ程度に回復したことからがん細胞のEV分泌にセリンが重要であることが明らかとなりました(図2b)。
図2 セリン添加によるエクソソーム分泌に対するレスキュー試験
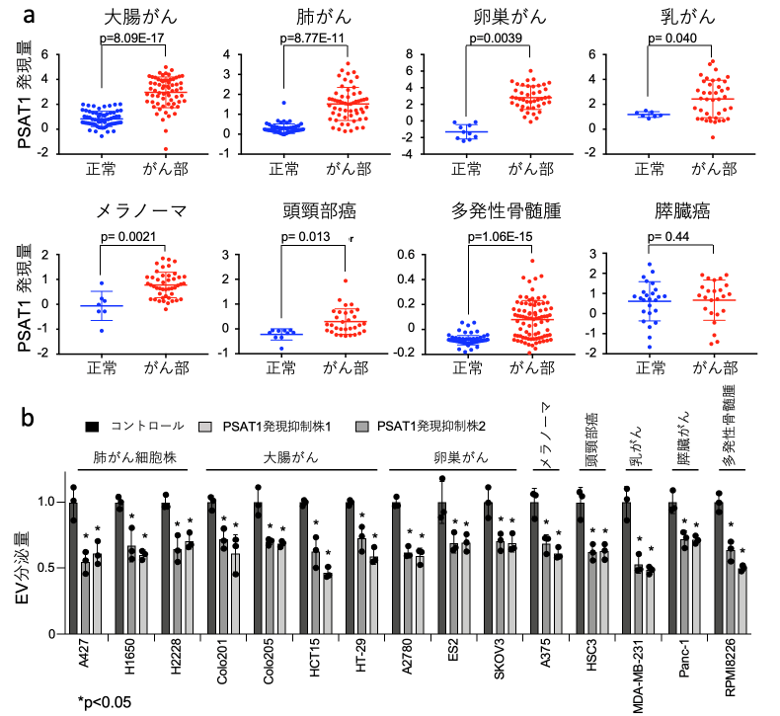
3. 多くのがん種においてPSAT1は高発現しており、EV分泌に関わることを発見しました
次に、様々ながん種におけるPSAT1の発現量とEV分泌について、公共のデータベースを利用して、正常部位とがん部位におけるPSAT1の発現量を比較しました。PSAT1の発現量は多くのがん種において正常部位と比較してがん部位での発現が高く(図3a)、がん細胞においてPSAT1がEV分泌を担っている可能性が示唆されました。実際、それらのがん細胞株を用いてPSAT1の発現を抑制したところ、どの細胞株においても一定量のEV分泌抑制効果が確認できました(図3b)。これらよりPSAT1は多くのがんにおいてEV分泌を担っていることが明らかとなりました。
図3 様々ながん種におけるPSAT1発現量とEV分泌量比較
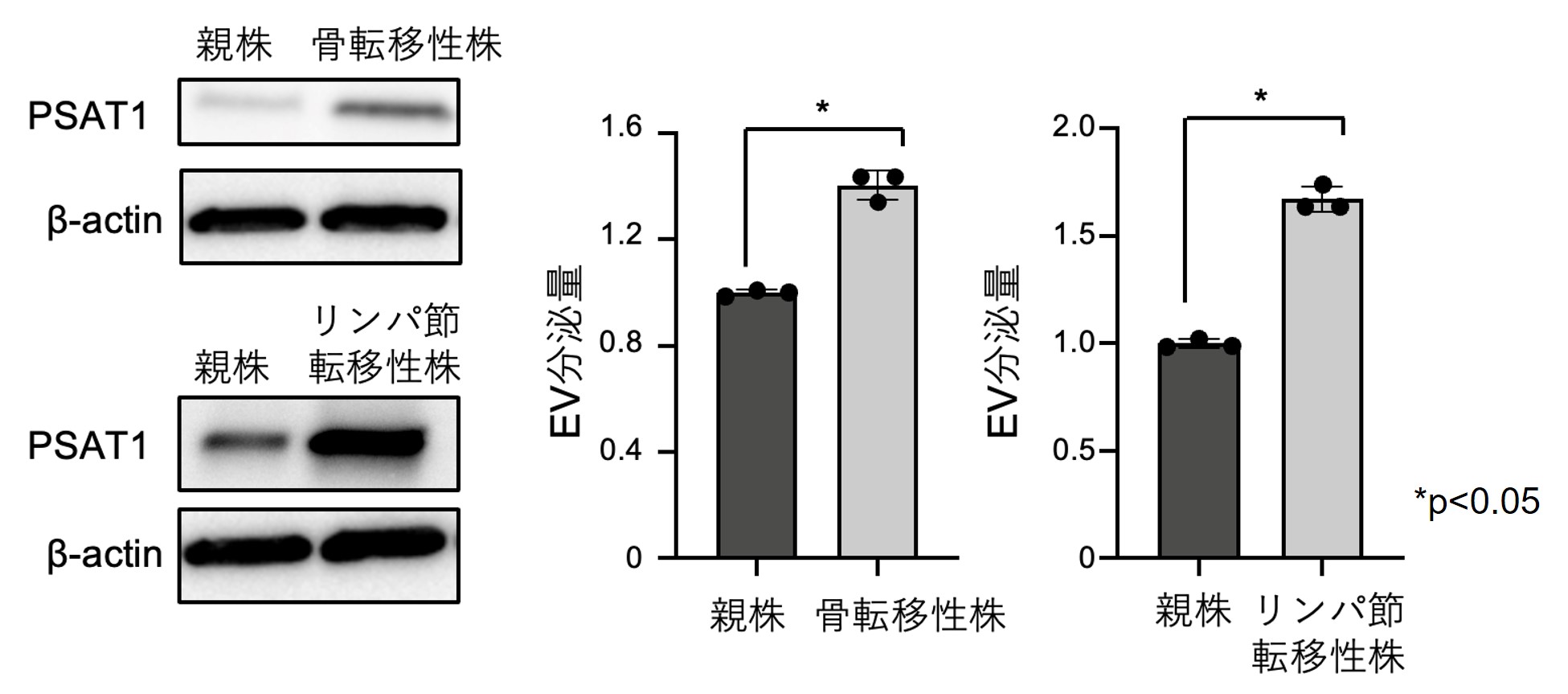
4. PSAT1は高転移性がん細胞株で高発現し、EV分泌の亢進に寄与することを同定しました
次にPSAT1で増加したEVがどのようにがんの悪性化に寄与するのかを検討したところ、同じ乳がん細胞でも親株と比較して転移する能力を獲得した細胞株の方がPSAT1の発現量が多いことを明らかにしました(図4左)。さらにその発現量に比例してEVの分泌量も上昇していたことから(図4右)、PSAT1の転移における重要性について検討しました。
図4 高転移性乳がん細胞におけるPSAT1発現量とEV分泌量比較
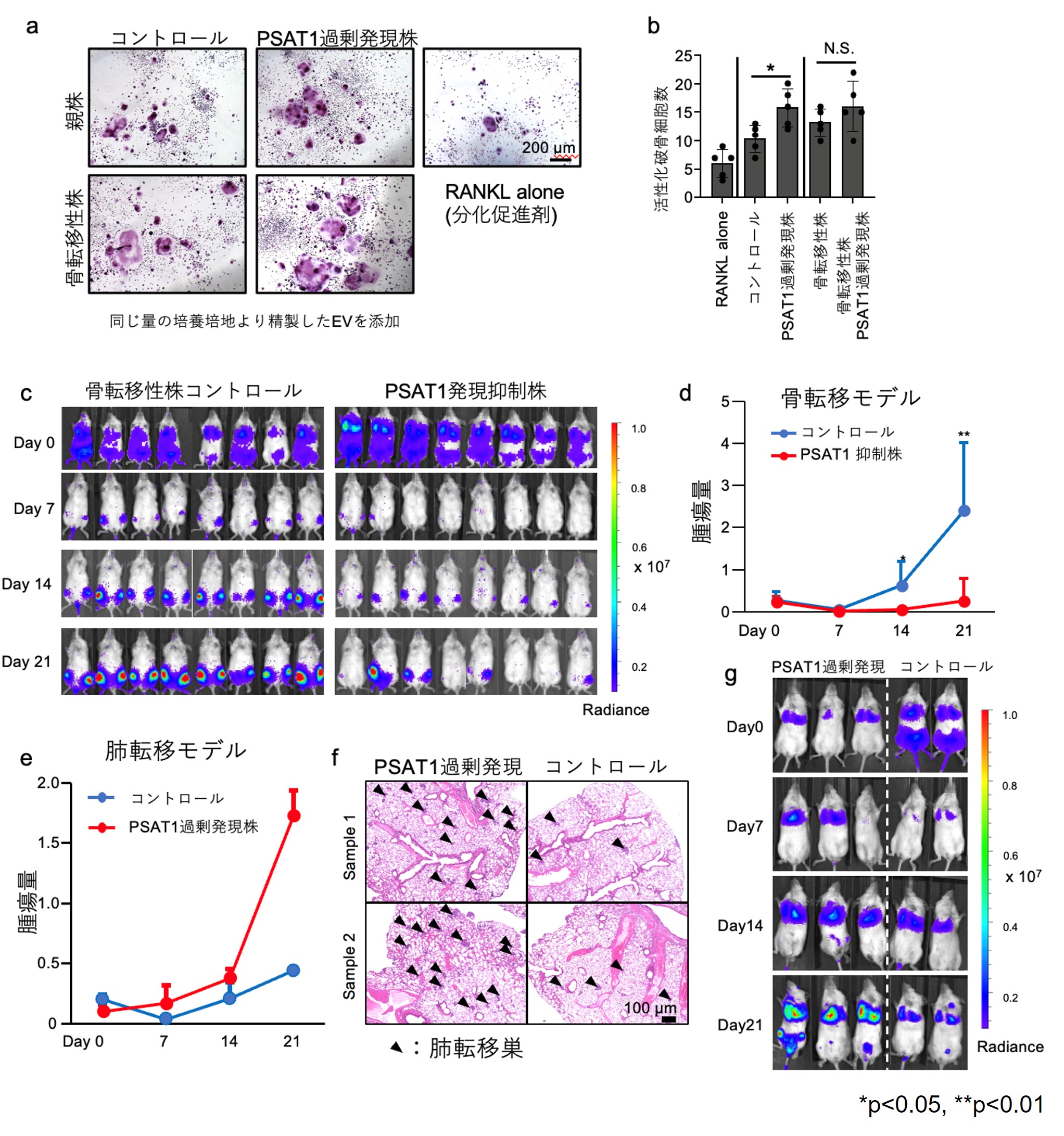
5. PSAT1はEVの分泌を介して乳がん転移を促進しました
最後に転移におけるPSAT1の役割を検討するため、乳がんの骨転移モデルと肺転移モデルを使用しました。また、PSAT1過剰発現株とPSAT1発現抑制株を準備して検討に用いました。今回乳がん骨転移細胞が出すEVを受け取る細胞として、乳がんにおける溶骨性転移において重要な役割を果たす破骨細胞を選んで、その活性化を確認いたしました。破骨細胞の活性化はTRAP染色*6で赤く細胞が染まり、成熟した破骨細胞の特徴である多核の細胞の割合で評価しました。がん細胞を同じ量の培養培地で培養し、そこから得られたEVを破骨細胞に添加したところ、PSAT1過剰発現株由来のEV、つまりより多くのEVを添加した方が、破骨細胞を活性化することが明らかとなりました(図5a-b)。PSAT1はEVの材料であるセリンをがん細胞に供給することでそのがん細胞が分泌するEVの量を増やしていると考えられ、その量の増加が重要であると示唆されました。それを裏付けるデータとして動物実験を行いました。まず、PSAT1発現抑制株を経尾動脈的に投与することで骨転移するモデルを用いたところ、コントロールと比較して、PSAT1発現抑制株ではがん細胞の骨転移が有意に抑制されました(図5c-d)。逆にPSAT1過剰発現株を経尾静脈的に投与することで肺転移をさせる肺転移モデルではPSAT1過剰発現モデルにおいて肺の微小転移の数が有意に増加することが明らかとなり(図5e-g)、PSAT1の発現は骨転移だけでなく肺転移においても重要であることがわかりました。
図5 PSAT1発現による乳がん転移への影響
展望
今回発見したセリンセラミド経路にはすでにいくつかの阻害剤があります。それらも同じようにEV分泌を抑制する効果が細胞レベルでの検討において確認されているので、治療薬として有用かどうか動物試験を行なって確かめることで、がん治療としてEV分泌抑制剤が使用できる可能性があります。また今回は乳がんの転移モデルを使用しましたが、PSAT1の発現量は多くのがん種で上昇しています。これらのがんにおける転移などへの影響も今後見ていくことで、がんの種類によらず、EVの分泌を阻害することでがんを治療する、新規治療法の開発に取り組んでいきます。
発表論文
雑誌名
Cell Reports
タイトル
Aberrant regulation of serine metabolism drives extracellular vesicle release and cancer progression
著者
Tomofumi Yamamoto+, Jun Nakayama+, Fumihiko Urabe, Kagenori Ito, Nao Nishida-Aoki, Masami Kitagawa, Akira Yokoi, Masahiko Kuroda, Yutaka Hattori, Yusuke Yamamoto*, and Takahiro Ochiya*
(*:責任著者)(+:筆頭著者)
DOI 10.1016/j.celrep.2024.114517
掲載日 2024年7月24日 日本時間0時(オンライン)
URL https://www.cell.com/cell-reports/fulltext/S2211-1247(24)00846-5
研究費
- 日本医療研究開発機構(AMED)JP18ae0101011「体液中マイクロRNA測定技術基盤開発」(研究代表者名 落谷 孝広)
- 日本学術振興会・科学研究費助成事業 基盤研究(B)(一般)「腫瘍内の機能的不均一性の解明を目指した患者由来がん細胞培養技術の開発」(研究代表者名:山本 雄介)
- 日本学術振興会・科学研究費助成事業 挑戦的研究(開拓)「超高解像度画像解析によるエクソソームの標的細胞内の情報リプログラミング機構の解明」(研究代表者名:山本 雄介)
- 高松宮妃癌研究基金・研究助成「がん特異的なエクソソーム分泌阻害による新規治療戦略の開発」(研究代表者名: 山本 雄介)
- 公益財団法人 小林がん学術振興会・研究助成「遺伝子変異依存的な小胞体ストレス誘導による呼吸器癌新規治療方法の開発」(研究代表者名: 山本 雄介)
- 公益財団法人 三島海雲記念財団・研究助成「アミノ酸が細胞外小胞分泌に与える影響の解明とその疾患への応用研究」(研究代表者名: 山本 雄介)
- 公益財団法人 がん研究振興財団・研究助成「セリン代謝酵素を標的としたがん特異的エクソソーム分泌抑制手法の開発」(研究代表者名: 山本 雄介)
- 公益財団法人 先進医薬研究振興財団・研究助成「血液中を循環するがん由来エクソソームの病態生理学的な機能解析」(研究代表者名: 山本 雄介)
用語説明
注1 細胞外小胞(Extracellular vesicle: EV)
ほとんどの細胞が分泌する100nm前後の脂質二重膜小胞で、様々なタンパク質や核酸を内包しています。分泌後、受け手細胞に取り込まれ、細胞間の情報伝達を行い、がんや神経変性疾患等の疾患形成に関与することが知られています。
注2 破骨細胞
骨再構築(骨リモデリング)過程において、骨を破壊(骨吸収)する役割を担っている細胞であり、複数の核をもつ多核巨細胞です。
注3 マイクロRNA
遺伝子ゲノム上にコードされ、20 から 25 塩基⻑で構成される微小 RNA。機能性核酸であり、他の遺伝子の発現調節を行うことで、生体内のさまざまな現象に重要な役割を担っています。
注4 エクソソーム
細胞が分泌する直径 100ナノメートル(nm)前後の小さな胞体。細胞の情報を搭載して、細胞外へ放出され、生命に重要な機能を有する。
注5 siRNA
21-23塩基対から成る低分子二本鎖RNAです。siRNAはRNA干渉(RNAi)と呼ばれる現象に関与しており、伝令RNA(mRNA)の破壊によって配列特異的に遺伝子の発現を抑制します。
注6 TRAP染色
破骨細胞のマーカーであるは酒石酸抵抗性酸性ホスファターゼ(Tartrateresistant acid phosphatase)を染色することで、破骨細胞の活性化を確認することができます。
お問い合わせ先
研究に関するお問い合わせ
東京医科大学 医学総合研究所 未来医療研究センター 分子細胞治療研究部門
特任教授 落谷 孝広
国立医薬品食品衛生研究所 生物薬品部
研究員 山元 智史
国立がん研究センター研究所 病態情報学ユニット
ユニット長 山本 雄介
広報窓口
学校法人東京医科大学 企画部 広報・社会連携推進室
国立がん研究センター 企画戦略局 広報企画室