2024-08-07 理化学研究所
理化学研究所(理研)脳神経科学研究センター 神経老化制御研究チームの綿村 直人 研究員(研究当時、現 客員研究員)、垣矢 直雅 研究員(研究当時)、西道 隆臣 チームリーダーらの国際共同研究グループは、アルツハイマー病(AD)[1]の初期病理学的因子であるアミロイドβ(Aβ)ペプチド[2]の分解酵素「ネプリライシン[3]」が、脳内神経伝達物質の一つであるドーパミン[4]によって制御されていることを発見しました。
本研究成果は、ADの予防・治療法の開発に貢献すると期待されます。
今回、国際共同研究グループは、培養細胞を用いた網羅的スクリーニングにより、ドーパミンがネプリライシンの活性を調節していることを明らかにしました。また、化学遺伝学的手法によって、腹側被蓋野(ふくそくひがいや)[5]におけるドーパミン作動性神経細胞を長期的に活性化し、ドーパミン放出を促すと、その投射先である前頭前皮質において、ネプリライシンが活性化し、アミロイドβ蓄積の減少が観察されました。さらに、薬理学的アプローチとして、パーキンソン病治療薬の「レボドパ」をADモデルマウス[6]に投与すると、ネプリライシンの発現が高まり、アミロイドβ蓄積が減少し、認知機能異常が回復することを発見しました。このことから、レボドパは、ドラッグリポジショニング[7]として、有用なAD予防薬となる可能性があることが分かりました。
本研究は、科学雑誌『Science Signaling』(8月6日号)の掲載に先立ち、オンライン版(8月6日付:日本時間8月7日)に掲載されました。
化学遺伝学的アプローチによるドーパミンのAβ蓄積に対する効果
背景
超高齢化社会を迎える日本では、加齢が主原因であるアルツハイマー病(AD)の患者数は年々増加し、医療経済や介護などの社会的負担も膨大になり、その病態解明と予防・治療方法の確立は喫緊の課題となっています。
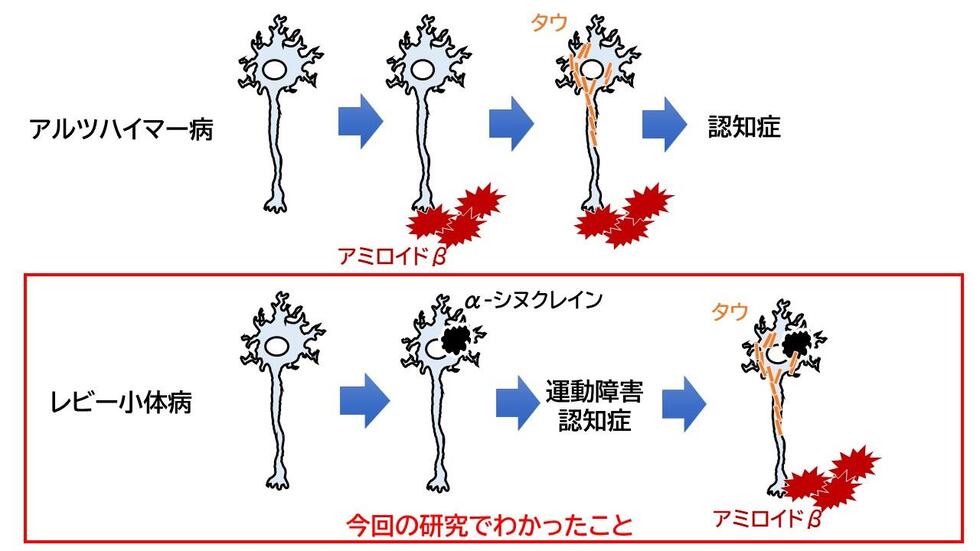
AD患者の脳では、初期病理として脳内にアミロイドβ(Aβ)ペプチドの凝集体である「老人斑」が形成され(アミロイド病理)、最終的に神経細胞死を引き起こすという仮説が強く支持されています。家族性ADでは、Aβを作る前駆体および酵素群の遺伝子変異によってAβ量が増えるのに対し、全AD患者の99%を占める孤発性ADでは「なぜ脳内にAβが蓄積するのか」という原因は特定されていません。
そこで、国際共同研究グループは、Aβ分解の異常によってAβが蓄積すると考え、脳内のAβ分解機構を理解し、それに基づく予防・治療法を確立することを目指し、研究を進めました。西道チームリーダーらはこれまでに、脳内のAβは主に「ネプリライシン」と呼ばれる分解酵素によって代謝されることを明らかにしました注1、2)。さらに脳内ペプチドの一つである「ソマトスタチン[8]」がネプリライシンの活性を制御していること注3)、また、五つのサブタイプが存在するソマトスタチン受容体の中で1と4の受容体が主にネプリライシンを制御していること注4)、さらに、その下流でKATPチャネルの内因性のリガンドである、「ENSA(α-endosulfine)[9]」が、ネプリライシンの活性をコントロールしていることを次々と明らかにしました注5)。
しかしながら、同定したこれらのパスウェイは、主に海馬に局在するネプリライシンの活性制御に関与するのに対し、大脳皮質における発現・活性調節メカニズムは不明なままでした。国際共同研究グループは、ソマトスタチン-ENSAのパスウェイ以外にも、ネプリライシンの発現・活性調節因子が存在するという仮説を立て、研究をスタートしました。
注1)2000年2月1日プレスリリース「脳内のβアミロイド分解系路を解明(PDF 1.3MB)」
注2)2001年5月21日プレスリリース「孤発性アルツハイマー病の原因解明に大きく前進(PDF 871.7KB)」
注3)Saito et al., Somatostatin regulates brain amyloid beta peptide Abeta42 through modulation of proteolytic degradation,Nat Med(2005)
注4)Nilsson et al., Somatostatin receptor subtypes 1 and 4 redundantly regulate neprilysin, the major amyloid-beta degrading enzyme in brain, Biorxiv (2010)
注5)2021年11月9日プレスリリース「アルツハイマー病の新しい治療標的を発見」
研究手法と成果
国際共同研究グループはまず、培養細胞を用いて脳内に存在する神経伝達物質およびホルモンとして同定されている因子について、網羅的スクリーニングを行い、ドーパミンがネプリライシンの活性制御因子であることを見いだしました。さらに、ドーパミンに暴露された神経細胞は、ネプリライシンを介して、培地中のAβ量を低下させました。
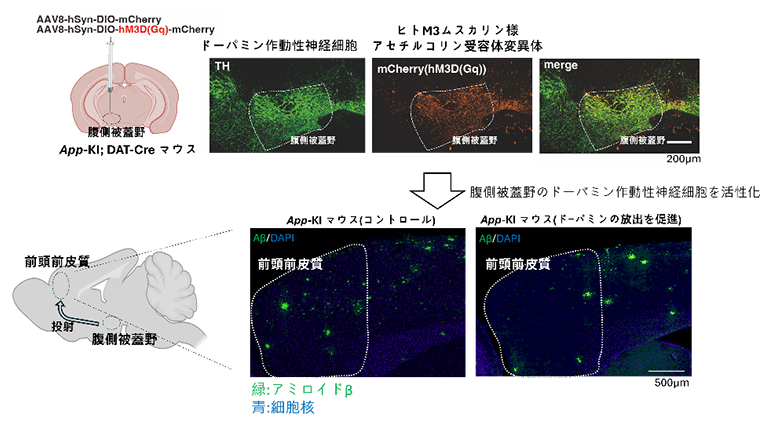
次に、ドーパミンがマウス個体内において、ネプリライシンの発現・活性調節に関与しているのかを、化学遺伝学的手法を用いて調べました。腹側被蓋野には多くのドーパミン作動性神経細胞が存在し、それらは前頭前皮質に投射していることが知られています。そこで、DREADDシステム[10]を利用し、長期間、腹側被蓋野領域のドーパミン作動性神経細胞を活性化させた後に、前頭前皮質におけるネプリライシンの発現や活性を調べました。その結果、ドーパミンはマウス個体内においても、上方発現・活性制御因子であることが分かりました(図1)。
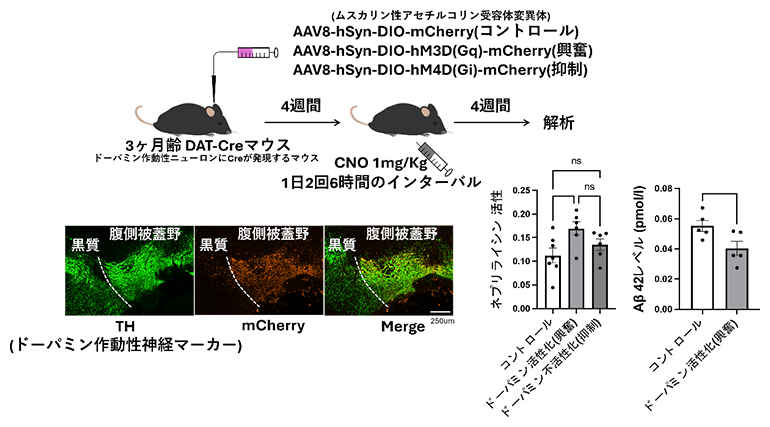
図1 前頭前皮質におけるネプリライシンを活性化するドーパミン
左図:DREADDシステムの概要図。CreはDNA組換え酵素(上)。腹側被蓋野ドーパミン作動性神経細胞選択的に活動をコントロールした(下)。
右図:腹側被蓋野ではドーパミン神経細胞活動依存的に、前頭前皮質におけるネプリライシンの活性上昇(左)およびAβ42量の低下(右)が認められた。
また、DREADDシステムをADモデルマウス(App-KIマウス)に応用したところ、前頭前皮質におけるAβの蓄積量が低減していることを発見しました。
さらに、マウス個体内におけるドーパミンの役割を、薬理学的手法を用いて調べました。パーキンソン病の治療薬として使われている「レボドパ(L-dopa):ドーパミン前駆体」をADモデルマウスに投与し、ドーパミンのアミロイド病理に対する効果を検証しました。興味深いことに、レボドパを投与すると、主に前頭前野におけるネプリライシンの発現が高まり、Aβ蓄積量の低下が認められました(図2)。
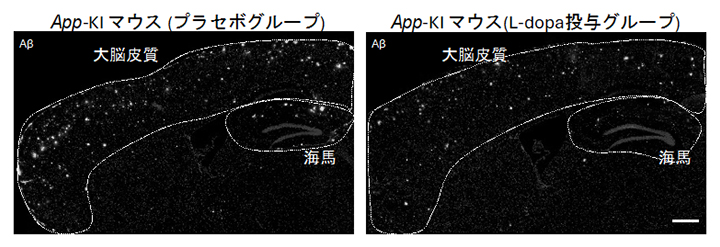
図2 L-dopaの長期投与によるAβ蓄積量の低減
左図:ADモデルマウス(App-KIマウス)の大脳皮質と海馬におけるアミロイド病理(プラセボグループ)。
右図:ADモデルマウス(App-KIマウス)の大脳皮質と海馬におけるアミロイド病理(L-dopa投与グループ)。左図に比べAβ(白い点)の蓄積量が低いことが分かる。スケールバーは500マイクロメートル(μm、μmは100万分の1メートル)。
さらに、長期間の投与によって、異常だった認知機能が回復していることも明らかになりました。
最後に、脳内ドーパミン/シグナルを介したネプリライシンの発現とADの主原因である加齢との関係性を調べるために、若齢と高齢の野生型マウスの比較解析を行いました。その結果、加齢によって、前頭前野のドーパミン量が低下すること、また、それに伴って、ネプリライシンの発現も低下することが分かりました。続いて、この加齢による影響がAD病態下だとどのように変化するのかを調べるために、高齢の野生型マウスとADモデルマウスの比較解析を行いました。その結果、ADモデルマウスの前頭前野においてドーパミン量がさらに低下していること、また、ネプリライシンの発現量もさらに低下していることが明らかになりました。これらの変化は、他の脳領域では確認されなかったことから、前頭前野におけるドーパミンはADの病態形成に関与している可能性が示唆されました。
今後の期待
本研究成果は、ネプリライシンの発現・活性メカニズムに基づいた新しい薬剤作用点を発見したことにより、ADの根本的な予防や治療法に結び付く可能性があります。特に、この研究で示したパーキンソン病の治療薬として臨床で使用されているレボドパは、アミロイド病理に対する治療効果を認められたことから、ドラッグリポジショニングとして臨床応用されることが期待できます。近年、米国食品医薬局(FDA)に承認されたAβ病理に対する抗体医薬のアデュカヌマブ[11]やレカネマブ[11]は、コスト面で大きな課題があります。レボドパはより安価で、既に臨床応用されている薬剤であるため、迅速に臨床試験を進められるメリットがあります。
また、腹側被蓋野から前頭前皮質へのドーパミン投射がAβ代謝において重要な神経回路であること示しましたが、ドーパミンがどのようにAD病態形成機構に関与するのかについては、未知であり、今後さらに知見を積み重ねていく必要があると考えられます。パーキンソン病とアルツハイマー病の関係性についても考察する必要があります。今後は、どのようにしてドーパミンがネプリライシンの活性を調節しているのかを探るため、さらに下流のメカニズムを調査していきます。同時に、Aβ抗体医薬に代わるネプリライシンを基軸とした予防・治療法の開発にも注力し、研究を続けていきます。
補足説明
1.アルツハイマー病(AD)
アルツハイマー病はドイツの精神科医、アルツハイマー博士により1905年に報告された進行性の記憶障害を伴う認知症。主に中高年で発症し、徐々に進行して生活に支障を来すようになり、最終的には意思疎通ができなくなる。日本を含む先進国では、高齢期発症の認知症のうちで最も多いタイプの疾患となっている。
2.アミロイドβ(Aβ)ペプチド
アミロイド前駆体タンパク(APP)から、複数のタンパク質分解酵素によって切断されて精製される40~42個程度のアミノ酸が連なった長さのペプチド。アルツハイマー病患者の脳に出現する老人斑と呼ばれる凝集体の主要な構成成分であり、アルツハイマー病発症に関与する重要な分子と考えられている。
3.ネプリライシン
疎水性アミノ酸残基のアミノ末端側でタンパク質のペプチド結合を切断する細胞膜結合型のタンパク質分解酵素。エンケファリナーゼ、中性エンドペプチダーゼ24.11とも呼ばれる。理研では、ネプリライシンが脳内でアミロイドβを分解する主要な酵素であることを発表注1、2)している。
4.ドーパミン
脳内の神経伝達物質の一つ。カテコールアミンであり、生体内においてはチロシンから合成される。主に、運動機能、認知機能など中枢機能の調節および報酬系に関与することが知られている。パーキンソン病では黒質におけるドーパミン作動性神経細胞の脱落が観察され、線条体におけるドーパミンが低下し、運動機能の障害が生じる。
5.腹側被蓋野(ふくそくひがいや)
中脳の一部であり、ドーパミン作動性神経細胞が多く存在する。この領域は、報酬や動機付け行動、意思決定、作業記憶などの中心的な役割を担っている。腹側被蓋野に存在するドーパミン神経細胞は前頭前皮質へ投射していることが知られている。
6.ADモデルマウス
AD病態を示す遺伝子改変マウス。西道チームリーダーらは、これまでに既存のモデルの弱点を克服した、次世代型ADモデルマウスの作製に成功している(Saito et al., 2014 Nat Neurosci; Sato et al., 2021 J Biol Chem)。
7.ドラッグリポジショニング
別の疾患の既存薬や開発中または開発中止となった医薬品化合物を新たな疾患の治療薬として転用する方法。ヒトでの安全性や体内動態が確認されており、既存の臨床データを利用できるため、新たな安全性試験などを行う必要がなく、新薬開発に要する期間・コストが縮小できる。
8.ソマトスタチン
成長ホルモンの分泌抑制因子として古くから知られている神経ペプチドの一つ。記憶学習などへの関与も報告されており、その生理作用は多岐にわたる。AD患者の脳内では、ソマトスタチンレベルが著しく低下していることが報告されており、このことは孤発性ADの発症原因は、Aβ分解系の低下によるということが示唆されている。
9.ENSA(α-endosulfine)
ENSAはATP(アデノシン三リン酸)感受性Kチャネル(KATPチャネル)の内因性のリガンドであり、細胞内のATP濃度依存性に調節されるカリウムチャネルの開閉に関与する。KATPチャネルは、スルフォニルウレア受容体(SUR)と内向き整流性K+チャネル(Kir)の二つのサブユニットから構成されるヘテロ8量体のチャネル。SURはSUR1、SUR2AおよびSUR2Bのサブユニット、KirはKir6.1およびKir6.2のサブユニットが存在する。膵島β細胞や心筋、骨格筋、中枢および末梢(まっしょう)神経細胞などに発現している。
10.DREADDシステム
DREADDは人工的に遺伝子変異を加えたGタンパク質共役受容体であり、内在性のリガンドには結合せずに、人工的に合成されたクロザピン-N-オキシド(CNO)などと結合する。細胞内シグナルを活性化または不活性化することで、神経細胞の活動をコントロールすることができる。
11.アデュカヌマブ、レカネマブ
アデュカヌマブとレカネマブは、Biogen社とエーザイ社の共同開発によって作製された。前者は不溶性Aβを標的とするモノクローナル抗体。後者は、可溶性のプロトフィブリルAβおよび不溶性凝集体を標的とするモノクローナル抗体。
国際共同研究グループ
理化学研究所 脳神経科学研究センター
神経老化制御研究チーム
研究員(研究当時)綿村 直人(ワタムラ・ナオト)
(現 客員研究員)
研究員(研究当時)垣矢 直雅(カキヤ・ナオマサ)
テクニカルスタッフⅠ(研究当時)藤岡 亮(フジオカ・リョウ)
(現 認知症病態連携研究ユニット テクニカルスタッフⅠ)
テクニカルスタッフⅠ 釜野 直子(カマノ・ナオコ)
テクニカルスタッフⅠ(研究当時)髙橋 美華(タカハシ・ミカ)
(現 脳発達病態研究チーム テクニカルスタッフⅠ)
チームリーダー 西道 隆臣(サイドウ・タカオミ)
時空間認知神経生理学研究チーム
チームリーダー 藤澤 茂義(フジサワ・シゲヨシ)
カロリンスカ研究所(スウェーデン)Center for Alzheimer Research
准教授 ニルソン・パー(Nilsson Per)
名古屋市立大学 大学院 医学系研究科
教授 斉藤 貴志(サイトウ・タカシ)
長崎大学 大学院 医歯薬学総合研究科
教授 岩田 修永(イワタ・ノブヒサ)
研究支援
本研究は、理化学研究所奨励課題(研究代表者:綿村直人)により実施し、日本医療研究開発機構(AMED)脳科学研究戦略推進プログラム「孤発性アルツハイマー病アミロイド蓄積の原因に即した治療薬と診断用バイオマーカーの開発(プロジェクトリーダー:岩田修永)」、「革新的技術による脳機能ネットワークの全容解明プロジェクト(プロジェクトリーダー:宮脇敦史、岡野栄之)」、日本学術振興会(JSPS)科学研究費助成事業若手研究「α-endosulfineによる脳内ネプリライシン活性制御機構の解明(研究代表者:綿村直人)」による助成を受けて行われました。
原論文情報
Naoto Watamura, Naomasa Kakiya, Ryo Fujioka, Naoko Kamano, Mika Takahashi, Per Nilsson, Takashi Saito, Nobuhisa Iwata, Shigeyoshi Fujisawa, Takaomi C. Saido, “The dopaminergic system promotes neprilysin-mediated degradation of β-amyloid in the brain”, Science signaling, 10.1126/scisignal.adk1822
発表者
理化学研究所
脳神経科学研究センター 神経老化制御研究チーム
研究員(研究当時)綿村 直人(ワタムラ・ナオト)
(現 客員研究員)
研究員(研究当時)垣矢 直雅(カキヤ・ナオマサ)
チームリーダー 西道 隆臣(サイドウ・タカオミ)
報道担当
理化学研究所 広報室 報道担当