2024-09-18 理化学研究所
理化学研究所(理研)生命医科学研究センター 粘膜システム研究チームの佐々木 崇晴 客員研究員、大野 博司 チームリーダーらの国際共同研究グループは、食物抗原[1]が消化器腫瘍の発症を抑制することを発見しました。
本研究成果は、食物抗原やそれによる免疫系誘導機構をターゲットとした新たな疾患予防法・治療法の開発に寄与することが期待されます。
今回、国際共同研究グループは食物抗原に着目し、食物抗原を除去した食餌(無抗原食)でマウスを飼育した研究から、食物抗原が小腸腫瘍を抑制することを見いだしました。また、腫瘍の抑制には小腸に点在する免疫誘導組織パイエル板[2]が関与することを示すとともに、食物抗原はパイエル板に局在する腸管上皮細胞の一種であるM細胞[3]からパイエル板に取り込まれ、免疫系の誘導に働くことを発見しました。さらに、1細胞RNAシーケンス法(scRNA-seq法)[4]を用いた解析から、パイエル板における食物抗原に依存する免疫細胞の挙動についても明らかにしました。
本研究は、科学雑誌『Frontiers in Immunology』オンライン版(9月18日付:日本時間9月18日)に掲載されました。
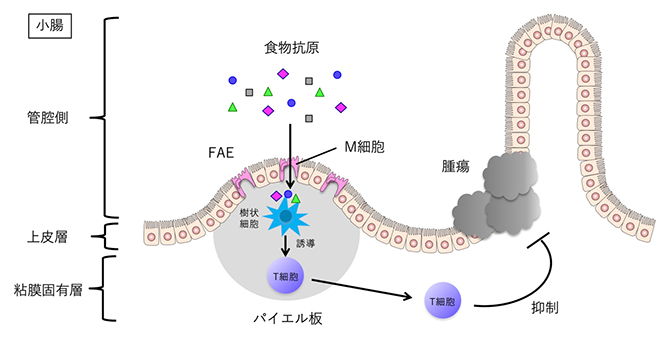
食物抗原による小腸腫瘍の抑制
背景
消化器腫瘍はその発症に遺伝的素因だけでなく食物や腸内細菌などの環境要因が関与する多因子疾患であり、治療法・予防法に関するさまざまな研究開発が世界中で展開されています。大腸腫瘍は症例数が多いことで知られていますが、小腸腫瘍は消化器腫瘍の中でも3~6%を占める、比較的希少な疾患です。そのため、小腸腫瘍に関する治療法・予防法に関する知見は少なく、発見されにくいとされています。日常生活で摂取する食物から小腸腫瘍の発症を抑制する成分を見つけることは、その予防を考える上で重要です。
近年、国際共同研究グループは腸管免疫系の誘導に食物抗原が関与することを見いだしました注)。しかし、食物抗原による腸管免疫系の誘導メカニズムと、消化器腫瘍に対する食物抗原の影響については明らかにされていませんでした。
消化器の中でも特に小腸では、パイエル板という免疫組織が免疫系の誘導に重要な役割を果たしてしています。腸の管腔(かんくう)側は上皮細胞によって覆われており、中でもパイエル板を覆う部分は濾胞随伴(ろほうずいはん)上皮細胞層(FAE)[5]と呼ばれています。FAEには腸内に存在する微生物を取り込むM細胞が分布し、M細胞はパイエル板の免疫細胞に微生物を受け渡して免疫系を誘導します。
以上の背景から、国際共同研究グループは食物抗原が消化器腫瘍の制御に働くのではないかという仮説を立て、M細胞を介した未知のメカニズムの解明に挑みました。
注)Satoko Hara et al. 2019, Dietary Antigens Induce Germinal Center Responses in Peyer’s Patches and Antigen-Specific IgA Production, Frontiers in Immunology, doi:10.3389/fimmu.2019.02432
研究手法と成果
国際共同研究グループはまず、消化器腫瘍に対する食物抗原の影響を調べるため、消化器腫瘍を自然発症するApcmin/+マウス[6]に食物抗原を除いた食餌(無抗原食)を与えて飼育し、小腸と大腸における腫瘍の数を調べました。その結果、無抗原食で飼育したApcmin/+マウスの小腸腫瘍の数が通常食で飼育したマウスと比較して増加しました(図1左)。一方、大腸では無抗原食で飼育しても腫瘍の数に変化は見られませんでした。これらの結果から、食物抗原が小腸腫瘍の発症を抑制する可能性が考えられました。
通常食と無抗原食では、食物抗原のみならず他の栄養成分の組成も異なっているため、無抗原食に代表的な食物抗原であるタンパク質抗原を添加した食餌がApcmin/+マウスの小腸腫瘍に与える影響について調べました。その結果、タンパク質抗原を添加した無抗原食では無抗原食のみで飼育したApcmin/+マウスと比較して小腸腫瘍の数が減少しました(図1右)。以上の結果から、食物抗原が小腸腫瘍の発症を抑制することが明らかになりました。
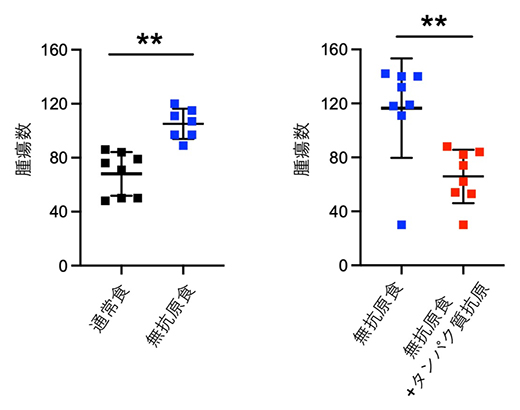
図1 食物抗原の小腸腫瘍抑制
(左)無抗原食で飼育したApcmin/+マウスの小腸腫瘍数は通常食で飼育したマウスよりも増加する。
(右)無抗原食にタンパク質抗原を添加するとApcmin/+マウスの小腸腫瘍数が減少する。p**<0.01。
国際共同研究グループのこれまでの食物抗原に関する研究から、食物抗原が小腸の免疫系の誘導に働くことが知られていました。そこで、食物抗原による小腸腫瘍の抑制にも免疫系が関与しているのではないかと考えました。
小腸ではパイエル板という免疫誘導組織が腸の中に含まれる微生物を取り込み、免疫系の誘導に働くことが知られています。そこで、パイエル板が食物抗原を取り込んで免疫系を誘導し、小腸腫瘍を抑制するのではないかと予想し、検証ました。
まず、パイエル板が小腸腫瘍の数に与える影響を調べるため、パイエル板を欠損するApcmin/+マウスを作製し、通常食で飼育したこのマウスの小腸腫瘍の数を調べました。その結果、通常のApcmin/+マウスと比べ、パイエル板を欠損したApcmin/+マウスでは、小腸の腫瘍の数が増加する(図2左)とともに、小腸の免疫細胞(小腸T細胞)の減少も認められたことから、パイエル板を介した免疫系の誘導が小腸腫瘍の抑制に働いていることが示唆されました(図2右)。これらの結果は、食物抗原がパイエル板を介して小腸腫瘍を抑制する可能性を示しています。
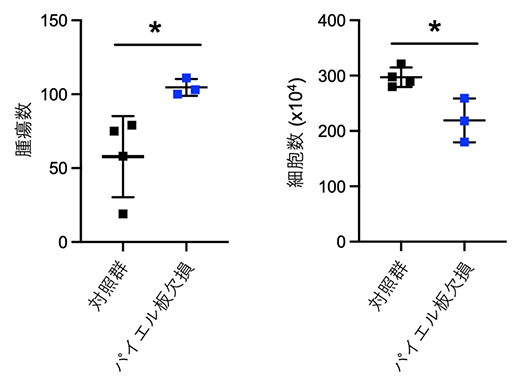
図2 パイエル板の小腸腫瘍発症抑制
(左)パイエル板欠損Apcmin/+マウスの小腸腫瘍数は正常なApcmin/+マウス(対照群)と比較して増加する。
(右)パイエル板欠損Apcmin/+マウスでは小腸T細胞の細胞数が対照群と比べ減少する。p*<0.05
次に、食物抗原がパイエル板から取り込まれ、小腸の免疫細胞誘導に働く可能性について検証しました。マウス小腸のパイエル板を含む部位の両端を結紮(けっさつ)し、その部位にタンパク質抗原を注入する実験(ループアッセイ[7])を実施してパイエル板の樹状細胞[8]をフローサイトメトリー[9]で解析しました。その結果、タンパク質抗原陽性となったことから、食物抗原がパイエル板から取り込まれパイエル板の樹状細胞に受け渡されることが分かりました。
さらに、パイエル板を覆うFAEに局在する上皮細胞のM細胞が小腸の管腔内に存在する微生物をパイエル板に取り込むことが知られていたため、食物抗原も同様にM細胞を介してパイエル板に取り込まれるのではないかと考えました。この点を検証するため、M細胞欠損マウスを用いてループアッセイによりタンパク質抗原の一種であるオボアルブミン(OVA)の取り込みを観察したところ、樹状細胞のOVA陽性率が減少したことから、食物抗原もM細胞を介してパイエル板に取り込まれることが明らかとなりました(図3)。
興味深いことに、M細胞が抗腫瘍効果を有するT細胞[10]の誘導に関与すること、ならびにM細胞が小腸腫瘍の抑制に関与することも示されました。
以上の結果は、食物抗原がM細胞を介してパイエル板に取り込まれて免疫系の誘導に働くとともに、このメカニズムが小腸腫瘍の発症を抑制する可能性を強く示唆しています。
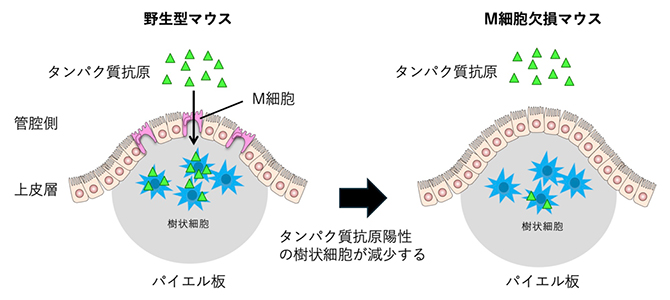
図3 M細胞は食物抗原を樹状細胞に受け渡す仲介役
野生型マウスの小腸にタンパク質抗原を注入すると、タンパク質抗原がM細胞を介してパイエル板の樹状細胞に受け渡される。M細胞欠損マウスで同様の実験を行うと、タンパク質抗原を受け取る樹状細胞が減少する。
食物抗原がパイエル板におけるT細胞の誘導に大きく寄与することが分かったことから、パイエル板のT細胞をscRNA-seq法で解析しました。その結果、T細胞のほとんどが食物抗原によって誘導されていることが分かりました(図4)。また、T細胞に抗原を提示する樹状細胞についてもscRNA-seq法によって解析を行い、食物抗原によるT細胞の機能変化を誘導するリガンド[11]分子候補を65分子見つけました。これらのうち、ヘルパーT細胞の誘導に関与するH2-DMaや、抗腫瘍作用を有するキラーT細胞の誘導に関与するH2-M3、H2-T23といったMHC[12]タンパク質をコードする遺伝子の発現が、食物抗原によって変化を受けることが分かりました。以上の結果は、食物抗原がT細胞の誘導に関与するのみならず、樹状細胞の機能そのものを変化させることによって腫瘍の発症を抑制する可能性を示しています。
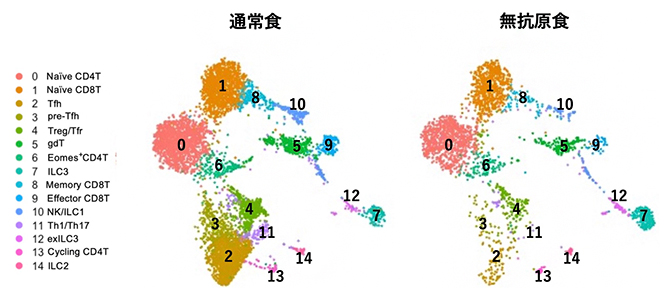
図4 食物抗原によって誘導されるT細胞の違い
通常食、もしくは無抗原食で飼育した野生型マウスのパイエル板をscRNA-seq法で解析した。この解析では、図中で異なる色および番号で示すように、免疫細胞のさまざまなサブセットを分類し可視化できる。その結果、無抗原食で飼育したマウスではさまざまなT細胞の減少が見られ、食物抗原がパイエル板の大部分のT細胞の誘導に関与していることが分かった。
今後の期待
本研究では、食物抗原が免疫系を介して小腸腫瘍を抑制することを発見しました。Apc遺伝子は家族性大腸腺腫症の原因遺伝子であり、家族性大腸腺腫症においても本来まれな小腸腫瘍が比較的見られやすいので、その制御においても食物抗原が重要である可能性があります。今後、本研究成果は食物抗原やパイエル板をターゲットとした消化器腫瘍の予防・治療法開発に貢献することが期待されます。
近年、腸管免疫系が腫瘍だけでなく代謝性疾患やアレルギー疾患などのさまざまな疾患制御に関与することが知られるようになり、本研究を契機として、食物抗原の生理的意義が広く解明されていく可能性が考えられます。
補足説明
1.食物抗原
樹状細胞([8]参照)のような抗原提示細胞によって断片化されてT細胞([10]参照)に提示され、T細胞の活性化を誘導する分子を抗原といい、一部例外を除いてはタンパク質である。食物に含まれる抗原を食物抗原という。抗原として働く分子は主に高分子であるため、本研究では特に10キロダルトン(kDa)以上の高分子のことを指す。kはキロ、Daはダルトンで質量数12の炭素を基準とした相対的な質量。
2.パイエル板
小腸に点在する免疫誘導組織であり、リンパ節と同様に抗原提示の場としての役割を持つ。ただし、パイエル板は微生物などを腸管から直接取り込むことができる点において他のリンパ節とは異なる。
3.M細胞
M(Microfold)細胞は小腸の腸管上皮の中でもパイエル板を覆う濾胞随伴(ろほうずいはん)上皮細胞層(FAE)([5]参照)に局在する上皮細胞である。M細胞は腸内に存在する抗原をパイエル板の中に取り込む機能を有する。
4.1細胞RNAシーケンス法(scRNA-seq法)
組織や細胞における全遺伝子の発現を網羅的に定量する解析方法をトランスクリプトーム解析という。近年、細胞1個を用いたトランスクリプトーム解析を行うことが技術的に可能となり、これを1細胞RNAシーケンス法(scRNA-seq法)という。数千個分の細胞に関して同時にscRNA-seq法解析を実施することが可能である。scRNA-seqはsingle cell RNA-sequenceの略。
5.濾胞随伴(ろほうずいはん)上皮細胞層(FAE)
パイエル板の管腔(かんくう)側を覆う上皮細胞層をいう。FAEには5~10%の割合でM細胞が存在している。FAEはFollicle-Associated Epitheliumの略。
6.Apcmin/+マウス
Apc遺伝子はもともと家族性大腸腺腫症(Familial adenomatous polyposis: FAP)の原因遺伝子として同定された遺伝子である。Apcmin/+マウスは、Apc遺伝子の片方に変異を持つマウスであり、家族性大腸腺腫症と同様に腸腫瘍が発生しやすい特徴を持つ。
7.ループアッセイ
生きた組織の応答を観察する実験手法。麻酔下の実験動物を用い、小腸のパイエル板を含む部分の両端を結紮(けっさつ)して閉空間(ループ)を作る。このループに抗原溶液を充填(じゅうてん)し、生体組織の応答を観察する。このようにして、抗原がパイエル板へ移行するかどうかを調べることができる。
8.樹状細胞
白血球の一種であり、抹消(まっしょう)では樹枝状の突起を伸ばしていることを特徴とする細胞。体内に侵入した食物や微生物由来の断片(抗原)を貪食し、その一部をMHC分子に結合させT細胞に提示する機能(抗原提示)を担う。
9.フローサイトメトリー
蛍光色素で標識した抗体を反応させ、1個1個の細胞にレーザー光を照射し、その散乱光や蛍光を測定することで、細胞の情報を取得したり、特定の細胞を分取したりする技術。
10.T細胞
リンパ球の一種であり、骨髄由来の未熟なリンパ球が胸腺で分化・成熟するので、胸腺(Thymus)の頭文字をとってT細胞と呼ばれる。T細胞は樹状細胞などの抗原提示細胞からMHC分子([12]参照)によって提示された抗原情報を受け取り、活性化する。機能は多岐にわたるが、中でも1型ヘルパーT細胞というT細胞は抗がん作用を有することが知られており、本研究ではこの細胞がM細胞を介して誘導されることが分かった。
11.リガンド
特定の生体分子と結合することで、生理的な作用を発揮する物質のこと。一般的には受容体に結合する分泌因子(ホルモンや成長因子など)を指すことが多い。
12.MHC
主要組織適合遺伝子複合体(Major Histocompatibility Complex:MHC)をコードし、臓器移植の際の拒絶反応に関与するタンパク質群。このタンパク質群は抗原提示に関わるタンパク質群(MHCタンパク質)をコードする。MHCタンパク質は食物、ウイルス、細菌などに由来する非自己タンパク質の断片をその先端に収容し、T細胞に提示するために用いられる。このような機構により、T細胞が活性化して免疫応答が誘導される。
国際共同研究グループ
理化学研究所 生命医科学研究センター
粘膜システム研究チーム
チームリーダー 大野 博司(オオノ・ヒロシ)
客員研究員 佐々木 崇晴(ササキ・タカハル)
(基礎科学特別研究員(研究当時))
研修生(研究当時) 太田 悠奈(オオタ・ユウナ)
研修生(研究当時) 滝川 由衣(タキカワ・ユイ)
副チームリーダー(研究当時)金谷 高史(カナヤ・タカシ)
テクニカルスタッフⅠ 髙橋 ますみ(タカハシ・マスミ)
テクニカルスタッフⅠ 新 奈緒子(アタラシ・ナオコ)
テクニカルスタッフⅡ 橘 直子(タチバナ・ナオコ)
エピゲノム技術開発ユニット(研究当時)
ユニットリーダー(研究当時)蓑田 亜希子(ミノダ・アキコ)
研究員(研究当時)トミー・テロオアテア(Tommy Terooatea)
テクニカルスタッフⅠ(研究当時)藪上 春香(ヤブカミ・ハルカ)
(現 生命医科学研究センター 免疫器官形成研究チーム テクニカルスタッフⅠ)
浦項工科大学校(大韓民国)
教授(故人・研究当時)チャールズ・D・サー(Charles D. Surh)
助教授 クヮン・スーン・キム(Kwang Soon Kim)
研究支援
研究本研究は、日本学術振興会(JSPS)科学研究費助成事業の若手研究「食物に含まれる抗原は腸に発生する癌の制御因子となるのか?(研究代表者:佐々木崇晴)」「食物抗原が消化器腫瘍を抑制する機構の解析(研究代表者:佐々木崇晴)」、同基盤研究(A)「宿主ー腸内細菌叢相互作用が宿主の病理に及ぼす影響の研究(研究代表者:大野博司)」、同基盤研究(B)「食物繊維が小腸免疫系を発達させる仕組みの解明(研究代表者:金谷高史)」、同基盤研究(C)「腸管免疫系における高度不飽和脂肪酸の機能解析(研究代表者:佐々木崇晴)」、日本医療研究開発機構(AMED)ムーンショット型研究開発事業「健康寿命伸長にむけた腸内細菌動作原理の理解とその応用(研究代表者:本田賢也、JP23zf0127007h0002)」、武田科学振興財団、安藤スポーツ・食文化振興財団による助成を受けて行われました。
原論文情報
Takaharu Sasaki, Yuna Ota, Yui Takikawa, Tommy Terrooatea, Takashi Kanaya, Masumi Takahashi, Naoko Taguchi-Atarashi, Naoko Tachibana, Haruka Yabukami, Charles D. Surh, Aki Minoda, Kwang Soon Kim and Hiroshi Ohno, “Food antigens suppress small intestinal tumorigenesis”, Frontiers in Immunology, 10.3389/fimmu.2024.1373766
発表者
理化学研究所
生命医科学研究センター 粘膜システム研究チーム
チームリーダー 大野 博司(オオノ・ヒロシ)
客員研究員 佐々木 崇晴(ササキ・タカハル)
報道担当
理化学研究所 広報室 報道担当