2024-09-20 国立がん研究センター,埼玉医科大学国際医療センター,日本臨床腫瘍研究グループ
発表のポイント
- 手術療法の対象とならない大腸がん(切除不能大腸がん)患者さんに対する初回の抗がん剤治療として、フッ化ピリミジン(FU)とベバシズマブ(BEV)にオキサリプラチン(OX)を加えた3剤併用療法(FU+OX+BEV)が標準治療の一つとして確立しています。
- しかし、この3剤併用療法(FU+OX+BEV)の高齢者におけるオキサリプラチン(OX)の上乗せ効果は必ずしも明らかではありませんでした。大腸がんと診断される方の半数近くは75歳以上の高齢者で、また高齢者では抗がん剤の副作用が生じやすく重症化するリスクも高いことから、高齢者での検証が求められていました。
- そこで、日本臨床腫瘍研究グループ(JCOG)は、高齢の切除不能大腸がんの患者さんを対象としてFU+BEVの2剤併用療法に対するOXの上乗せ効果を検証するランダム化第III相試験を行いました。
- 本試験の結果、高齢者においてはFU+BEVに対するOXの上乗せ効果は認められず、OXを追加することで、かえって副作用が強くなることが示唆されました。このため、高齢の切除不能大腸がんの患者さんに対する初回の抗がん剤治療は、3剤併用療法(FU+OX+BEV)ではなく、FU+BEVの2剤併用療法が推奨されることが示されました。
- 本試験の成果は、手術療法の対象とならない高齢の大腸がん患者さんにおける新たな標準治療を示したことが世界的に評価され、医学雑誌「Journal of Clinical Oncology」に掲載されました。
概要
国立研究開発法人国立がん研究センター(所在地:東京都中央区、理事長:中釜斉)中央病院(病院長:瀬戸泰之)が、中央支援機構(データセンター/運営事務局)を担い支援する日本臨床腫瘍研究グループ(Japan Clinical Oncology Group:JCOG)では、科学的証拠に基づいて患者さんに第一選択として推奨すべき最善の治療である標準治療や診断方法等を確立するため、専門別研究グループで全国規模の多施設共同臨床試験を実施しています。
このたび、JCOG大腸がんグループは、手術療法の対象とならない大腸がん(切除不能大腸がん)患者さんに対する標準治療である抗がん剤治療が、高齢の患者さんにとっても適正かどうかを検証するランダム化第III相試験(JCOG1018)を行いました。
切除不能大腸がん患者さんに対する初回治療は、フッ化ピリミジン(FU)、ベバシズマブ(BEV)の2剤併用療法(FU+BEV)にオキサリプラチン(OX)を加えた3剤併用療法(FU+OX+BEV)が標準治療の一つとして確立しています。しかし、臨床試験の多くは75歳以下を対象とし、また年齢制限がない場合も参加条件を満たさないことにより高齢者での検証は十分ではありませんでした。一方で、大腸がんと診断される方の半数近くは75歳以上の高齢者で、また高齢者では臓器機能障害や併存症を有していることが多く、副作用が生じやすく重症化するリスクもあることから、本治療の高齢者における有効性と副作用を検証するため本試験を行いました。
本試験の結果、2剤併用療法(FU+BEV)に対するオキサリプラチン(OX)の上乗せ効果は認められず、オキサリプラチン(OX)を追加することで、かえって副作用が強くなることが示唆されました。このため、高齢の切除不能大腸がん患者さんの初回の抗がん剤治療は、3剤併用療法(FU+OX+BEV)ではなく、FU+BEVの2剤併用療法が推奨されることが示されました。
本試験の成果は、手術療法の対象とならない高齢の大腸がん患者さんにおける新たな標準治療を示したことが世界的に評価され、医学雑誌「Journal of Clinical Oncology」(日本時間2024年8月26日付)に掲載されました。JCOGでは、高齢のがん患者さんにとって最善の医療を確立するための臨床試験を今後も推進してまいります。
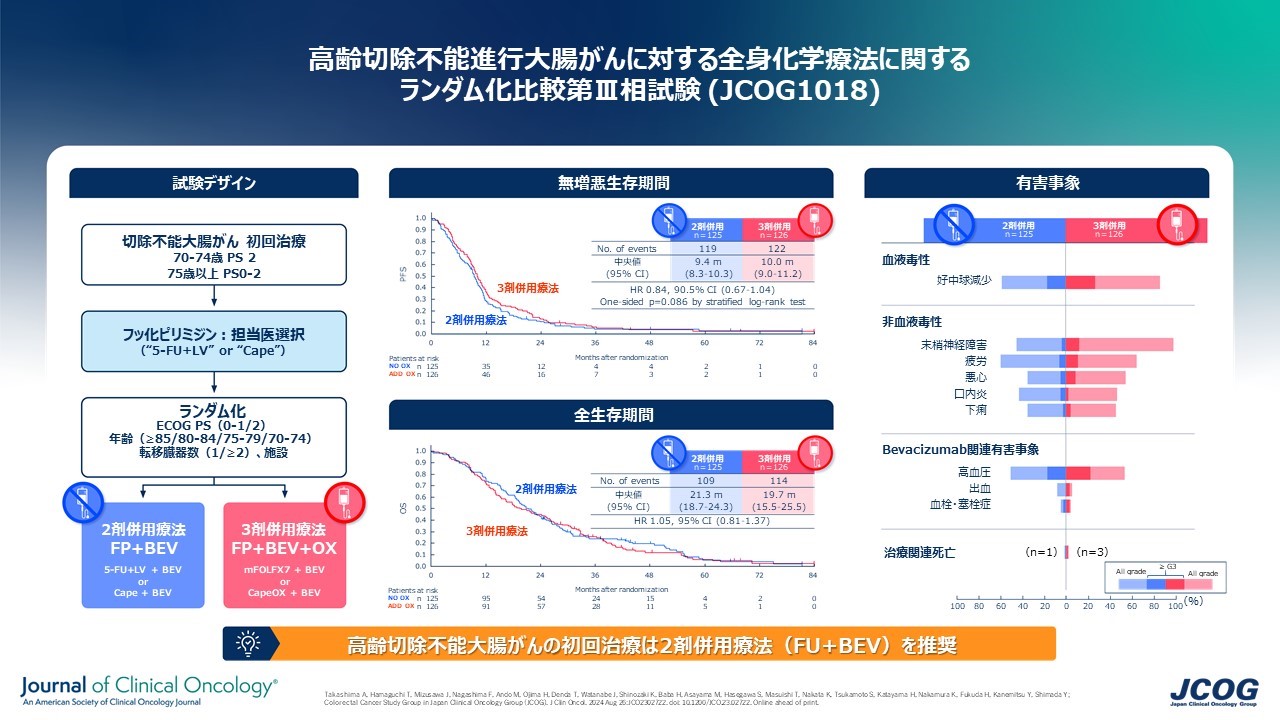
図1 高齢切除不能進行大腸がんに対する全身化学療法に関するランダム化比較第III相試験(JCOG1018)の全体像
背景
臨床試験の多くは、安全性の懸念により参加年齢に制限を設け75歳以下を対象としています。年齢の制限が無い場合でも、高齢者は臓器機能障害や併存症により参加条件を満たさないことや、臨床試験に参加している病院への定期通院が難しいなどにより、臨床試験に参加できる高齢者は少ないのが現状です。
一方わが国は、2070年には約4人に1人が75歳以上となることが推計され(内閣府「令和6年版高齢社会白書」)、世界に先駆けての高齢者に対するがん医療の科学的エビデンスの創出と、高齢のがん患者にとっても副作用や効果の面で優れた新規医薬品の開発が求められます。そのためJCOGでは、近年、臨床試験での年齢の制限は設けず、また高齢者を対象とした臨床試験も実施しています。
研究方法
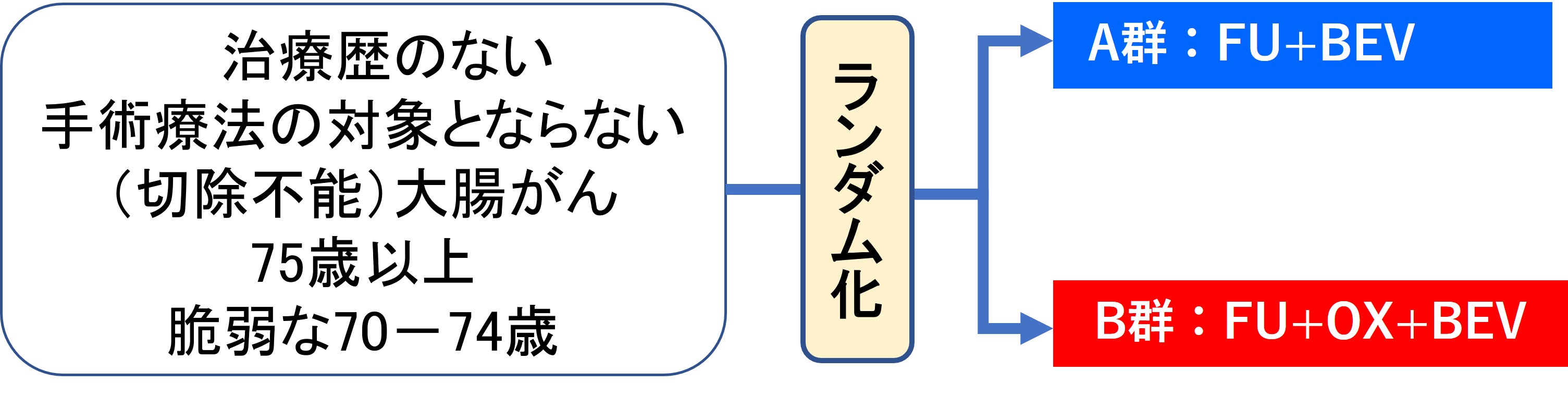
70歳以上(脆弱な70~74歳および75歳以上)の治療歴のない切除不能大腸がんの患者さんを対象に、2剤併用療法(FU+BEV)に対し、3剤併用療法(FU+OX+BEV)が優れているかどうか検証するランダム化第III相試験(JCOG1018)を行いました。2剤併用療法(FU+BEV)をA群、3剤併用療法(FU+OX+BEV)をB群とし、患者さんはランダム(無作為)に振り分けられ、いずれかの治療を受けていただきました(図2)。FUの投与方法を点滴(5-FU/l-LV)とするか、経口(カペシタビン(Cape))とするかは、医師が選択しました。
図2 試験の概要
主たる評価項目は「無増悪生存期間(試験の登録日から疾患が悪化せずに患者さんが生存している期間)」、副次的評価項目は「全生存期間(試験の登録日から患者さんが生存している期間)」、「奏効割合(治療効果が得られて一定以上腫瘍が縮小した患者さんの割合)」、「有害事象発生割合」、「重篤な有害事象発生割合」、「QOL(生活の質)」としました。
研究結果
2012年9月から2019年3月までに251名が登録されました(A群:FU+BEV 125名、B群:FU+OX+BEV 126名)。登録された患者さんの年齢の中央値はA群 80歳(70歳から91歳)、B群 79歳(71歳から89歳)でした。
本試験では、B群の無増悪生存期間が、標準治療であるA群の無増悪生存期間を統計学的に上回り、かつ、B群の全生存期間が、標準治療であるA群の全生存期間を上回っている場合に有効と判断すると規定していました。結果として、B群に対するA群のハザード比注1は、無増悪生存期間で0.84(90.5%信頼区間0.67–1.04, p=0.086)(図3)、全生存期間で1.05(95%信頼区間0.81–1.37)と、B群の優越性を示すことは出来ませんでした(図4)。
一方で、奏効割合は、A群が29.5%、B群が47.7%でありB群のほうが腫瘍縮小効果は高いことが示されました。副作用においては、重い副作用(グレード3注2以上)の割合はB群のほうが高く、特に好中球減少、悪心、下痢、倦怠感、末梢神経障害がより多く見られました(表1)。
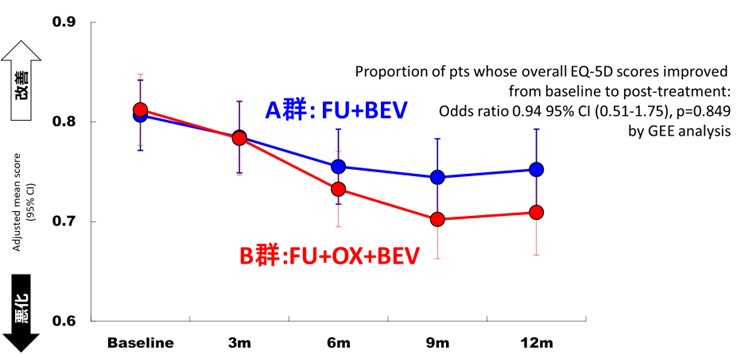
治療を受けた患者さんのQOLスコアの変化に差が無いかどうかも検討しましたが、両群で差は認めませんでした(図5)。
図3 無増悪生存期間
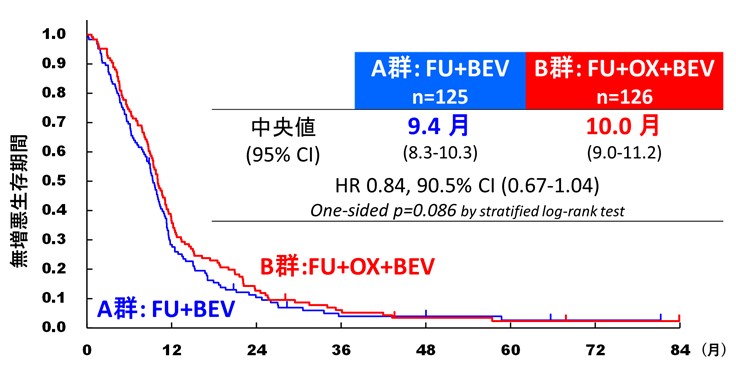
図4 全生存期間
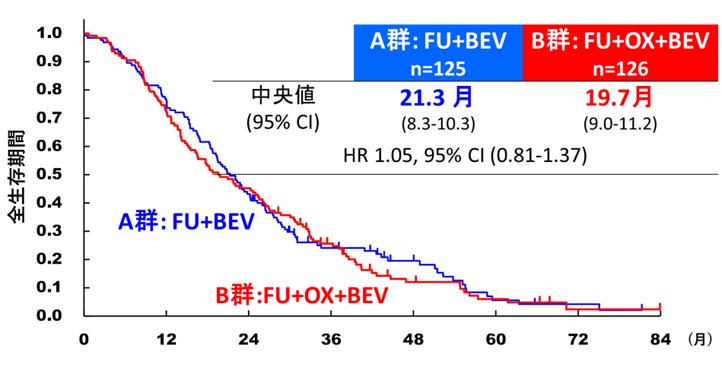
表1 主な副作用(グレード3以上の重い副作用の割合)
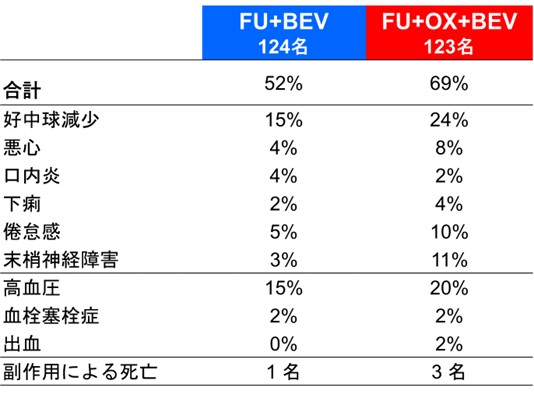
図5 QOLスコア(EQ-5D)
展望
高齢者の参加が少なかった既報の臨床試験においては、2剤併用療法(FU+BEV)に対するオキサリプラチン(OX)の上乗せ効果が示されていましたが、高齢者のみを対象とした本試験では、オキサリプラチン(OX)の上乗せ効果を示すことは出来ず、追加することで副作用が強くなることが示唆されました。このことから、高齢の切除不能大腸がん患者さんの初回抗がん剤治療の標準治療はFU+BEVが推奨されることになります。
日本の診療ガイドラインでは、全身状態や主要臓器機能、併存疾患などのため、OXの併用療法に対する忍容性に問題があると判断される患者さんに対する初回抗がん剤治療の標準治療の一つとして2剤併用療法(FU+BEV)が推奨されています。本試験の結果をもとに、高齢の患者さんは前述の忍容性に問題があると判断される患者さんに含まれることが明らかとなりました。また、高齢者に対する抗がん剤治療の適正化につながることが期待されます。
今後さらなる高齢化社会を迎える日本が世界に先駆けて、高齢者に対する治療開発を牽引することは急務です。JCOGでは、大腸がん以外のグループでも高齢者に対する治療開発が行われており、高齢者研究委員会によって高齢がん患者さんを対象とした研究が最適に行われるようJCOGの全研究グループをサポートしています。
今後も引き続き、高齢な患者さんにとって最善の医療を確立するための臨床試験を推進してまいります。
論文情報
雑誌名
Journal of Clinical Oncology
タイトル
Oxaliplatin added to fluoropyrimidine/bevacizumab as initial therapy for unresectable metastatic colorectal cancer in older patients: a multicenter, randomized, open-label phase 3 trial (JCOG1018)
著者
Atsuo Takashima, Tetsuya Hamaguchi, Junki Mizusawa, Fumio Nagashima, Masahiko Ando, Hitoshi Ojima, Tadamichi Denda, Jun Watanabe, Katsunori Shinozaki, Hideo Baba, Masako Asayama, Seiji Hasegawa, Toshiki Masuishi, Ken Nakata, Shunsuke Tsukamoto, Hiroshi Katayama, Kenichi Nakamura, Haruhiko Fukuda, Yukihide Kanemitsu, Yasuhiro Shimada, Colorectal Cancer Study Group in Japan Clinical Oncology Group (JCOG)
DOI
10.1200/JCO.23.02722
掲載日
2024年8月26日付
URL
https://ascopubs.org/doi/10.1200/JCO.23.02722(外部サイトにリンクします)
研究費
国立研究開発法人日本医療研究開発機構(AMED) 革新的がん医療実用化研究事業 「超高齢者社会における治癒困難な高齢切除不能進行再発大腸癌患者に対する標準治療確立のための研究」 (15ck0106076h0002, 16ck0106076h0003, 17ck0106346h0001, 18ck0106346h0002, 19ck0106346h0003, 20ck0106346h0004)
日本臨床腫瘍研究グループ(JCOG:Japan Clinical Oncology Group)の概要
日本臨床腫瘍研究グループは、新しい治療法の開発や検証的試験の実施を通じて、科学的証拠に基づいて第一選択として推奨すべき治療である標準治療や診断方法等の最善の医療を確立することを目的として研究活動を行っています。各種がんの治癒率の向上とがん治療の質の向上を図ることを目標としています。
JCOGは国立がん研究センター研究開発費、日本医療研究開発機構研究費を主体とする公的研究費によって助成される研究班を中心とする多施設共同臨床研究グループで、がん診療連携拠点病院を中心とした医療機関の研究者で構成される専門分野別研究グループと国立がん研究センターが管轄する中央支援機構(国立がん研究センター中央病院臨床研究支援部門)および各種委員会から構成されており、法人格を有さない任意団体です。
JCOGウェブサイト: http://www.jcog.jp/index.html(外部サイトにリンクします)
高齢者研究委員会: https://jcog.jp/org/committee/gsc/(外部サイトへリンクします)
用語解説
注1 ハザード比
死亡あるいは増悪のリスクが何倍かを示す数値。
注2 グレード 3
医薬品等の副作用の重篤度分類基準を示したもので、1~5の5つのグレードに分類されます。
グレード3の副作用は、日常生活に影響がある、または入院が必要となる程度の副作用であることを意味します。
お問い合わせ先
研究に関するお問い合わせ
国立研究開発法人国立がん研究センター
中央病院 消化管内科
高島 淳生
日本臨床腫瘍研究グループに関するお問い合わせ
国立研究開発法人国立がん研究センター
中央病院 臨床研究支援部門 研究企画推進部 多施設研究支援室
広報窓口
国立研究開発法人国立がん研究センター
企画戦略局 広報企画室
埼玉医科大学
広報室