2024-11-22 大阪大学,科学技術振興機構
ポイント
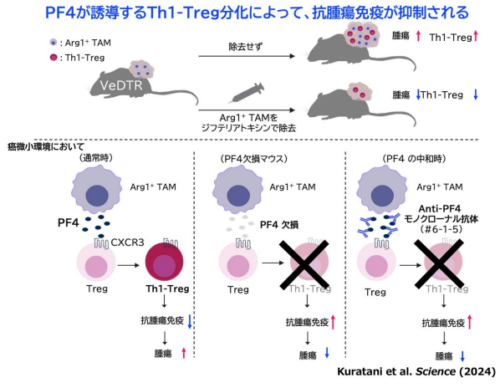
- Arg1産生腫瘍随伴マクロファージ(Arg1+TAM)が産生するケモカインPF4ががん免疫を抑制するTh1-Tregの分化を誘導し、腫瘍の増殖につながっていることが判明
- PF4を中和することで、Th1-Tregの分化が阻害され、がん免疫を活性化し、かつ自己免疫を起こさずに、腫瘍の増殖を抑制できることを発見
- PF4を標的とする安全性の高い抗腫瘍免疫治療につながる可能性
大阪大学 大学院生命機能研究科 大学院生の倉谷 歩見 さん、微生物病研究所の山本 雅裕 教授(免疫学フロンティア研究センター、感染症総合教育研究拠点 兼任)らの研究グループは、腫瘍内のアルギナーゼ1(Arg1)を産生するマクロファージ(Arg1+TAM)が産生するケモカインPF4がTh1-Tregを誘導し、がん免疫を抑制することを明らかにしました。
これまで腫瘍内において強力にがん免疫を抑制するTregのサブセットの1つであるTh1-Tregが腫瘍内に高度に蓄積することが分かっていましたが、なぜそのようになるのか、その分子メカニズムは全く不明でした。今回、山本 教授らのグループはArg1+TAMを特異的に標識・除去可能な遺伝子改変マウスをVeDTRマウスシステムにより作製し、腫瘍随伴マクロファージの役割を検討しました。胆がんマウスでArg1+TAMを除去したところ、腫瘍内Th1-Tregの割合の減少とがん免疫の強い活性化が確認されました。さらに、Arg1+TAMが産生する液性因子PF4(別名CXCL4)がTregのTh1-Tregへの分化に関与することを明らかにしました。PF4欠損マウスや抗PF4中和抗体の投与によるPF4の機能の阻害によって、がん組織内Th1-Tregの割合の減少にともなうがん免疫の強い活性化が確認され、その結果、腫瘍増殖の抑制が確認されました。さらにPF4中和抗体の投与は、全Treg除去で起きる自己免疫になりませんでした。以上のことから、PF4が安全性の高い抗腫瘍免疫治療の新規標的となる可能性が大いに期待されます。
本研究成果は米国科学誌「Science」で、日本時間11月22日(金)にオンライン公開されます。
本研究は、JST 創発的研究支援事業(FOREST)「次世代型免疫細胞サブセット解析手法の開発とその実装」(グラント番号:JPMJFR206D)の一環として行われました。
<プレスリリース資料>
- 本文 PDF(1.09MB)
<論文タイトル>
- “Platelet factor 4-induced Th1-Treg polarization suppresses anti-tumor immunity”
- DOI:10.1126/science.adn8608
<お問い合わせ先>
<研究に関すること>
山本 雅裕(ヤマモト マサヒロ)
大阪大学 微生物病研究所 教授
<JST事業に関すること>
加藤 豪(カトウ ゴウ)
科学技術振興機構 創発的研究推進部
<報道担当>
大阪大学 微生物病研究所 企画広報推進室
科学技術振興機構 広報課

