2025-01-10 国立精神・神経医療研究センター
国立研究開発法人 国立精神・神経医療研究センター(東京都小平市、理事長:中込和幸、以下、NCNP)は、日本新薬株式会社(本社:京都市、社長:中井亨、以下、日本新薬)と共同研究を進めてきたアンチセンス核酸医薬品であるデュシェンヌ型筋ジストロフィー(以下、DMD)治療薬(ブロギジルセン:NS-089/NCNP-02)を用いた医師主導治験(First In Human試験)の成果が、日本時間2025年1月10日(金)午前1時に、Cell Reports Medicine誌に掲載されました。
ブロギジルセンは、NCNPと日本新薬が共同で開発した世界初のエクソン44スキップ薬です。モルフォリノ核酸が本来有する高い安全性に加えて、特許出願技術である新規高活性配列探索法を用いて開発したデュアルターゲティング(配列連結型)モルフォリノ核酸製剤であり、高いエクソン・スキップ活性を有しています。これまでに得られた非臨床試験の結果からは、エクソン44スキップに応答する変異形式の DMD患者細胞における高い有効性が確認されていました。
本治験(UMIN: 000038505、ClinicalTrials.gov: NCT04129294として登録)は、NCNP病院と鹿児島大学病院で6例のDMD患者さんに対して行われ、主要評価項目である安全性の他、ブロギジルセン投与後の薬物動態、ジストロフィンタンパク質の発現確認、運動機能評価等の有効性について検討を行いました。ブロギジルセンの全身投与により、平均20.55%のジストロフィンタンパク質の発現が認められました(図1)。また、ノース・スター歩行能力評価スコアを含め、運動機能の維持又は改善傾向が示唆されました。これらの結果から本剤は、DMDに対する治療効果が期待されます。本治験を通じて、有害事象の発生による投与中止例はありませんでした。

本治験では、すべての患者さんより尿の中に含まれる幹細胞(以下、尿中細胞)を採取しました。筆頭著者の一人である邦武克彦研究員、責任著者の青木吉嗣部長らは、この尿中細胞をダイレクト・リプログラミング法で骨格筋細胞へ変換し、身体に負担をかけることなく、かつ効率的にエクソン・スキップ治療の効果を実験皿の上で検証する方法を既に確立していました。そこで、本治験でも、この方法を用いて、ブロギジルセンの効果を検証したところ、実際の全身投与で有効だった患者さんでは、その尿中細胞由来の骨格筋細胞においても、同様に有効でジストロフィンの発現上昇がみられました(図2)。これまでの治験では、苦痛を伴う筋生検によって得られる骨格筋がエクソン・スキップ治療の有効性評価のためには必須でした。しかし、将来のDMD関連の治験においても継続的に尿中細胞を用いた評価が有用であることが示せれば、苦痛のない尿中細胞を主要評価項目とする治験実施も期待されます。

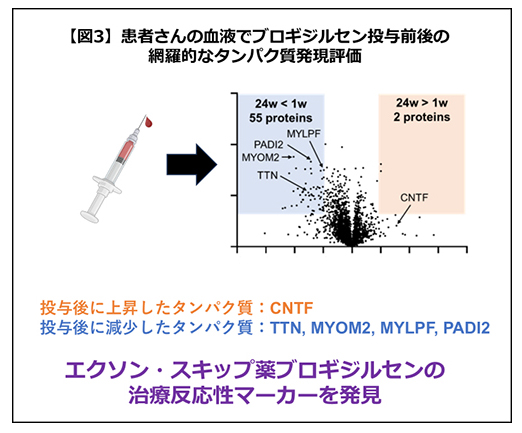
また、DMDに対するエクソン・スキップ治療では、日常診療で使いやすい治療効果判定の血中マーカーは確立されていないのが現状です。そこで、本治験ではブロギジルセンの投与前後の血漿を用いて、タンパク質の網羅的な発現解析を行いました(図3)。その結果、以前よりDMDで高値であることが知られていたタイチン(TTN)、ミオメシン2(MYOM2)、ミオシン軽鎖PF(MYLPF)が、いずれもジストロフィンの回復に伴い、低下することが分かりました。さらに、これまでDMDではほとんど注目されてこなかったタンパク質である繊毛神経栄養因子(CNTF)の上昇、プロテインアルギニンデイミナーゼ2型(PADI2)の低下もみられました。これらのタンパク質は、日常診療の治療反応性マーカーとなり得るばかりか、今後のDMD関連治療薬の治験における測定項目となることが期待されます。
本医師主導治験の結果も踏まえ、日本新薬は、臨床試験を引き継ぎ、上市に向けて本医師主導治験継続投与試験とグローバル第Ⅱ相試験を実施中です。
本治験にご協力を頂きました患者さまとそのご家族に、この場を借りて深く御礼を申し上げます。
開発背景
DMDは、ジストロフィン遺伝子の変異が原因で、筋の細胞膜からジストロフィンタンパク質が失われ、徐々に筋力低下が進む難病で、男児に発症します。「エクソン・スキップ治療」は、アンチセンス核酸と呼ばれる短いDNAの様な合成核酸を用いて、メッセンジャーRNA前駆体から成熟メッセンジャーRNAが作られる過程で、タンパク質に翻訳されるエクソン領域の一部を人為的に取り除く(スキップする)ことで、アミノ酸読み取り枠のずれを修正する治療法です(イン・フレーム化といいます)。この結果、正常なジストロフィンに比べると、タンパク質の一部が短縮するものの、機能を保ったジストロフィンが発現して筋機能の改善が期待できます。この治療でスキップの対象となるエクソンは患者の変異形式に応じて異なり、現在までに、本邦では、NCNPと日本新薬が共同で見出したビルトラルセンを有効成分としたエクソン53スキップ薬であるビルテプソ®点滴静注250mgが製造販売承認を取得しておりますが、エクソン53スキップ薬が適応にならない患者に対して、別のエクソンを標的とした薬剤の開発が喫緊の課題となっています。
責任著者の青木吉嗣部長のコメント:「画期的に高いジストロフィンタンパク質の回復が得られました。また、尿中細胞を利用した新たな評価方法は、患者さんの負担を軽減できる可能性を示しています。さらに、今回新たに見出した血液中の治療マーカーは、治療効果をより的確に追跡する有用な手段となる可能性があり、近い未来の治療に大きな期待を抱かせるものです」
筆頭著者の一人で治験責任医師の小牧宏文TMCセンター長のコメント:「世界で初めてヒトを対象に平均20.55%以上のジストロフィンタンパク質の発現回復に成功したこと、ならびに運動機能への有効性が十分に期待できる結果が得られたことは画期的です」。
助成金
ブロギジルセンの開発は、以下の助成を受けています。
・日本医療研究開発機構(AMED)研究費
2015~2017年度 難治性疾患実用化研究事業「新規配列連結型核酸医薬品を用いたデュシェンヌ型筋ジストロフィーに対するエクソン・スキップ治療の実用化に関する研究」
2016~2020年度 臨床研究・治験推進研究事業「疾患登録システムの効果的活用に基づく筋ジストロフィーの医師主導治験、ならびに医薬品開発に資する臨床研究の実施」
2018年度 橋渡し研究戦略的推進プログラム「デュシェンヌ型筋ジストロフィーに対する新規配列連結型核酸医薬品の医師主導治験」
2019~2021年度 橋渡し研究戦略的推進プログラム「デュシェンヌ型筋ジストロフィーに対する新規配列連結型核酸医薬品の医師主導治験」
用語説明
<デュシェンヌ型筋ジストロフィー(DMD)>
DMDは、男児に発症する、もっとも頻度の高い遺伝性筋疾患で、ジストロフィンと呼ばれる筋肉の細胞の骨組みを作るタンパク質(ジストロフィンタンパク質)の遺伝子に変異が起こることで、正常なタンパク質が作れなくなり、筋力が低下してやがて死に至る重篤な疾患です。現在、その進行を遅らせる目的でステロイド剤による治療が行なわれていますが、それ以外に有力な治療法は存在せず、新たな治療法の開発が必要とされています。
<エクソン・スキップ治療>
アンチセンス核酸と呼ばれる短い合成核酸(DNAの様なもの)を用いて、遺伝子の転写産物(メッセンジャーRNA)のうち、タンパク質に翻訳される領域(エクソン)の一部を人為的に取り除く(スキップする)ことで、アミノ酸読み取り枠のずれを修正(これをイン・フレーム化といいます)する治療法です。正常なジストロフィンタンパク質に比べると、その一部が短縮するものの、機能を保ったジストロフィンタンパク質が発現し、筋機能の改善が期待できます。この治療の対象となるエクソンは、患者の変異形式に応じて異なり、ブロギジルセン(NS-089/NCNP-02)はエクソン44を対象としています。
エクソン・スキップ治療の概念図

最上段:健常者では、ジストロフィンのメッセンジャーRNA(mRNA)前駆体から、スプライシングを経て成熟mRNAが作られ、ジストロフィンタンパク質が翻訳されます。
中段:エクソン45を欠失した DMDでは、エクソン44とエクソン46が連結したmRNAができますが、アミノ酸の読み枠にずれが生じ、ジストロフィンは発現しません(アウト・オブ・フレーム変異)。
下段:エクソン45を欠失した DMDを対象に、ブロギジルセンを用いてエクソン44スキップを誘導し、エクソン43とエクソン46が直接連結出来る様にすると、アミノ酸の読み枠のずれは解消し、やや短いが正常に機能するジストロフィンが発現します(イン・フレーム化)。
<デュアルターゲティング(配列連結型)モルフォリノ核酸製剤>
本剤は、特許出願技術である新規高活性配列探索法を用いて開発した、2ヶ所の離れた塩基配列を標的とするアンチセンス核酸です。従来の1ヶ所の連続した塩基配列を標的とするアンチセンス核酸とは異なります。
デュアルターゲティング核酸の概念図

<ダイレクト・リプログラミング法>
分化した体細胞に、特定の制御因子(遺伝子やメッセンジャーRNAなど)を作用させることで、細胞の性質を変換し、別の種類の細胞に分化させることを指します。筋制御因子であるMYOD1は、ダイレクト・リプログラミングを誘導する代表的な因子です。遺伝子疾患治療研究部では、MYOD1を尿中細胞に導入することによる高効率な骨格筋細胞作出法を2019年に報告しています。
<タイチン(TTN)>
生体内に存在する最も大きなタンパク質で、骨格筋中の各筋線維をつなぐ役割を有し、筋収縮に関与します。血中あるいは尿中のタイチン上昇がDMD患者でみられることが知られています。
<ミオメシン2(MYOM2)>
成人の骨格筋あるいは心筋に存在するタンパク質で、骨格筋が収縮する仕組みの最小単位となる構造(サルコメアと呼びます)の配列を安定化する機能を持ちます。血中のミオメシン上昇がDMD患者でみられることが知られています。
<ミオシン軽鎖PF(MYLPF)>
新生児及び成体の骨格筋に特異的に発現しているタンパク質で、骨格筋の発達に重要な役割を果たしています。血中のミオシン軽鎖上昇がDMD患者でみられることが知られています。
<繊毛神経栄養因子(CNTF)>
インターロイキン6ファミリーに属する免疫細胞から分泌されるタンパク質(サイトカインと呼びます)の1つです。全身の神経節細胞や中枢神経、眼の網膜に分布しています。神経保護あるいは再生の作用を有しますが、これまでDMDとの関連は報告されていませんでした。
<プロテインアルギニンデイミナーゼ2型(PADI2)>
中枢神経あるいは骨格筋に存在するタンパク質で、アミノ酸の一つアルギニンをシトルリンに変換する酵素です。DMD患者のアストロサイトで上昇することは過去に報告されていました。
原論文情報
論文名: “Phase I/II Trial of Brogidirsen: Dual-Targeting Antisense Oligonucleotides for Exon 44 Skipping in Duchenne Muscular Dystrophy”
著 者: 小牧宏文、竹下絵里、邦武克彦、石塚量見、本橋裕子、石山昭彦、佐々木征行、米衛ちひろ、丸山 慎介、飛田 英祐、青木吉嗣
掲載誌: Cell Reports Medicine
DOI:10.1016/j.xcrm.2024.101901
URL:https://www.cell.com/cell-reports-medicine/fulltext/S2666-3791(24)00672-4
お問い合わせ
≪研究に関すること≫
国立研究開発法人 国立精神・神経医療研究センター
神経研究所 遺伝子疾患治療研究部 部長
青木 吉嗣(あおき よしつぐ)
≪治験に関すること≫
国立研究開発法人 国立精神・神経医療研究センター
トランスレーショナル・メディカルセンター長
小牧 宏文(こまき ひろふみ)
≪報道に関すること≫
国立研究開発法人 国立精神・神経医療研究センター 総務課広報係