2025-01-10 理化学研究所
理化学研究所(理研)環境資源科学研究センター ケミカルゲノミクス研究グループのティルマン・シュナイダー・ポーチュ 専任研究員、吉田 稔 グループディレクター、開拓研究本部 岩崎RNAシステム生化学研究室の岩崎 信太郎 主任研究員、七野 悠一 研究員らの国際共同研究グループは、南太平洋ニューカレドニアの海綿から単離された低分子化合物「ジロリン(Giro)」が、メッセンジャーRNA(mRNA)からタンパク質への翻訳における伸長過程を特定の配列で阻害するタンパク質合成モジュレーター(配列特異的翻訳制御剤)として作用することを発見しました。翻訳の伸長過程での配列特異的阻害はほとんど例がなく、今回の発見は、明確に証明されたほぼ最初の例です。
本研究成果は、がん、老化、神経変性などの研究ツールとなる新たな化合物の開発に貢献すると期待されます。
リボソーム[1]によるタンパク質の合成は、機能的なタンパク質を正確に産生するために高度に制御されています。リボソームはDNAから転写されたmRNAの上を滑りながら、その塩基配列をタンパク質のアミノ酸[2]配列に翻訳します。翻訳因子eIF5A[3]は、リボソームが減速するとリボソームに結合し、翻訳の停滞を防ぎ、タンパク質の産生速度を維持する機能を持ちます。
今回、国際共同研究グループは、(1)Giroが、eIF5Aをリボソームから解離させ、減速した翻訳を回復させることなく停止させること、(2)失速したリボソームが、リボソーム関連品質管理機構(RQC)[4]によって検出され、このリボソームもmRNAから解離して、合成されつつあった不完全なタンパク質が蓄積されることを突き止めました。
本研究は、科学雑誌『Nature Communications』オンライン版(1月10日付:日本時間1月10日)に掲載されました。
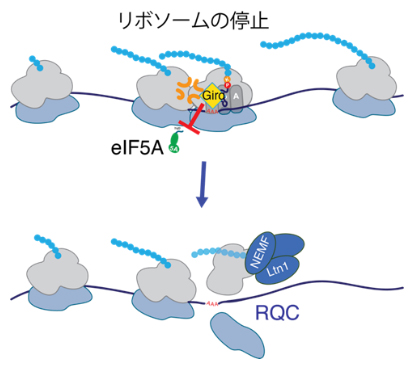
eIF5Aと競合してタンパク質合成を停滞させる海綿由来のジロリン
背景
地球上の生命体においてタンパク質の合成は不可欠です。リボソームと呼ばれる大きなタンパク質・RNA複合体が、メッセンジャーRNA(mRNA)の塩基配列をタンパク質のアミノ酸配列に翻訳します。アミノ酸はトランスファーRNA(tRNA)と呼ばれる別のRNAによってリボソームに運ばれます。タンパク質の生合成は、多くの因子によって厳密に制御されたプロセスであり、機能的なタンパク質が正確に産生されます。タンパク質を合成する際、リボソームはmRNA上を連続的に移動するため、タンパク質合成を理解するには、その動きを止めて観察する必要があります。そのため、特定のリボソーム成分に結合してその動きを止める特異的な低分子阻害剤はリボソームの機能解析に不可欠でした。またこれらの低分子阻害剤の多くは、抗生物質として病気との闘いにも役立っています。
翻訳におけるeIF5Aの機能は未解明な課題の一つです。eIF5Aは、当初、タンパク質合成の開始のための開始コドン(連続した塩基3個ずつの配列)を認識して複合体を形成するのに必要な因子だと考えられていました。しかし、実は「翻訳開始」ではなく翻訳開始後のリボソームによるタンパク質合成プロセスである「翻訳伸長」に関わっていることが分かっています。産生中のタンパク質がプロリンというアミノ酸を含んでいたり、荷電したアミノ酸を含んでいたりする場合、リボソームの減速が起こることがあります。このようなときにeIF5Aはリボソームに結合し、タンパク質の産生速度を高めると考えられています。eIF5Aがないと、リボソームがmRNA上で停滞し、後続のリボソームが衝突して、機能的なタンパク質合成が妨げられます。そのため、eIF5Aは生育に必須の因子であり、その機能欠損は、老化だけでなく、がんや神経変性など多くの疾患に関与しています注1)。こうした健康や疾患への関与から、eIF5Aは多くの研究分野で注目されていますが、生存に必須の因子であるため生体における変異解析が困難であること、特異的な化学プローブ(化学的に調べる探針)が報告されていないことなどから、その機能の詳細については不明な点が多く残されています。
注1)Tauc, M., Cougnon, M., Carcy, R. et al. The eukaryotic initiation factor 5A (eIF5A1), the molecule, mechanisms and recent insights into the pathophysiological roles. Cell Biosci 11, 219 (2021).
研究手法と成果
海綿から単離されたジロリン(Girolline:Giro)は、弱いタンパク質合成阻害剤であることが知られていました。国際共同研究グループは、リボソームが衝突したmRNA上の位置を特定する最近の技術であるダイソーム・プロファイリングを用いて、Giroの再評価を行いました(図1)。ダイソーム・プロファイリングは、隣接する二つのリボソームによって覆われたmRNA断片を分離し、塩基配列を決定することで位置の特定を行います。
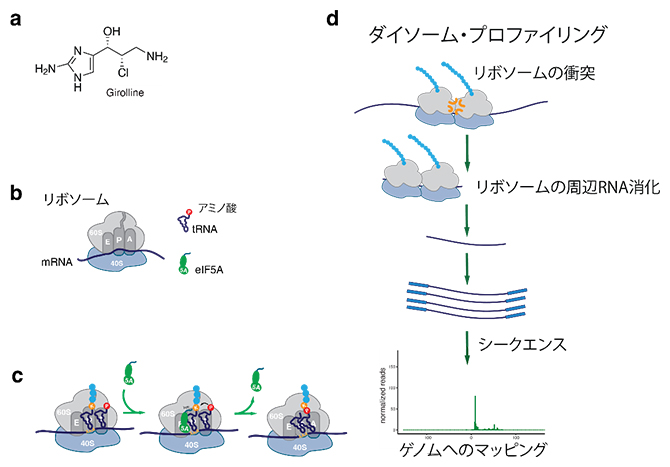
図1 海綿から単離された低分子化合物Giroの作用機構解析手順
(a)Giro(Girolline)の分子構造。
(b)eIF5A、tRNAに結合したアミノ酸およびmRNA上のリボソームの模式図。
(c)eIF5Aは、大サブユニットと小サブユニットで構成されるリボソームの大サブユニットに結合し、アミノ酸の付加速度を高めることでタンパク質合成を助ける。
(d)ダイソーム・プロファイリング。衝突した二つのリボソームによる消化から保護されたmRNA断片が単離され、塩基配列が決定され、ゲノム上にマッピングされる。
この手法により、リボソームの失速が起こる配列を特定することができ、国際共同研究グループはGiroがアミノ酸プロリンまたは正電荷を持つアミノ酸リジンをコードする遺伝暗号の「AAA」(A:アデニン)コドンを含む配列でリボソームを失速させることに気づきました。その原因として、GiroがeIF5Aをリボソームから解離させ、eIF5Aが働けなくなっていることを示唆することができました。
このことは、Giroが一般的な翻訳阻害剤ではなく、リボソームから翻訳因子を解離させ、eIF5Aを必要とする配列に選択的に作用するというユニークな作用機序を持つことを示しています。すなわち、この研究によって初めてGiroはeIF5Aの直接的なモジュレーターであると確認されました。
さらに、Giroによって停止したリボソームは、RQCを通して分解され、それによって不完全な新生ペプチド[5]が蓄積されることが示されました(図2)。RQCは、細胞にとって有害となる可能性のある不完全なタンパク質の産生を防ぐ役割を果たしています。今回の発見は、eIF5Aが欠乏してリボソームが停滞すると、RQCが早期に活性化し、機能的なリボソームでも分解されてしまうことを示唆しています。
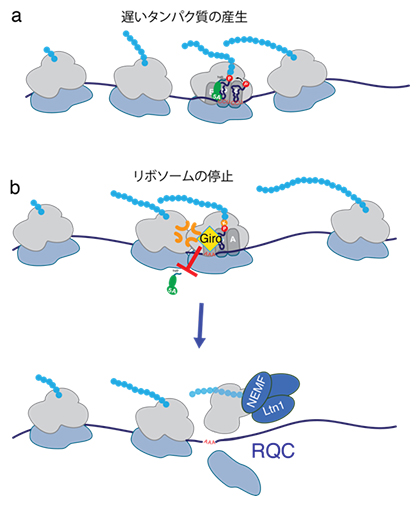
図2 elF5Aと競合してRQCを誘導するGiroの作用機構
(a)eIF5A(黄緑)は、リボソームが遅くなったときにタンパク質合成を速めるために必要である。
(b)Giro(黄色)はeIF5Aがリボソームと結合するのを妨げ、リボソームの停滞を引き起こす。失速したリボソームはRQCによって処理される。NEMF、Ltn1はRQCに不可欠な酵素。
今後の期待
今回の発見は、eIF5Aがタンパク質の合成速度を維持し、RQCの偶発的な活性化を防ぐ重要な機能を持つことを初めて示すものとなりました。eIF5Aはがん、老化、神経変性に関与していますが、遺伝学的手法で操作することが難しく、eIF5Aの働きを阻害することができるGiroは、がん、老化、神経変性におけるeIF5Aの機能を解明するための強力で有用なツールになるはずです。また、Giroは必須アミノ酸のリジンをコードする「AAA」コドンを標的としますが、「AAA」コドンの使用頻度がマラリア原虫で非常に高いことを考えると、Giroは抗マラリア薬の候補化合物として再評価されることも期待されます。
本研究成果は、国連の「持続可能な開発目標(SDGs)[6]」の17の目標のうち、「3.すべての人に健康と福祉を」に貢献するものです。
補足説明
1.リボソーム
大サブユニットと小サブユニットから成る大型の酵素で、mRNAを鋳型としたタンパク質の生合成を触媒する。
2.アミノ酸
カルボン酸とアミノ基を持つ有機分子。細胞は20種類のアミノ酸を組み合わせて使い、直鎖状のアミノ酸鎖を形成してタンパク質を作る。アミノ酸が付加される順序は、メッセンジャーRNA(mRNA)の配列によって決まる。
3.eIF5A
真核生物開始因子5Aのこと。翻訳開始因子と命名されたが、実際には翻訳開始には必要ない。リボソームの大サブユニットと結合し、タンパク質合成の速度を上げる機能を持つタンパク質。
4.リボソーム関連品質管理機構(RQC)
停止したリボソームを検出し、リボソームのサブユニットを分離して新生ペプチド([5]参照)を分解するシステム。RQCはribosome-associated quality controlの略。
5.新生ペプチド
リボソーム内で新たに合成されたペプチドのこと。ペプチドはアミノ酸がつながったもの。長いペプチドがタンパク質と呼ばれる。
6.持続可能な開発目標(SDGs)
持続可能な開発目標(SDGs)とは、2015年9月の国連サミットで採択された「持続可能な開発のための2030アジェンダ」にて記載された2016年から2030年までの国際目標である。持続可能な世界を実現するための17のゴールから構成され、地球上の誰ひとりとして取り残さないことを誓っている。SDGsは発展途上国のみならず、先進国自身が取り組むユニバーサル(普遍的)なものであり、日本としても積極的に取り組んでいる。(外務省のホームページから一部改変して転載)
国際共同研究グループ
理化学研究所
環境資源科学研究センター
ケミカルゲノミクス研究グループ
グループディレクター 吉田 稔(ヨシダ・ミノル)
専任研究員 ティルマン・シュナイダー・ポーチュ(Tilman Schneider-Poetsch)
創薬シード化合物探索基盤ユニット
テクニカルスタッフⅠ 新 真由美(アラタ・マユミ)
生命機能科学研究センター
翻訳構造解析研究チーム
チームリーダー 伊藤 拓宏(イトウ・タクヒロ)
専任研究員 岩崎 わかな(イワサキ・ワカナ)
開拓研究本部
岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(イワサキ・シンタロウ)
研究員 七野 悠一(シチノ・ユウイチ)
重慶医科大学(中国)
教授 ヨンジュン・ダング(Yongjun Dang)
フランス国立科学研究センター
教授 アリ・アル・ムラビット(Ali Al Mourabit)
テクニカルスタッフ セリネ・モリユー(Celine Moriou)
ベイラー大学(米国)
教授 ダニエル・ロモ(Daniel Romo)
ジョンズ・ホプキンズ大学(米国)
教授 ジュン・リユー(Jun O. Liu)
研究支援
本研究は、理化学研究所奨励課題「The role of eIF5A in Energy Metabolism(代表者:Tilman Schneider-Poetsch)」で実施し、日本学術振興会(JSPS)科学研究費助成事業基盤研究(S)「革新的化学遺伝学による内在性代謝物の新機能の解明と応用(研究代表者:吉田稔、JP19H05640)」「化学遺伝学と情報科学による内在性代謝物の隠された機能の解明(研究代表者:吉田稔、JP23H05473)」、同新学術領域研究(研究領域提案型)「ユビキチン機能制御のためのケミカルバイオロジー(研究代表者:吉田稔、18H05503)」、同学術変革領域研究(A)「化学遺伝学評価系に基づく化合物潜在空間の生物活性検証と作用機序解明(研究代表者:吉田稔、JP23H04882)」による助成を受けて行われました。
原論文情報
Tilman Schneider-Poetsch, Yongjun Dang, Wakana Iwasaki, Mayumi Arata, Yuichi Shichino, Ali Al Mourabit, Celine Moriou, Daniel Romo, Jun O. Liu, Takuhiro Ito, Shintaro Iwasaki and Minoru Yoshida, “Girolline is a sequence context-selective modulator of eIF5A activity”, Nature Communications, 10.1038/s41467-024-54838-2
発表者
理化学研究所
環境資源科学研究センター ケミカルゲノミクス研究グループ
グループディレクター 吉田 稔(ヨシダ・ミノル)
専任研究員 ティルマン・シュナイダー・ポーチュ(Tilman Schneider-Poetsch)
開拓研究本部 岩崎RNAシステム生化学研究室
主任研究員 岩崎 信太郎(イワサキ・シンタロウ)
研究員 七野 悠一(シチノ・ユウイチ)
報道担当
理化学研究所 広報室 報道担当