2018-11-30 科学技術振興機構,自然科学研究機構 基礎生物学研究所
ポイント
- 体液中のナトリウム濃度の上昇による交感神経系の活性化を通して血圧を上昇させることは知られていたが、その詳細な仕組みは明らかになっていなかった。
- 食塩を過剰摂取すると脳内のナトリウム濃度センサーであるNaxがナトリウム濃度の上昇を感知することで、そのシグナルを交感神経制御中枢に送る神経の仕組みを明らかにした。
- 本成果は、食塩の過剰摂取に伴う高血圧発症の脳内の仕組みの詳細を初めて明らかにしたものであり、新たな治療薬の開発に役立つと期待される。
JST 戦略的創造研究推進事業において、自然科学研究機構 基礎生物学研究所の野田 昌晴 教授(総合研究大学院大学 教授、東京工業大学 教授(併任))らの研究グループは、食塩(塩化ナトリウム)の過剰摂取により体液中のナトリウム(Na+)濃度が上昇すると、脳内のNa+濃度センサーであるNax注1)がこれを感知し、その結果、交感神経注2)を活性化して血圧上昇が起こることを初めて明らかにしました。
高血圧は、日本の成人のうち約4300万人が罹患していると試算される重大な国民病です。食塩の過剰摂取が高血圧の原因となることは良く知られており、その仕組みとして、体液中のNa+濃度が上昇することによって交感神経系が活性化し、その結果として血圧が上がる、という説が有力となっています。しかし、脳がどのようにしてNa+濃度を感知し、その情報をどのような仕組みで交感神経まで伝えられているのかは不明でした。
本研究グループでは、これまでに細胞外液のNa+濃度上昇に応じて開口するNaチャンネルであるNaxを見いだし、その機能や生理的役割を明らかにしてきました。今回Nax遺伝子を欠損したマウスは、野生型マウスと異なり、体液中のNa+濃度が上昇しても交感神経の活性化による血圧上昇を起こさないことを発見しました。さらに、神経活動の活性化や抑制を光によってコントロールする技術などを用いて、Naxが感知したNa+濃度上昇のシグナルが交感神経の活性化につながる仕組みを分子レベル、および神経回路ネットワークレベルで解明しました。
本成果は、Na+濃度と血圧上昇をつなぐ脳内の仕組みを詳細に明らかにしたものであり、高血圧に対する新しい治療法の開発に役立つものと期待されます。
本研究成果は、2018年11月29日(米国東部時間)に米国科学雑誌「Neuron」オンライン版で公開されます。
本成果は、以下の事業・研究領域・研究課題によって得られました。
戦略的創造研究推進事業 チーム型研究(CREST)
研究領域:「光の特性を活用した生命機能の時空間制御技術の開発と応用」
(研究総括:影山 龍一郎 京都大学ウイルス・再生医科学研究所 教授)
研究課題名:「オプトバイオロジーの開発による体液恒常性と血圧調節を司る脳内機構の解明」
研究代表者:野田 昌晴(自然科学研究機構 基礎生物学研究所 教授)
研究期間:2017年10月~2023年3月
<研究の背景>
高血圧は、日本の成人のうち約4300万人が罹患していると試算される重大な国民病であり、高血圧に起因する死亡者数は年間約10万人に上ると推定されています。高血圧は、心血管病(心疾患および脳卒中)の最大の危険因子であり、脳卒中罹患の50%以上、心血管病死亡の約50%が高血圧によるものと推定されています。
高血圧の主要な原因として食塩の過剰摂取があることは良く知られています。食塩の過剰摂取による血圧上昇の程度には個人差がありますが、日本人は血圧上昇が起こりやすいといわれています。その第一の原因は腎臓による尿中へのNa+の排泄が追い付かず体内で貯留され、体液中のNa+濃度が上昇することにあります。これまでNa+による血圧上昇の仕組みは、血液浸透圧の上昇によって血管中に水分が流入することで、血液量が増大するためとされてきました。これに対し10年あまり前から、体内の血管に張り付いた交感神経の活性化により、血管が収縮することで高血圧を発症しているという説が有力になってきました。しかし、体液中のNa+濃度の上昇がどこでどのように検知されているのか、そして、そのシグナルがどのように脳内の交感神経制御中枢に伝えられ、その活性化を引き起こしているのか、分子の仕組みや神経回路は未解明のままでした。
<研究の内容>
本研究グループでは、これまでに細胞外液のNa+濃度上昇に応じて開口するNaチャンネルであるNaxを見いだし、その機能や生理的役割を明らかにする研究を行ってきました(参考文献)。今回の研究では、Naxが血圧の制御に関与するNa+濃度センサーとして働いているのではないかという点について検討しました。
まず、野生型マウスに大量の食塩を与える実験を行い、体液中のNa+濃度が上昇(~10ミリモーラー(mM))すること、そして、それに伴って血圧が上昇することを確認しました。一方、Nax遺伝子欠損マウスでは体液中のNa+濃度が同程度上昇しているにもかかわらず、血圧の上昇は全く起こりませんでした(図1)。次に、高濃度のNa+を含む水溶液(高張Na+溶液)をマウスの脳室内に注入し、脳脊髄液注3)のNa+濃度を上昇させる実験を行いました(図2)。野生型マウスでは、交感神経の活性化と血圧上昇が起こったのに対し、Nax遺伝子欠損マウスでは交感神経の活性化や血圧上昇は起こりませんでした。
このことから、Naxが体液中のNa+濃度の上昇を感知し、交感神経の活性化を通じて血圧を上昇させている脳内センサーであることが強く示唆されました。また、Naxが発現している脳内器官のうち終板脈管器官(OVLT)注4)を損傷させたマウスでは、高張Na+溶液の脳室内への注入による交感神経性の血圧上昇が起こらなかったため、血圧制御のためにNa+濃度を感知する領域はOVLTであると考えられました。
脳は脊髄を介して交感神経にシグナルを伝達しているため、OVLTからのシグナルを脊髄へと仲介している脳領域があると考えられます。そこで本研究グループは、視床下部室傍核(PVN)注5)に注目しました。PVNにシグナルを伝えるOVLTニューロン(以下、OVLT(→PVN)ニューロン)を逆行性に標識して観察すると、このニューロンはOVLTの中でNaxを発現するグリア細胞注6)に囲まれた状態で存在していることが分かりました(図3A、B)。
そこで、OVLT(→PVN)ニューロンが活性化すると血圧が上昇するのかを光遺伝学注7)の手法を用いて調べました。まず、光感受性陽イオンチャンネルChR2を用いてOVLT(→PVN)ニューロンを選択的に活性化させました。その結果、血圧が上昇することが確認できました(図3C)。この血圧上昇は交感神経活動の阻害剤により消失したため、交感神経を介して起こっていることが分かりました。反対に、光感受性クロライド(Cl–)ポンプeNpHRを用いたOVLT(→PVN)ニューロンの抑制実験も行いました(図3D)。光照射によりOVLT(→PVN)ニューロンの活動を抑制すると、高張Na+溶液の脳室注入による交感神経性の血圧上昇が抑制されました(図3D)。これらの実験から、OVLT(→PVN)ニューロンが体液のNa+濃度上昇に応答した交感神経性の血圧上昇を担うニューロンであることが明らかとなりました。
Naxは、OVLT(→PVN)ニューロンそのものではなくグリア細胞に発現しているため、グリア細胞からニューロンへの情報伝達の仕組みが必要です。OVLT(→PVN)ニューロンは細胞外のNa+濃度を上昇させた時だけでなく(図4A)、細胞外を酸性状態にすることでも活性化したため(図4B)、この仕組みに酸(H+)が関わっている可能性が考えられました。調べてみると、細胞外Na+濃度が上昇したときOVLTでは細胞外に酸(H+)が放出されていることが分かりました(図4C)。このH+放出は、Nax発現グリア細胞における糖の取り込み、並びに嫌気的解糖(酸素を使わないグルコース代謝)の亢進によるものでした。嫌気的解糖系の産物である乳酸は、乳酸/H+共輸送体を介して細胞外に放出されるため、H+が同時に細胞外に放出されます。
さらに、細胞外の酸性化に応答して活性化する酸感受性イオンチャンネルASIC1注8)がOVLT(→PVN)ニューロンに発現していることを見いだしました(図4D)。阻害剤を用いて調べたところ、ASIC1a(ASIC1の中でも酸に感受性の高いタイプ)を阻害するとNa+濃度の上昇に応答したOVLT(→PVN)ニューロンの活性化や交感神経性の血圧上昇が消失しました(図4E)。反対に、ASIC1の活性化剤をOVLTに注入すると、血圧を上昇させることができました。この血圧上昇は、交感神経活動の阻害剤をあらかじめ投与しておいたマウスでは起こらなかったので、交感神経を介したものであることが分かりました。
これらの結果から、OVLTのグリア細胞に発現するNaxが活性化すると、H+の放出が促進され、放出されたH+がASIC1aを介してOVLT(→PVN)ニューロンを活性化することによって、交感神経性の血圧上昇が誘導されていることが明らかとなりました。加えて、OVLT(→PVN)ニューロンの活性化は、PVNを経て、さらに下流の交感神経中枢であるRVLMへとシグナルを伝えていることも分かりました。
<今後の展開>
脳内の仕組みを解明した今回の研究は、高血圧症の新たな治療法の開発に役立つと期待されます。また、高血圧全体の約90パーセントを占めるにもかかわらず、原因が特定されていない本態性高血圧注9)の発症の仕組みを理解するための重要な一歩ともいえます。
<付記>
本研究は、以下の支援を受けて実施しました。
- 科学研究費助成事業 基盤研究(S)「体液恒常性を司る脳内機構の研究」(研究代表者:野田 昌晴)
- 公益財団法人 金原一郎記念医学医療振興財団 基礎医学医療研究助成金 生体の科学賞(野田 昌晴)
- 科学研究費助成事業 若手研究(B)「脳内ナトリウムセンサーを介した血圧調節機構の解明」(研究代表者:野村 憲吾)
- 科学研究費助成事業 研究活動スタート支援「血圧を規定する脳内ナトリウムセンサーの分子実体解明」(研究代表者:野村 憲吾)
- 公益財団法人 日本科学協会 笹川科学研究助成(野村 憲吾)
- 日本医療開発機構 革新的先端研究開発支援事業 個人型研究(AMED-PRIME)の研究領域「メカノバイオロジー機構の解明による革新的医療機器及び医療技術の創出」(研究開発総括:曽我部 正博)における研究課題「脳内浸透圧/Na+レベルセンサーの動作機序と生理機能の解明」(研究代表者:檜山 武史)
- 公益財団法人 武田科学振興財団(檜山 武史)
- 公益財団法人 ソルト・サイエンス研究財団(檜山 武史)
<参考文献>
1)Hiyama, T.Y., Watanabe, E., Ono, K., Inenaga, K., Tamkun, M.M., Yoshida, S., and Noda, M. (2002). Nax channel involved in CNS sodium-level sensing. Nat Neurosci. 5, 511–512.
2)Hiyama, T.Y., Watanabe, E., Okado, H., and Noda, M. (2004). The subfornical organ is the primary locus of sodium-level sensing by Nax sodium channels for the control of salt-intake behavior. J Neurosci. 24, 9276–9281.
3)Matsuda, T., Hiyama, T.Y., Niimura, F., Matsusaka, T., Fukamizu, A., Kobayashi, K., Kobayashi, K., and Noda, M. (2017). Distinct neural mechanisms for the control of thirst and salt appetite in the subfornical organ. Nat Neurosci. 20, 230–241.
<参考図>
![]()
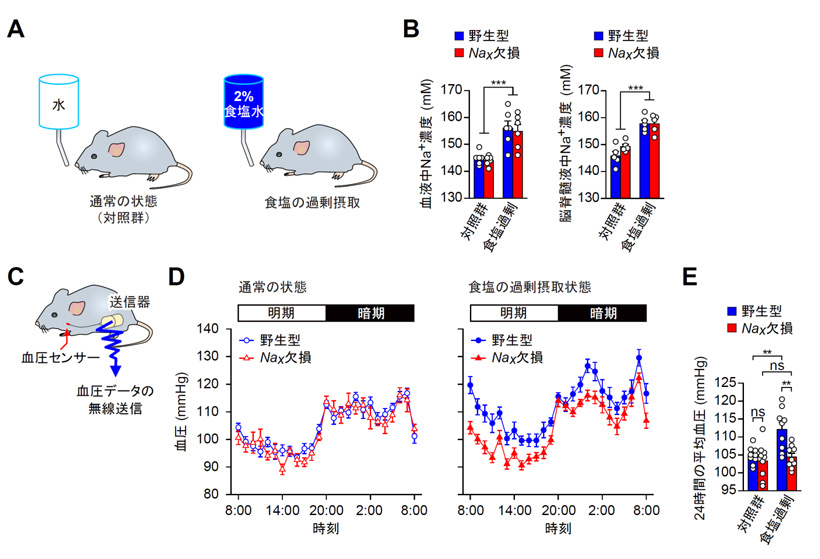
図1 Nax遺伝子欠損マウスは食塩を大量に摂取しても血圧が上昇しない
A:食塩を大量に摂取させる実験の概要図。飲み水を2%食塩水に交換して7日間飼育する。
B:血液中(左)と脳脊髄液中(右)のNa+濃度。通常、動物の体液中のNa+濃度は約145mMに保持されている。食塩の大量摂取により、野生型マウスとNax遺伝子欠損マウスの体液中のNa+濃度は同程度(約10mM)上昇を示した。
C:血圧測定の概要図。テレメトリーシステムにより、マウスが自由に行動できる状態で連続的に血圧の測定ができる。
D:通常の状態(左)と食塩の過剰摂取状態(右)のマウスにおける、1日(24時間)の血圧の推移。食塩を過剰摂取した野生型マウスは、1日を通じて同条件のNax遺伝子欠損マウスよりも高い血圧を示す。
E:24時間の平均血圧。食塩の大量摂取により、野生型マウスでは平均血圧が約8mmHg上昇したが、Nax遺伝子欠損マウスでは血圧上昇が起こらなかった。
![]()
図2 Nax遺伝子欠損マウスは脳脊髄液のNa+度が上昇しても、交感神経活動の亢進や血圧上昇が起こらない
A:高張Na+溶液を脳室内に注入する実験の概要図。交感神経の活動レベルは腰部にある交感神経線維の束に電極を接触させて測定した。
B:高張Na+溶液を脳室内に注入したときの交感神経活動の代表的データ(左)と変化の時間推移(右)。野生型マウスでは交感神経活動が約15%亢進したが、Nax遺伝子欠損マウスでは変化しなかった。
C:高張Na+溶液を脳室内に注入したときの血圧の変化。野生型マウスでは血圧が約8mmHg上昇したが、Nax遺伝子欠損マウスでは血圧上昇が起こらなかった。
![]()
図3 Naxによる血圧上昇は、OVLT(→PVN)ニューロンの活性化を介して起こっている
A:OVLT(→PVN)ニューロンを標識する方法の概要図。特殊な色素(逆行性色素)をPVNに注入すると、色素がニューロンに取り込まれ、溯ってOVLT(→PVN)ニューロンが標識される。
B:OVLTを蛍光顕微鏡で撮影した写真。Naxを赤、OVLT(→PVN)ニューロンを緑に染色している。OVLT(→PVN)ニューロンはNaxを発現する細胞に取り囲まれて存在している(矢頭)。
C:光刺激(青色)によりOVLT(→PVN)ニューロンを選択的に活性化させたときの血圧の変化。OVLTへの光照射により血圧上昇が起こった。
D:高張Na+溶液を脳室内に注入したときの血圧の変化。光刺激(黄色)によりOVLT(→PVN)ニューロンの活動を選択的に抑制しておくと、Na+濃度上昇に応答した血圧上昇は抑制された。
![]()
図4 Naxの活性化は、酸の放出とそれに伴うASIC1aの活性化を誘導し、 OVLT(→PVN)ニューロンの活動を亢進させることで血圧を上昇させる
A:OVLT(→PVN)ニューロンの電気活動。細胞外のNa+濃度を160mMへ上昇させると、野生型マウスのニューロンの電気活動は亢進したが、Nax遺伝子欠損マウスのニューロンの活動は変わらなかった。
B:細胞外を酸性化すると(pH7.4→pH6.8)、OVLT(→PVN)ニューロンの電気活動が亢進した。
C:OVLTを蛍光顕微鏡で撮影した写真。細胞外pHの変化に反応する色素の存在下で撮影した。細胞外のNa+濃度を160mMに上昇させると、野生型マウスのOVLTでは細胞外領域の酸性化が起こったが、Nax遺伝子欠損マウスのOVLTでは起こらなかった。
D:OVLTを蛍光顕微鏡で撮影した写真。ASIC1を赤、OVLT(→PVN)ニューロンを緑に染色している。OVLT(→PVN)ニューロンはASIC1を発現している(矢頭)。
E:高張Na+溶液を脳室内に注入したときの血圧の変化。OVLTにASIC1aの特異的阻害剤を注入しておくと、Na+濃度上昇に応答した血圧上昇は起こらなくなった。
![]()
図5 体液のNa+度上昇に応答した血圧上昇を担う脳内の仕組み
①体液のNa+濃度の上昇を、Naxチャンネルが感知し、Naxを発現するグリア細胞(アストロサイトと上衣細胞)内にNa+の流入が起こる。
②Nax発現グリア細胞において、エネルギー産生のため嫌気的解糖系が亢進し、その結果、乳酸が産生される。
③MCT(乳酸/H+共輸送体)を介して乳酸とH+がグリア細胞から放出される。
④細胞外の酸性化により、OVLT(→PVN)ニューロンに発現するASIC1aが活性化する。
⑤OVLT(→PVN)ニューロンが活性化し、シグナルがPVNへと伝達される。
⑥PVNからRVLMを経由して(あるいは直接)、脊髄にシグナルが伝達される。
⑦ 交感神経の活動が亢進する。
⑧ 血管が収縮し、血圧が上昇する。
<用語解説>
- 注1)Nax
- ナトリウムチャンネルの1つ。生理的な細胞外ナトリウム濃度付近のナトリウム濃度の上昇に応答して開口し、細胞内にナトリウムを流入させる機能を持つ。
- 注2)交感神経
- 中枢神経(脳・脊髄)ではなく、末梢組織に張り巡らされている末梢神経系の1つ。脊髄を経由して脳からのシグナルを受け取っている。交感神経が活性化すると、血管の収縮が起こることで血圧が上昇する。
- 注3)脳脊髄液
- 脳内や脊髄にある腔(脳室など)の中を満たす体液。
- 注4)終板脈管器官(OVLT)
- 交感神経や血圧の制御に関与する脳内器官の1つ。脳内で例外的に血液-脳関門(血液中の成分が脳内へ非特異的に侵入するのを防ぐためのバリア構造)を持たず、また、脳室に面した位置にあるため、血液と脳脊髄液の成分を感知するのに適した構造を持つ。
- 注5)視床下部室傍核(PVN)
- 交感神経や血圧の制御に関与する脳内器官の1つ。吻側延髄腹外側野(RVLM)を経由して、あるいは直接、脊髄にシグナルを伝えている。
- 注6)グリア細胞
- 神経系を構成する細胞のうち、神経細胞ではない細胞の総称。長い間、神経細胞の補助的細胞であると考えられてきたが、情報伝達においても重要な役割を持つことが分かってきている。
- 注7)光遺伝学
- 光によって活性化する特殊なたんぱく質を作る遺伝子を細胞に発現させることで、その細胞機能を光によって操作できるようにする技術。神経細胞を活性化させる実験では、青色光によって活性化する陽イオンチャンネルであるチャネルロドプシン(ChR2)などが使用される。神経細胞の活動を抑制する実験では、黄色光によって活性化するクロライド(Cl–)ポンプであるハロロドプシン(eNpHR)などが使用される。
- 注8)酸感受性イオンチャンネルASIC1
- 細胞外の酸性化(pHの低下)に応答して開口する性質を持つ陽イオンチャンネルであるASICファミリーに属するチャンネルの一種。ASIC1aはASICファミリーの中でも特に酸に対して高い感受性を持つ。
- 注9)本態性高血圧
- 高血圧のうち、明らかな原因(腎臓や副腎の疾患、薬剤など)があって発症している高血圧(二次性高血圧)以外のものを指す。高血圧全体の約90%を占めるとされている。明らかな原因が特定できず、遺伝的因子と環境因子(食習慣や飲酒、喫煙、ストレスなど)により複合的に発症していると考えられている。
<論文情報>
タイトル:“[Na+] increases in body fluids sensed by central Nax induce sympathetically-mediated blood pressure elevations via H+-dependent activation of ASIC1a”
著者名:Kengo Nomura, Takeshi Y. Hiyama, Hiraki Sakuta, Takashi Matsuda, Chia-Hao Lin, Kenta Kobayashi, Kazuto Kobayashi, Tomoyuki Kuwaki, Kunihiko Takahashi, Shigeyuki Matsui, and Masaharu Noda
DOI:10.1016/j.neuron.2018.11.017
<お問い合わせ先>
<研究に関すること>
野田 昌晴(ノダ マサハル)
自然科学研究機構 基礎生物学研究所 教授
<JST事業に関すること>
川口 哲(カワグチ テツ)
科学技術振興機構 戦略研究推進部 ライフイノベーショングループ
<報道担当>
科学技術振興機構 広報課
自然科学研究機構 基礎生物学研究所 広報室