2025-10-24 ノースウェスタン大学
<関連情報>
- https://news.northwestern.edu/stories/2025/10/molecular-snapshots-reveal-how-the-body-knows-its-too-hot
- https://www.nature.com/articles/s41594-025-01692-5
痛覚受容体TRPM3のアゴニストおよび熱活性化の構造的基盤 Structural basis for agonist and heat activation of nociceptor TRPM3
Sushant Kumar,Fei Jin,Sung Jin Park,Wooyoung Choi,Sarah I. Keuning,Richard P. Massimino,Simon Vu,Wei Lü & Juan Du
Nature Structural & Molecular Biology Published:24 October 2025
DOI:https://doi.org/10.1038/s41594-025-01692-5
Abstract
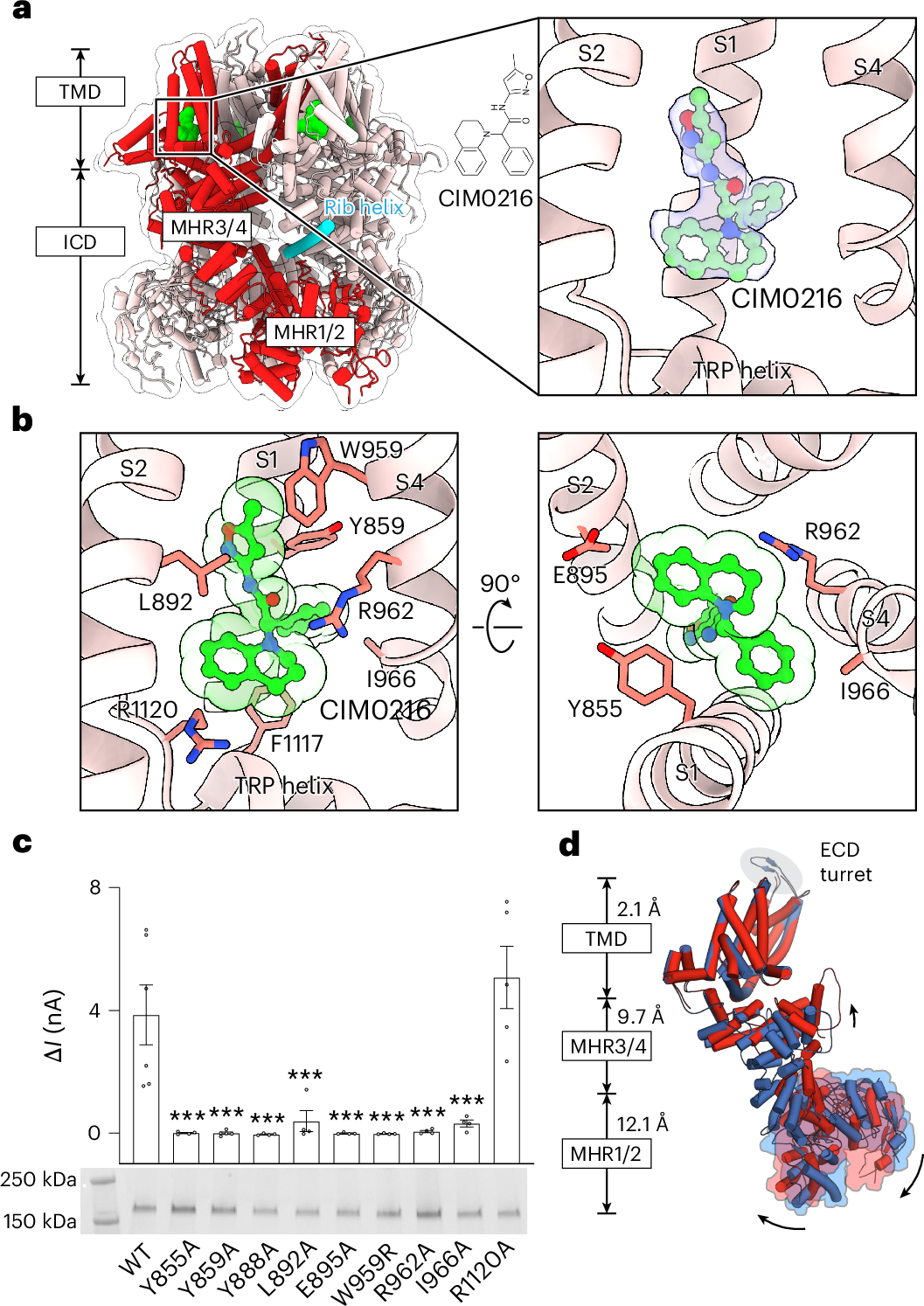
Detecting noxious heat is vital for survival, triggering protective pain responses. The TRPM3 channel is a key nociceptor and a promising therapeutic target for pain and neurological disorders. Here we show that the rabbit TRPM3 is intrinsically dynamic, with its intracellular domain (ICD) sampling both resting and activated states, but favoring the resting state in the absence of stimulation. We reveal that heat and the synthetic agonist CIM0216 shift the equilibrium toward activation by inducing a similar ICD rearrangement. Mutations that facilitate ICD movement enhance sensitivity to both thermal and chemical stimuli, underscoring the central role of the ICD in channel gating. We also show that the antagonist primidone binds the same site as CIM0216 in the S1–S4 domain but inhibits channel activation. This study provides a structural framework for a mechanistic understanding of thermal and chemical gating of TRPM3 and for guiding the rational design of TRPM3-targeted analgesics and neurotherapeutics.