エオメス陽性ヘルパーT細胞の研究に基づく成果
2021-03-09 国立精神・神経医療研究センター,日本医療研究開発機構
国立精神・神経医療研究センター(NCNP)神経研究所免疫研究部のベン・レイバニー研究員、佐藤和貴郎室長、大木伸司室長、山村隆部長らの研究グループは、NCNP病院・脳神経内科、同多発性硬化症センター、同放射線診療部および同臨床検査部との共同研究から、進行期にある多発性硬化症の早期発見に有用な血液診断マーカーを発見しました。多発性硬化症(MS)1)患者の20-50%は、再発寛解型(RRMS)を経て二次進行型多発性硬化症(SPMS)へ移行しますが、SPMSでは中枢神経内で慢性炎症と神経変性がゆっくりと不可逆的に進行し、車椅子や寝たきりの生活に至る例が多く見られます。治療薬の開発は進んでいますが、SPMSの診断は臨床的な評価に頼るしかないために容易ではなく、診断・治療の遅れなどの問題が生じています。今回の研究では、免疫応答に関わるT細胞の一種であるEomes陽性2)Th細胞(エオメス陽性ヘルパーT細胞)がSPMSの診断や病勢評価において有用なバイオマーカーとなることを明らかにしました。エオメス陽性ヘルパーT細胞の末梢血中の頻度(Eomes頻度)は、健常者、RRMS患者、一次進行型MS(PPMS)患者、SPMS患者の4群で比較検討したところ、SPMSで顕著な増加が見られ、SPMSの進行速度と有意に相関しました。研究チームは以前にマウスのSPMSモデルでエオメス陽性ヘルパーT細胞が脳内炎症を起こすことを報告しましたが(Raveny et al. Nature Comm 2015)、今回の研究ではSPMS患者の死後脳におけるエオメス陽性ヘルパーT細胞浸潤の証明にも成功しました。マウスの基礎研究の成果がヒト疾病で確認された意義は大きく、研究成果は今後、SPMS診断能力の向上、医療の均てん化、ひいてはMS患者の予後の向上に大きく貢献することが期待できます。
この研究成果は、米国アカデミー紀要「Proceedings of the National Academy of Sciences of the United States of America (PNAS)」オンライン版に報道解禁日を2021年3月9日午前5時(米国東部標準時間 3月8日午後3時)として掲載されます。
研究の背景
MSは、免疫系が自身の中枢神経系を攻撃することで発症する自己免疫疾患の一つです。主に髄鞘が障害されるRRMSでは、再発(=炎症性脱髄の悪化)と寛解(=炎症と脱髄の改善)を繰り返すことが特徴ですが、病歴が長くなったRRMS患者の一部はSPMS (secondary progressive MS)に移行します。SPMSでは脱髄に加えて神経組織の変性が起こり、神経障害は不可逆性に進展します。進行したSPMS患者の脳萎縮は顕著であり、それに伴い歩行困難、認知機能障害など、重篤な中枢神経症状を呈します。RRMSで有効性が確認されている薬剤はSPMSには効果がありません。SPMSの診断根拠としては、再発に関係ない神経障害の進行(progression independent of relapse activity; PIRA) を確認することが求められます。脳神経内科の臨床では、年1-2回の神経症状評価尺度(EDSS) 3)の評価値の変動などを参考にSPMSと診断しますが、PIRAの確認は容易ではなく、主治医がSPMSの診断を確定するまでに要する期間は年単位になっており、治療機会の喪失に繋がっていました。SPMS病態を的確に反映するバイオマーカーが利用できればSPMSの診療は現在よりもはるかに容易になることから、バイオマーカー研究が世界各国で展開されてきました。
なおSPMSの症状の進行速度は、必ずしも一定ではなく、「安定期(stationary phase)」と「進行期 (progressive phase)」が確認できるケースが多いことが認識されるようになっていますが、このこともSPMSの診療を複雑にする要因になっています。
研究の概要
本研究グループは、独自に開発したSPMSマウスモデルにおいてエオメス陽性ヘルパーT細胞が病原性細胞であることを示しました(Raveney et al. Nature Comm 2015)。SPMS患者の一部で血液中のエオメス陽性ヘルパーT細胞の増加を確認しましたが、大規模な研究で、その意義を確認する必要がありました。そこで今回、RRMSとSPMSだけでなく一次進行型MS(PPMS)も含む、多数例での解析を進め、エオメス陽性ヘルパーT細胞がSPMSのバイオマーカーとなりうるか、Eomes頻度の多寡がSPMS病態とどのように関連するのか、について調べました。その結果、SPMS患者のEomes頻度は他群に比較して有意な高値を呈し(図1)、その分布は健常人やRRMS患者と重なるピークと、頻度がより高く広域に分布するピークの2つのピークからなることがわかりました(図2)。
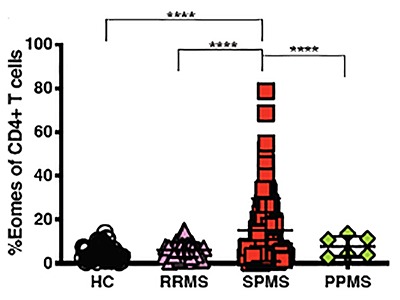
図1 MS患者および健常人のEomes頻度
健常者;HC、再発寛解型MS;PRMS、二次進行型MS;SPMS、一時進行型MS患者;PPMS
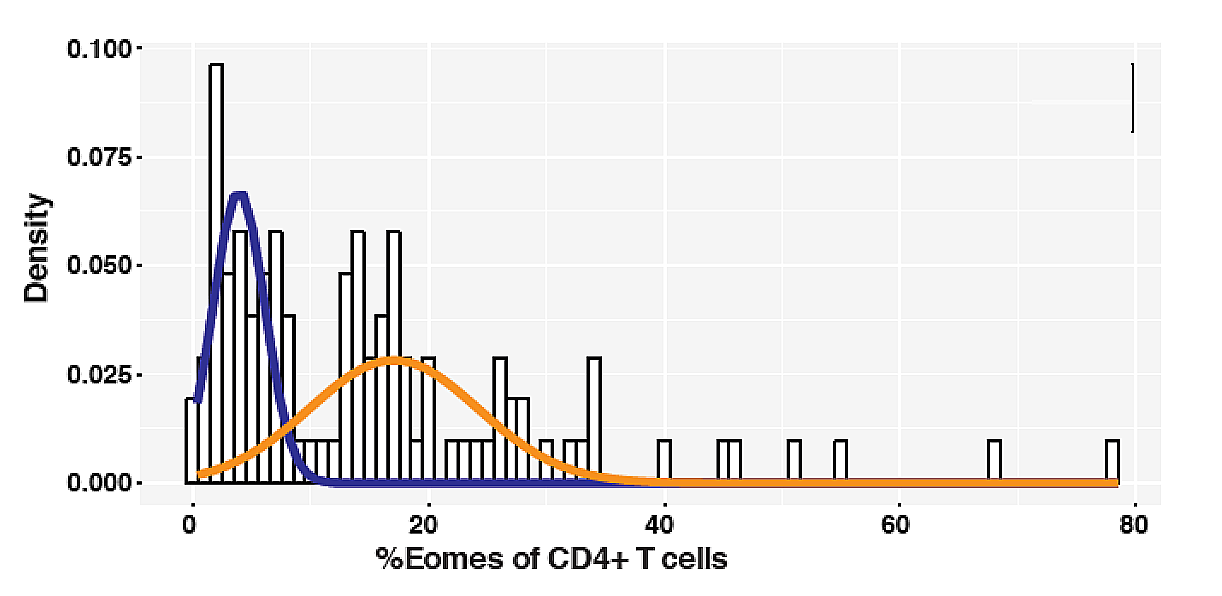
図2 SPMS患者のEomes頻度分布
混合ガウスモデルを用いた解析から、SPMS患者のEomes頻度分布□は、健常人やRPMS患者と重なるピーク(紺色)と、頻度がより高く広域に分布するピーク(オレンジ色)の2つの正規分布の線型結合からなることがわかった。
計算から得られたカットオフ値(=13%)を超える患者(Eomes-hi 群)はほぼ全例がSPMS患者でしたが、ほぼ同数のSPMS患者がカットオフ値以下(Eomes-lo群)でした。SPMSの症状の進行速度は、必ずしも一定ではなく、「安定期(stationary phase)」と「進行期 (progressive phase)」が確認できるケースが多いことは、先に述べましたが、次にこのEomes頻度の高低が、SPMS患者のどのような病態を反映するかを調べるため、SPMSの診断に用いるEDSSの1年間の変動量をEDSSと定義し、この値が0を超える患者をprogressive群(以下P群)、0以下の患者をstationary群(以下S 群)として2群のSPMS患者の比較を行いました。その結果、P群のEomes頻度はS群と比較して有意に高値を示し、先のEomes-hi 群とP群、Eomes-lo群とS群の大部分がオーバーラップすることがわかりました。ROC曲線(AUC=0.8276)から計算されたカットオフ値(=12.1%)は先のカットオフ値(13%)とよく一致しており、この値を用いてSPMS患者を分類すると、Eomes-hi 群の80%以上がP群に分類されることがわかりました(図3)。したがってEomes頻度がSPMS患者の障害進行度の良好な指標となる可能性が示されました。さらに複数回の診断でP群からS群(P→S)、またはS群からP群(S→P)と変化したSPMS患者と、P群のままであったSPMS患者のEomes頻度を調べたところ、P→Sの患者では有意なEomes頻度の低下、S→Pの患者では有意なEomes頻度の上昇が認められ、P群→P群では特定の傾向を示さないことがわかり、Eomes頻度が患者の障害進行度と相関してダイナミックに変動することが明らかとなりました(図4)。
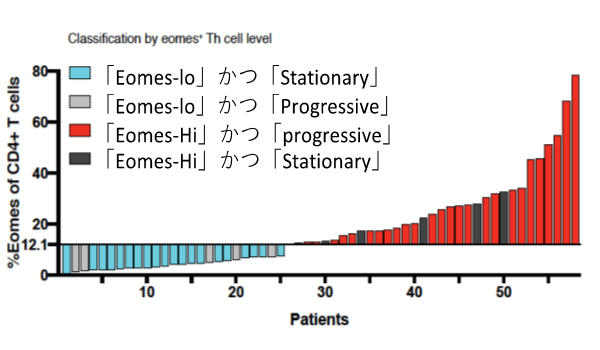
図3 SPMS患者のEomes頻度と障害進行度の相関(Waterfall plot解析)
ΔEDSSを指標SPMS患者をStationary群とProgressive群に分類し、ROC解析から得られたカットオフ値(=12.1%)を基準としたEomes-Hi/Loによる分類と比較した。
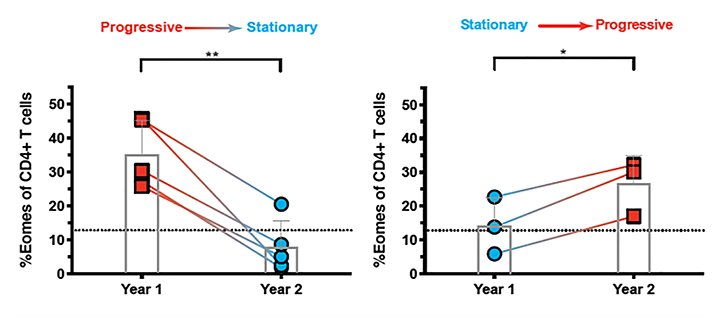
図4 Eomes頻度と臨床病態の変動
複数回の診断で、P群からS群(P→S;左)、またはS群からP群(S→P;右)と変化したSPMS患者のEomes頻度を示す。
さらにMRI画像の解析から、Eomes-hi 群のSPMS患者ではEomes-lo群に比べて灰白質の容積が有意に低下しており、SPMS患者に認められる灰白質の萎縮および重症度とEomes頻度の関連も明らかとなりました。
SPMSモデルマウスの脳脊髄組織や、SPMS患者の脳脊髄液中の Eomes頻度は明らかに増加しますが、エオメス陽性ヘルパーT細胞がSPMS患者の脳実質内にどのように分布するかは不明でした。そこで次にSPMS患者死後脳を対象に、分離した単核球画分を定法に従って抗体染色し、フローサイトメーターを用いてエオメス陽性ヘルパーT細胞の動態と中枢神経病理との関連を調べました4)。興味深いことに、脳実質内のTh細胞は、大部分がEomes陽性かつGranzyme B陽性であり、とくに前頭葉あるいは後頭葉のnormal-appearing white matter(NAWM)5)でEomes陽性細胞の割合が最も高く、皮質の病変部位にも多くのEomes陽性Th細胞が分布していました(図5)が、対照として用いたパーキンソン病患者由来脳組織ではそもそもTh細胞がほとんど検出されないことがわかりました。さらにSPMS患者の障害進行度とEomes頻度が極めてよく相関すること、およびエオメス陽性ヘルパーT細胞はSPMS患者の中枢神経系に広範に分布し、その多くがGranzyme B陽性の細胞障害性であることが明らかとなりました。さらにSPMS患者末梢血中のエオメス陽性ヘルパーT細胞も、その大部分がGranzyme B陽性であり、刺激に伴ってGranzyme B産生を引き起こすことも明らかとなりました。以上の結果は、SPMS患者のエオメス陽性ヘルパーT細胞およびGranzyme B陽性Th細胞が、神経細胞障害に直接関わる可能性を示すものです。
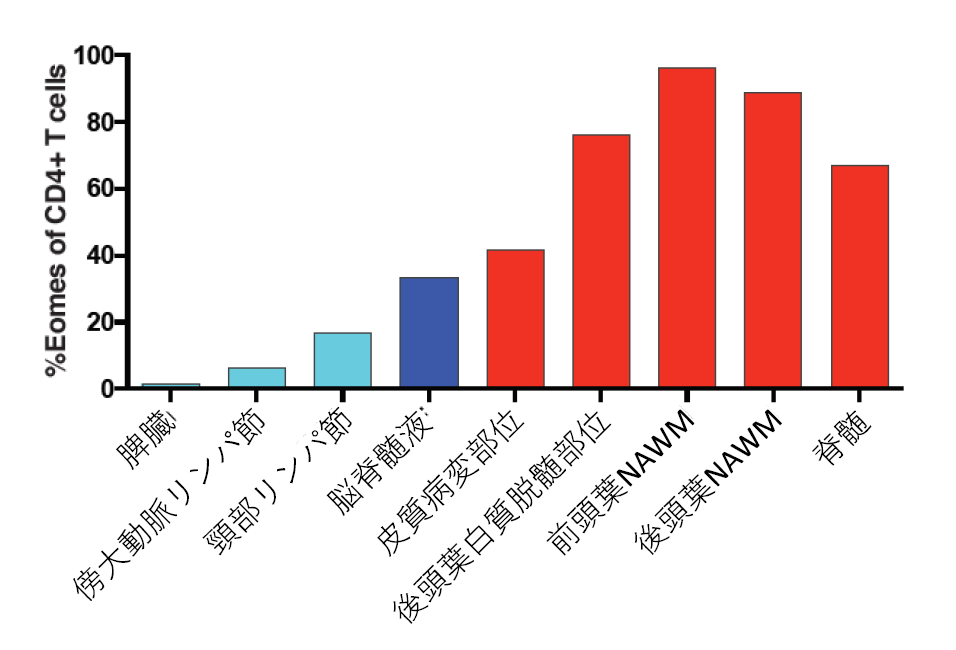
図5 ヒト中枢神経系のEomes陽性Th細胞の分布
フローサイトメーターを用いて、SPMS患者の中枢神経病理と、それぞれのエオメス陽性ヘルパーT細胞分布とを比較した。
今後の展望
今回の研究結果から、ヒト末梢血中のEomes頻度が、SPMSの病態進行度と極めて良く相関することが明らかとなり、同細胞はSPMS病態のリアルタイムのモニタリングを可能にする画期的なバイオマーカーであることが示唆されます。今後は多施設共同研究による多数サンプルの大規模解析を実施することで、SPMS患者の病態進行度のリアルタイム評価法を確立した上で臨床現場への普及を目指すことにより、より的確なSPMSの精密医療の実現に近づくことが期待されます。
用語説明
注1)多発性硬化症(multiple sclerosis; MS)
中枢神経系の炎症性脱髄疾患であり、その患者は国内では約2万5000人、全世界では200万〜300万人に達すると推定されている。大部分の患者が初発時に呈するRRMS(再発寛解型MS;relapsing-remitting MS)、RRMSから移行する進行性病態であるSPMS(二次進行型MS;secondary progressive MS)、および再発寛解病態を経ずに進行型病態を呈するPPMS (一次進行型MS; primary progressive MS)などの病型が知られている。SPMS では脱髄と並行して神経細胞障害による顕著な脳萎縮を認める。最近、有効性が示された初めてのSPMS治療薬であるシポニモドは、類似薬のフィンゴリモドと同様、リンパ球などの体内循環を阻害する活性を持つが、病態抑制につながるSPMSに対する作用機序は不明である。
注2)Eomes(Eomesodermin)
細胞障害性T細胞やNK細胞など、細胞障害性を示す細胞群で発現が亢進する転写因子の一つである。グランザイム、パーフォリン、インターフェロンγなどの発現に関わり、移植細胞、ウイルス感染細胞、癌細胞などの認識と破壊に関わる。
注3)神経症状評価尺度(EDSS)
多発性硬化症(multiple sclerosis:MS)患者の身体障害度の評価に用いることが推奨されている総合障害度評価スケール。日常診療や多くの臨床試験において、MSの身体障害度の評価に最も用いられている。評価方法として長い歴史もあり、信頼性,妥当性の高いMSの障害評価尺度といえるが、測定検者ごとに点数がばらつくこと、検出感度が必ずしも高くないこと、点数変化が直線的でないことなどの問題点も指摘されている。
注4)剖検組織を用いたフローサイトメーター解析
剖検組織サンプルを、ホルマリン固定しないままできる限り早く酵素消化することで、単核球画分を分離することが可能である。得られた細胞画分を定法に従って各種蛍光標識抗体を用いて染色し、フローサイトメーターを用いて解析することにより、脳内にした各種免疫細胞の挙動を解析することができる。NCNPでは、研究所免疫研究部とNCNP病院・脳神経内科、同臨床検査部との共同研究の積み重ねにより、この様な迅速な臨床サンプルの解析が可能となっている。
注5)normal-appearing white matter(NAWM)
MS患者における、通常のMRIの撮像では異常所見が確認されない潜在的な病変部位のこと。病理学的には、アストロサイトの増生、ミクログリアの活性化、血管周囲領域への細胞浸潤、軽度の軸索変性や脱髄などの病変を反映している。
原著論文情報
・タイトル
Involvement of cytotoxic Eomes-expressing CD4+ T cells in secondary progressive multiple sclerosis
・著者名
Ben JE Raveney, Wakiro Sato, Daiki Takewaki, Chenyang Zhang, Tomomi Kanazawa, Youwei Lin, Tomoko Okamoto, Manabu Araki, Yukio Kimura, Noriko Sato, Terunori Sano, Yuko Saito, Shinji Oki, Takashi Yamamura
・雑誌
Proceedings of the National Academy of Sciences of the United States of America (PNAS)
助成金
本研究成果は、以下の事業・研究領域・研究課題によって行われました。
・日本医療研究開発機構(AMED)難治性疾患実用化研究事業
・日本学術振興会・科学研究費補助金
・国立精神・神経医療研究センター・精神・神経疾患研究開発費
・日本多発性硬化症協会・医学研究助成
・加藤記念難病研究助成基金
お問い合わせ先
【研究に関する問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
神経研究所 免疫研究部
部長 山村 隆
室長 大木 伸司
【報道に関するお問い合わせ】
国立研究開発法人国立精神・神経医療研究センター
総務課広報係
【AMED事業に関するお問合せ】
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 創薬企画・評価課
難治性疾患実用化研究事業


