2019-05-24 理化学研究所
理化学研究所(理研)生命医科学研究センターがんゲノム研究チームの藤田征志上級研究員、中川英刀チームリーダーらの国際共同研究グループ※は、特殊な「混合型肝がん」を主とする肝がんの統合的ゲノム解析を行い、肝がんの新たな分子分類を確立し、混合型肝がんの遺伝的特徴と診断マーカーを発見しました。
本研究成果は、肝がんの診断精度を向上させ、個別化治療やがんゲノム医療に貢献すると期待できます。
肝がんには「肝細胞がん(HCC)[1]」と「肝内胆管がん(ICC)[2]」、それらが混在している混合型肝がんの三つの組織型があります。ほとんどはHCCもしくはICCですが、稀な混合型肝がんは診断が難しく、標準的な治療法もありません。
今回、国際共同研究グループは、主に日本と中国の合計130例の混合型肝がんの単一細胞解析[3]を含む統合的ゲノム解析を行い、これまで理研が解析してきたHCCとICCのゲノム変異と比較しました。その結果、肝がん全般について四つの分化度に基づく分子分類が可能であることが明らかになりました。また、混合型肝がんは、がん抑制遺伝子TP53[4]の変異がHCCやICCと比べて有意に多く、p53[4]の下流で幹細胞の分化可塑性[5]に関与するタンパク質Nestin[6]の高発現が見られたことから、混合型肝がんの診断マーカーとしての可能性が示されました。さらに、単一細胞解析にて、混合型肝がんの多くが単一細胞由来であることも分かりました。
本研究は、がん専門の科学雑誌『Cancer Cell』の掲載に先立ち、オンライン版(5月23日付け:日本時間5月24日)に掲載されます。
※国際共同研究グループ
理化学研究所生命医科学研究センター がんゲノム研究チーム
上級研究員 藤田 征志(ふじた まさし)
チームリーダー 中川 英刀(なかがわ ひでわき)
北京大学 医学部
Biomedical Pioneering Innovation Center(BIOPIC)
准教授 バイ・ファン(Bai Fan)
Health ScienceCenter 第一病院
教授 ツァン・ニン(Zhang Ning)
(天津大学 医学部)
広島大学 医歯薬保健学研究院 応用生命科学部門 消化器・代謝内科学
教授 茶山 一彰(ちゃやま かずあき)
※研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究A「肝胆膵がんの多元的オミックス解析による分子機構の解明(研究代表者:中川英刀)」による支援を受けて行われました。
背景
肝がんは、日本における部位別がん死亡者数で、男性では4位、女性では6位です。年間約4万人が肝がんと診断され、2万7000人以上が死亡しています注1)。さらに、世界全体の部位別がん死亡率では4位で年間約78万人の肝がん患者が死亡しており、特に日本と中国を含む東アジアで発症頻度が高く、世界の死亡者数の7割が東アジアです注2)。
主な原因は、肝炎ウイルスの持続感染であり、世界中の肝がんの約75%は、B型肝炎ウイルス(HBV)またはC型肝炎ウイルス(HCV)の感染によるものと推定され、肝炎ウイルスに感染し、慢性肝炎発症から肝硬変を経ると、高い確率で肝がんを発症します。原発性肝がん(最初にがんが発生した場所が肝臓であるがん)の90%以上は「肝細胞がん(HCC)」ですが、次いで、肝臓の中に発生する胆管がんである「肝内胆管がん(ICC)」が5~10%を占めます。さらには、HCCとICCの組織像が複雑に混在した腫瘍が見られる「混合型肝がん」が1~2%存在します。
ICCおよび混合型肝がんは、HCCに比べて悪性度が高く、特に混合型肝がんは最も予後が悪いのが特徴です。混合型肝がんでは、HCCまたはICCに対して行われる化学療法や血管塞栓療法への効果は不明であり、外科的切除以外に効果が期待できる標準的治療法もありません。また、ICC細胞とHCC細胞が複雑に混じっているため、切除前の画像診断や生検による病理診断での正確な診断は困難です。混合型肝がんには、多様な形態に分化したがん細胞が見られ、その組織学的な多様性から、最近では、肝細胞や胆管細胞の両方に分化する肝臓の幹細胞や未分化な細胞からのがん化の可能性も提案されています。
近年のDNA解読技術の飛躍的な進歩に伴い、次世代シーケンサー[7]とスーパーコンピュータを用いて、さまざまなタイプのがんや病気のゲノム変異を包括的に解析することが可能になってきました。がんは、ゲノム変異が蓄積することで発生・進行する“ゲノムの病気”であり、世界中でがんの網羅的ゲノム解析やその情報に基づく薬の開発、個別化医療に関わる研究が精力的に行われています。理研は、2008年よりがんのゲノム変異の全貌解明とカタログ化を目指し、「国際がんゲノムコンソーシアム(ICGC)注3)」に参画して、肝炎ウイルス関連の肝がん注4)やICC注5)の全ゲノムシーケンス解析[8]での研究を進めてきました。さらには世界のさまざまな施設と肝がんや他のがんの網羅的ゲノム解析の共同研究を行ってきています。
注1)国立がん研究センターがん対策情報センター「日本のがん最新統計まとめ2018」より
注2)「WHO IARC Estimated cancer incident, mortality and prevalence worldwide:Globocan 2018」より
注3)International Cancer Genome Consortium
注4)2016年4月12日プレスリリース「肝臓がん300例の全ゲノムを解読」
注5)2015年1月30日プレスリリース「慢性肝炎や肝硬変は肝内胆管がんのゲノム異常と発生に強く関与」
研究手法と成果
国際共同研究グループは、日本と中国、シンガポールにおいて合計130例の稀な混合型肝がんの手術凍結標本を収集しました。そして、それらのDNAとRNAから全ゲノムシーケンス解析、全エクソーム解析[9]、RNAシーケンス解析[10]を行い、これまで理研が解析してきた多数のHCCおよびICCのゲノム解析結果と比較検討しました。また、混合型肝がんの中のHCC細胞像の部分とICC細胞像の部分を顕微鏡下において分離、さらには単細胞レベルにまで分離して、網羅的ゲノム解析を行い、混合型肝がんの細胞由来や進化の過程の推定を試みました。
その結果、混合型肝がんでは、がん抑制遺伝子TP53の変異がHCCやICCと比べて有意に多く、約50%の症例で確認されました(HCCとICCは、20~35%)。これは、混合型肝がんの発生において、TP53の変異が中心的な役割をしていることを示しています。また、HCCでの発がんで最も重要なTERT遺伝子のプロモーター[11]やCTNNB1遺伝子の変異は、それぞれ23%、6%しか確認できず、HCCの変異遺伝子との重複はわずかでした。
また、混合型肝がんの病理学的検討では、HCC細胞とICC細胞の境目がはっきりする腫瘍(Combined type)と、境目がはっきりせずHCC細胞とICC細胞が複雑に混ざっている腫瘍(Mixed type)に分類されます(Allen & Lisa分類)。国際共同研究グループは、105例の混合型肝がんおよびHCCとICCを含む合計367例の原発性肝がんについて、それらのRNA発現プロファイルを統合・解析しました。そして、肝がんの分化機構に着目して、「胆管細胞への分化型(P1)」「低分化型(P2)」「肝細胞への分化型(P3)」「肝細胞への高分化型(P4)」の四つに分類した結果、混合型肝がんのCombined typeとICCはP1に属し、混合型肝がんのMixed typeと形態上肝細胞への分化度が低いHCC、TP53変異(+)肝がんはP2に属していることが分かりました(図1)。P2では、ICCで観察されるIDH1遺伝子やKRAS遺伝子の変異が見られませんでした。また、混合型肝がんが属し、分化機構の異常があると考えられるP1とP2の予後はP3とP4に比べて有意に不良であり、悪性度が高いことが分かりました。
次に、混合型肝がんのCombined typeとMixed typeについて、それぞれのHCC細胞とICC細胞を顕微鏡下にて分離した後、ゲノム解析を行いました。その結果、Combined typeは同じP1に属するICCと似た特性を持っており、Mixed typeはHCCと分子特性が似ており、それぞれ異なる分子特性を持っていることが分かりました。さらに、単一細胞解析の結果では、Combined typeとMixed typeはともに単一クローンから増えてきたこと(単一細胞由来)が分かった一方で、複数のクローンからHCCとICCが別々に発生し、それらが合体して混合型肝がんになったものも少数ですがありました。
がん抑制遺伝子であるTP53は混合型肝がんで変異が多く観察されます。TP53にはさまざまな機能があり、細胞の分化可塑性にも関わることが報告されていることから、TP53が変異すると、脱分化[5]からさまざまな形態の組織へ再分化する可能性があります。免疫組織染色解析の結果、混合型肝がんではp53(TP53よりコードされるタンパク質)の下流で細胞の分化可塑性、脱分化に関与するNestinタンパク質が高発現しており(図2)、Nestinの発現は予後不良とも関連していたことから、混合型肝がんの診断マーカーになる可能性が示されました。
今後の期待
今回の混合型肝がんの統合的ゲノム解析によって、混合型肝がんを含む肝細胞がんや胆管がんの詳細な分子生物学的な分類が明らかになりました。
今後、研究が進展することで、標準治療のない混合型肝がんの治療は、HCCに対する治療法か、もしくはICCに対する治療法へと個別化できる可能性があります。
また、これらの成果は、早期診断法や効果的な治療法がない混合型肝がんに対して、これらを標的とした新しい治療法や診断法の開発に貢献すると期待できます。特にTP53変異やNestinの発現は、病理診断にても困難な混合型肝がんの診断のためのマーカーとなる可能性があります。
原論文情報
Ruidong Xue, Lu Chen, Chong Zhang, Masashi Fujita (equally contribution), Ruoyan Li, Shu-Mei Yan, ChoonKiat Ong, Xiwen Liao, Qiang Gao, Shota Sasagawa, Yanmeng Li, Jincheng Wang, Hua Guo, Qi-Tao Huang, Qian Zhong, Jing Tan, Lisha Qi, Wenchen Gong, Zhixian Hong, Meng Li, Jingmin Zhao, Tao Peng, Yinying Lu, Kiat Hon Tony Lim, Arnoud Boot, Atushi Ono, Kazuaki Chayama, Zemin Zhang, Steve George Rozen, Bin Tean Teh, Xin Wei Wang, Hidewaki Nakagawa*, Mu-Sheng Zeng*, Fan Bai*, and Ning Zhang* (*correspondence), “Genomic and transcriptomic profiling of combined hepatocellular and intrahepatic cholangiocarcinoma reveals distinct molecular subtypes”, Cancer Cell, 10.1016/j.ccell.2019.04.007
発表者
理化学研究所
生命医科学研究センター がんゲノム研究チーム
上級研究員 藤田 征志(ふじた まさし)
チームリーダー 中川 英刀(なかがわ ひでわき)
報道担当
理化学研究所 広報室 報道担当
補足説明
-
- 肝細胞がん(HCC)
- 原発性肝がんの90%以上を占め、その多くは慢性肝炎や肝硬変を経て発生する。病理学的検査では、正常の肝細胞と似た組織形態を示し、肝細胞から発生した腫瘍であると考えられている。肝臓内での転移が多く、リンパ節転移はしない。治療としては、主な外科的切除以外に、血管が豊富なためTACE(血管内塞栓化学療法)、RFA(ラジオ焼却術)、分子標的治療薬(Sorafenib, Lenvatinib)による治療が行われる。
-
- 肝内胆管がん(ICC)
- 原発性肝がんの5~10%を占め、病理学的検査にて、胆管のような腺管構造を伴った腫瘍増殖があることから、肝臓内に存在する胆管細胞からの発生、または胆管細胞へ分化した腫瘍と考えられる。HCCと比べて血流は少なく、他の胆管がんと同様にリンパ節転移をきたす。治療としては、通常の胆管がんの治療法に準じて、リンパ節切除を伴う外科的切除以外に、ゲムシタビンとシスプラチンといった全身化学療法が行われる。
-
- 単一細胞解析
- 多数で多様な細胞の集合体である組織を一細胞に分離した後に、それぞれの細胞よりDNAやRNAを抽出し、それらのゲノム解析を行う。数十個から数千個の細胞の解析を一度に行い、それらの多様性や進化的つながりを検討する。
-
- TP53、p53
- TP53は最も代表的ながん抑制遺伝子で、p53はその産物(タンパク質)であり、さまざまながんで機能喪失変異が多く観察される。ゲノムの守護神と呼ばれるように、ゲノムに傷が入った細胞を死滅させたり、増殖を止めてゲノム修復を促すなど、さまざまな機能を持っている。転写因子として、さまざまな遺伝子の発現を制御している。
-
- 分化可塑性、脱分化
- 幹細胞からさまざまな成熟した細胞に分化して生体組織が構築されるが、この分化の過程は一方通行であるので、ひとたび分化した細胞が幹細胞のような機能を持つことは原則ないもの考えられてきた。しかし、近年、がん細胞やさまざまな分化した細胞が幹細胞的特性を再獲得する可塑性や脱分化を発揮することが報告され、脱分化した幹細胞的な細胞から、さらに別の細胞形態へ再分化することがあり得る。
-
- Nestin
- 神経系の幹細胞に特有のフィラメント(細胞骨格タンパク)として同定され、胎生期の脳の形成過程での多潜能を有する幹細胞で選択的に発現し、神経細胞などに分化すると発現は消失する。最近、p53が直接Nestin遺伝子の発現を抑制しており、p53の喪失により細胞が可塑性を獲得してNestin陽性の幹細胞的な能力を獲得することが、明らかになった。
-
- 次世代シーケンサー
- ヒトゲノムの全配列約30億塩基を1,000米ドル以下のコストで解読すべく、欧米の政府や企業が技術開発を行った結果、より高速高精度の性能を持つシーケンサーが開発された。従来の方法に比べ、超大量のDNAシーケンス反応を並列して行うことができる。現在、ヒトの全ゲノムは約10万円で解析できるようになった。
-
- 全ゲノムシーケンス解析
- 次世代シーケンサーを使って、約30億塩基からなる個人の正常細胞やがん細胞の全ゲノム情報を解読し、配列の違いや変化を同定すること。データが大量になるため、スーパーコンピュータを使って情報解析を行うのが一般的である。全ゲノムシーケンス解析の場合、タンパク質をコードする1~2%の範囲のエクソンだけでなく、遺伝子の発現を制御するゲノム領域の変異やさまざまな構造異常(大きなゲノム配列異常)も検出可能で、究極のゲノム解析手法といえる。がんの場合は、がんのDNAと同一患者由来の正常DNAの全ゲノムシーケンス解析を行い、その差分を調べる。
-
- 全エクソーム解析
- 全ゲノムのうち、タンパク質をコードする約1~2%の範囲のエクソンのみを次世代シーケンサー用いて解析するゲノム解析手法。
-
- RNAシーケンス解析
- RNAから逆転写したcDNA(RNAと相補的なDNA)を、次世代シーケンサーですべて解析する実験手法。RNAの定量のみならず、新規転写産物の検出や、スプライシングイベントの定量などを行うことができる。
-
- プロモーター
- 遺伝子の転写開始付近に位置して、遺伝子を発現させる機能を持つ塩基配列。プロモーターがないと遺伝子は発現しない。
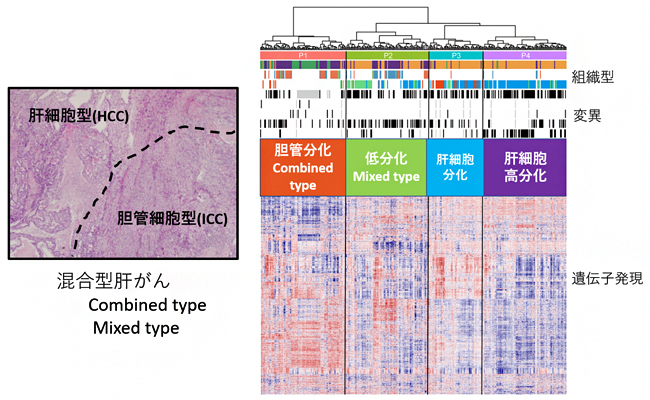
図1 新たな肝がんの分子分類とその特性
左図)混合型肝がんは、HCCとICCがさまざまな程度で混在する(Allen & Lisa分類)。
右図)遺伝子発現解析と肝がんの分化機構により、HCCとICCも含む肝がんは四つに分子分類(P1~P4)され、混合型肝がんのCombined typeとMixed typeは、それぞれP1とP2に分類された。
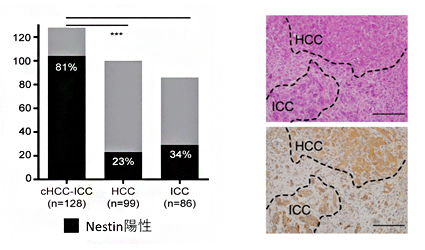
図2 Nestinは混合型肝がんの診断マーカー
左図)上段は、混合型肝がんの通常の病理像(HE染色)で、HCCとICCの境界を示している。下段は、Nestinの免疫組織染色による画像で、HCC細胞とICC細胞に両方が強い発現がみられる。スケールバーは400μm。
右図)81%の混合型肝がんでNestin陽性となるに対して、HCCやICCでは20~30%しか陽性とならない。