オートファジーを介する抗加齢効果と病態との関連を示唆
2019-07-02 順天堂大学,日本医療研究開発機構
本研究成果のポイント
- パーキンソン病患者の重症度に相関するジアセチルスペルミジンを特定
- パーキンソン病患者ではスペルミジンからスペルミンへの転換が年齢に拘わらず一貫して低下
- 血中のポリアミンとその代謝産物がパーキンソン病早期診断・重症度評価のバイオマーカーに
概要
順天堂大学大学院医学研究科神経学の斉木臣二准教授、服部信孝教授、老人性疾患病態・治療研究センターの吉川有紀子特任助教らの研究グループは、パーキンソン病*1患者血清中のポリアミン(スペルミン)*2とその代謝産物*37種がパーキンソン病診断・重症度評価のバイオマーカーになりうることを発見しました。さらに、パーキンソン病患者ではオートファジー誘導作用によって長寿効果を持つとされるスペルミン産生が年齢にかかわらず一貫して低下していることを明らかにしました。これらの結果はパーキンソン病患者の加齢リスクとオートファジーとの関連を初めて示した画期的な成果で、病態に基づく早期診断に繋がる点に意義があります。本成果は、米国神経学会誌「Annals of Neurology」のオンライン版(日本時間2019年7月3日付)で公開されます。
背景
パーキンソン病は有病率が10万人あたり140人に上るわが国で2番目に多い神経変性疾患で、運動に関する症状(手足・首が震える、手足がこわばる)が徐々に進行します。疫学研究によりパーキンソン病発症の最大のリスクは加齢であることがわかっており、高齢化が進む2030年には全世界での患者数が1400万人を超えるといわれています。
研究グループは一貫して、微量血液に含まれる、パーキンソン病患者さんの病状を正確に反映するバイオマーカーを探索していますが、現時点では臨床応用されているものはありません。病気の進行と共に変化するマーカーは、患者さんの状態を正しく知るだけでなく、新たな治療薬の薬効を評価する上でも極めて重要です。今回、我々は「パーキンソン病発症率が加齢と共に大きく上昇する」ことに着目し、患者体内で抗加齢効果を持つ物質が減少しているのではないかと仮説し、研究を開始しました。
内容
まず、パーキンソン病患者を含む集団血漿データ(健常者45名、パーキンソン病患者145名)を検討し、抗加齢効果を持つスペルミジンから作られるN8-アセチルスペルミジンの値が上昇していることを見出しました。 スペルミジンやスペルミンはポリアミンの一種であり、線虫・ショウジョウバエ・マウスにおいてオートファジー*4を誘導することで、運動機能保持・記憶力保持・心機能保護等の抗加齢効果を持ちます。次にパーキンソン病患者体内でポリアミンがどのように代謝されているかを解明するため、別集団(健常者49名、パーキンソン病患者186名)において病期・重症度との関連を血清ポリアミンとその代謝産物7種(スペルミジン、スペルミン、N1,N8-ジアセチルスペルミジン、N1-アセチルスペルミジン、N8-アセチルスペルミジン、N1,N12-ジアセチルスペルミン、N-アセチルスペルミン)に拡張して評価し、併せてMRIにおける脳実質の変化との関係や代謝酵素遺伝子変異を調べました。
その結果、パーキンソン病患者群ではジアセチルスペルミジン、N1-アセチルスペルミジン、N8-アセチルスペルミジン、ジアセチルスペルミン、スペルミジンが有意に増加している一方、スペルミンは減少していることを発見しました(図表1)。これらの代謝物のうち、ジアセチルスペルミジンはパーキンソン病の重症度*5に相関して上昇していました(図表2)。さらに、ポリアミン7種の各濃度により高確率でパーキンソン病を診断できることがわかり、バイオマーカーとしての有用性を実証することができました。またパーキンソン病患者では黒質ドパミン神経細胞だけでなく、他の神経軸索ネットワークも障害されていることが分かっていますが、無作為に抽出したパーキンソン病患者20名のMRI像の脳の軸索変化とジアセチルスペルミジン値の関係を検討したところ、ジアセチルスペルミジンが高いほど、脳の軸索障害が強いことが分かりました。
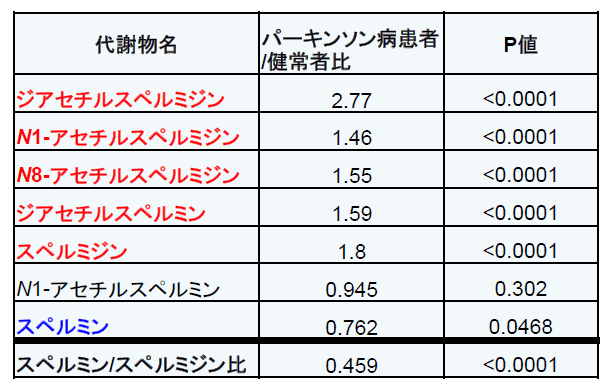
図表1:血清中ポリアミン代謝物比
健常者(1とする)に対するパーキンソン病患者血清中濃度の割合。赤字は患者群で有意増加した化合物、青字は有意に低下した化合物を示します。

図表2:ポリアミン代謝物濃度とパーキンソン病重症度との相関
パーキンソン病患者では7種類のポリアミン代謝物のうちジアセチルスペルミジンが重症度と相関して血清中で高値を示しました。(***: p<0.0001)
次にパーキンソン病患者群ではスペルミジンが増加しているにもかかわらず、その下流代謝物であるスペルミンが減少していることに着目しました。実際、スペルミン/スペルミジン比はパーキンソン病患者で有意に低下しており(図表3A)、健常者では加齢に伴いスペルミン/スペルミジン比が低下するのに対し、パーキンソン病患者群では年齢に関係なく低値を示しました(図表3B)。本結果は加齢が最大のリスクとされるパーキンソン病患者では、スペルミンによる抗加齢作用が低下していることを示唆します。また7種のポリアミン化合物の中でスペルミンが神経系細胞で最も高いオートファジー誘導能を示しました。
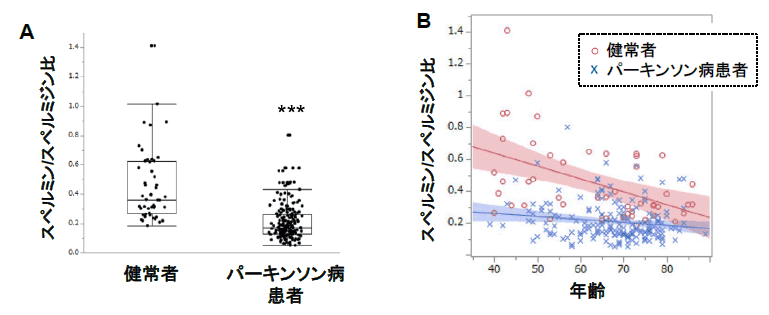
図表3:ポリアミン代謝物濃度とパーキンソン病重症度との相関
A.パーキンソン病患者でスペルミン/スペルミジン比が有意に低値を示しました。(***: p<0.0001)
B.健常者では加齢に伴いスペルミン/スペルミジン比が低下するのに対し、パーキンソン病患者では年齢に関係なく低値を示しました。
今後の展開
本成果から血中ポリアミン・関連代謝産物測定により、パーキンソン病の早期診断・疾患重症度判定が可能となり、薬効評価への応用を介して、新薬創製に繋がることが期待されます。スペルミン/スペルミジン比は、超早期の前臨床期・前駆症状期における発症前診断に繋がり、ひいては先制医療開発の一助となるものと考えられます。
パーキンソン病ではスペルミンによる抗加齢作用が低下していることから、研究グループでは、オートファジー誘導能が最も高いスペルミンについて、その体内濃度を調節する仕組み・オートファジーを誘導する仕組みについて検討を続けており、加齢メカニズムとパーキンソン病の発症メカニズムとの関係をさらに明らかにすることで、パーキンソン病の新たな治療法の開発を目指しています。
用語解説
- *1 パーキンソン病:
- 進行性の中脳黒質神経細胞脱落を特徴とする神経変性疾患で、わが国の患者数は14万人とされるが、高齢になるほど発症率が高まるため、2030年には全世界で1400万人が罹患すると予測されている。
- *2 ポリアミン(スペルミン):
- 生体内化合物群のうちプトレシン、スペルミジン、スペルミンの3化合物の総称。スペルミジン、スペルミンはオートファジー誘導作用が線虫、ショウジョウバエ、マウスで報告されており、オートファジー誘導を介して長寿に働くとされる。
- *3 ポリアミンとその代謝産物:
- 下図に示すように、本研究では化学的に安定な赤字の化合物7種を測定した。プトレシンからスペルミジンが、スペルミジンからスペルミンが合成され、アセチル化されることにより生理活性を失うと考えられている。
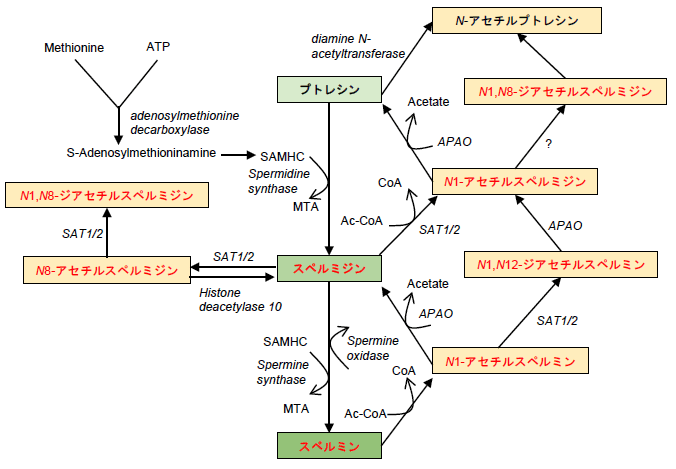
- *4 オートファジー:
- リソソームにおけるたんぱく質分解系の一つで、細胞、個体の恒常性維持に必須な細胞応答である。オートファジーの異常は神経変性疾患を引き起こすと考えられている。本機構に関与する遺伝子の同定・機能解析の功績により、2016年に大隅良典先生がノーベル医学生理学賞を受賞されている。
- *5 パーキンソン病の重症度:
- パーキンソン病の重症度を示す指標として「ヘーン-ヤールの重症度(Ⅰ~Ⅴ度)分類」が用いられる。Ⅰ度:ふるえなどの症状が片方の手足のみである場合、Ⅱ度:両方の手足にみられる場合、Ⅲ度: 病気が進行し姿勢反射障害(体のバランスの障害)を示す場合、Ⅳ度:日常生活に部分的な介助が必要になった場合、Ⅴ度:車いすでの生活や寝たきりとなった場合。
原著論文
本研究成果は、米国神経学会誌の「Annals of Neurology」誌のオンライン版(日本時間2019年7月2日15時)リンク先:Wiley Online Libraryで正式公開されます。
- 英文タイトル:
- A metabolic profile of polyamines in Parkinson’s disease: a promising biomarker
- 日本語訳:
- ポリアミン代謝プロファイルはパーキンソン病バイオマーカーになる
- 著者:
- Shinji Saiki1†, Yukiko Sasazawa†, Motoki Fujimaki, Koji Kamagata, Naoko Kaga, Hikari Taka, Yuanzhe Li, Sanae Souma, Taku Hatano, Yoko Imamichi, Norihiko Furuya, Akio Mori, Yutaka Oji, Shin-Ichi Ueno, Shuko Nojiri, Yoshiki Miura, Takashi Ueno, Manabu Funayama, Shigeki Aoki, Nobutaka Hattori († joint 1st authors)
- 著者(日本語表記):
- 斉木 臣二1、吉川(笹澤)有紀子1,2、藤巻 基紀1、鎌形 康司3、加賀 直子4、高 ひかり4、李 元哲1、相馬 早苗1、波田 野琢1、今道 洋子1、古屋 徳彦1, 5、森 聡生1、王子 悠1、上野 真一1、野尻 宗子6、三浦 芳樹4、上野 隆4、舩山 学1,2、青木 茂樹3、服部 信孝1
- 所属:
- 1順天堂大学大学院医学研究科神経学、2順天堂大学老人性疾患病態・治療研究センター、3順天堂大学大学院医学研究科放射線診断学、4順天堂大学研究基盤センター生体分子研究室、5順天堂大学オートファジー調節化合物探索研究講座、6順天堂大学革新的医療技術開発研究センター
- DOI:
- 10.1002/ana.25516.
本研究は、文部科学省私立大学戦略的研究基盤形成支援事業、文部科学省新学術領域研究領域提案型「オートファジーの集学的研究」、およびJSPS科研費(研究代表者:斉木臣二: JP15H04843, JP18H02744, JP18KT0027, JP18KK0242; 笹澤有紀子: JP16J40133, JP18K15464)と共に、国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(AMED-CREST)「疾患における代謝産物の解析および代謝制御に基づく革新的医療基盤技術の創出」研究開発領域*(研究開発総括:清水孝雄)における研究開発課題「パーキンソン病の代謝産物バイオマーカー創出およびその分子標的機構に基づく創薬シーズ同定」(研究開発代表者:服部信孝)による支援を受けて行われました。 また、本研究に協力頂きました患者さんのご厚意に深謝いたします。
*本研究開発領域は、平成27年4月の日本医療研究開発機構の発足に伴い、国立研究開発法人科学技術振興機構(JST)より移管されたものです。
お問い合せ先
研究内容に関するお問い合せ先
順天堂大学大学院医学研究科 神経学
准教授 斉木 臣二(さいき しんじ)
取材に関するお問い合せ先
順天堂大学 総務部 文書・広報課
担当:長嶋 文乃
AMED事業に関するお問い合せ先
国立研究開発法人 日本医療研究開発機構(AMED)
基盤研究事業部 研究企画課