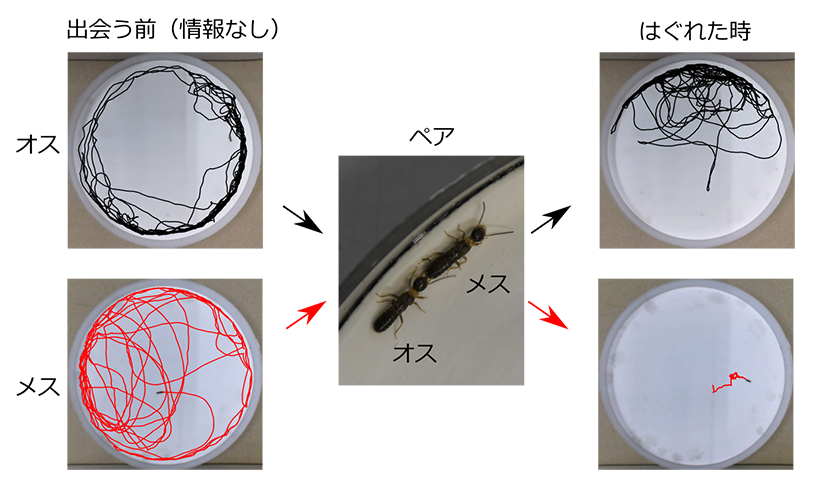
膜タンパク質TRPC6のブレーキ機構CDIの破綻が原因
2019-07-10 京都大学
森誠之 工学研究科准教授(現・産業医科大学教授)、オノー・ポラット 同博士課程学生、宇野雅俊 同博士課程学生、杤尾豪人 理学研究科教授らの研究グループは、腎病変の一つである巣状糸球体硬化症(Focal segmental glomerulosclerosis:FSGS)の発症メカニズムを分子および細胞レベルで解明しました。
本研究グループは、カルシウムチャネルの一つTRPC6の活性にブレーキをかける、Ca2+依存的不活性化(Ca2+-dependent inactivation:CDI)と呼ばれる機構に関する研究を行い、その分子的基盤を得ました。そして、本知見をもとにFSGS型のTRPC6を解析したところ、解析した全てのFSGS型TRPC6において分子構造体の異常を伴ったCDIの破綻を認めました。さらにCDIの破綻がポドサイト(腎糸球体上皮細胞、通称たこ足細胞)の細胞骨格形成異常につながることを初めて確認しました。
本研究成果はTRPC6のCDI分子機構を明らかにすると共に、このブレーキ機構の破綻がFSGS発症原因であるという新しい概念を提唱するもので、FSGSの診断、治療へ向けた重要な足がかりになると考えられます。
本研究成果は、2019年7月3日に、国際学術誌「Journal of American Society of Nephrology」のオンライン版に掲載されました。

図:(A)CDIの概念図。(B)TRPC6のCDIとポドサイト(腎臓糸球体上皮細胞)の関連性。
書誌情報
【DOI】 https://doi.org/10.1681/ASN.2018070756
Onur K. Polat, Masatoshi Uno, Terukazu Maruyama, Ha Nam Tran, Kayo Imamura, Chee Fah Wong, Reiko Sakaguchi, Mariko Ariyoshi, Kyohei Itsuki, Jun Ichikawa, Takashi Morii, Masahiro Shirakawa, Ryuji Inoue, Katsuhiko Asanuma, Jochen Reiser, Hidehito Tochio, Yasuo Mori and Masayuki X. Mori (2019). Contribution of Coiled-Coil Assembly to Ca2+/Calmodulin-Dependent Inactivation of TRPC6 Channel and its Impacts on FSGS-Associated Phenotypes. Journal of the American Society of Nephrology, 30(7).
詳しい研究内容について
腎病変「巣状糸球体硬化症」の発症メカニズムを分子・細胞レベルで解明
―膜タンパク質 TRPC6 のブレーキ機構 CDI の破綻が原因―
概要
近年、高齢者のみならず就労年齢における腎疾患患者数、腎臓透析患者の増加傾向が続いており、腎機能破 綻機構の解明と治療戦略の明確化が急務になってきています。巣状糸球体硬化症(Focal segmental glomerulosclerosis:FSGS)は、腎臓の機能不全を引き起こす可能性のある代表的な腎病変の一つで、今から 15 年ほど前、カルシウムチャネルの一つ TRPC6 チャネルの変異がこの FSGS に関連していることが報告さ れました (Reiser et al, Nature Genet, 2005、Winn et al, Science, 2005)。しかし変異が生じると何が起きて、 何が問題になるのか、詳細は不明のままであり原因究明が求められていました。
今回、京都大学大学院工学研究科森誠之准教授(研究当時、現:産業医科大学医学部教授)、オノーポラッ ト同博士課程学生、宇野雅俊 同博士課程学生、京都大学大学院理学研究科 杤尾豪人 教授らの研究グループ は、TRPC6 の活性にブレーキをかける、Ca2+依存的不活性化 (Ca2+ -dependent inactivation :CDI)と呼ばれ る機構に関する研究を行い、その分子的基盤を得ました。本知見をもとに FSGS 型の TRPC6 を解析したとこ ろ、解析した全ての FSGS 型 TRPC6 において分子構造体の異常を伴った CDI の破綻を認めました。さらに CDI の破綻がポドサイト (腎糸球体上皮細胞、通称たこ足細胞)の細胞骨格形成異常につながることを初めて 確認しました。これらの結果は TRPC6 の CDI 分子機構を明らかにすると共に、このブレーキ機構の破綻が FSGS 発症原因であるという新しい概念を提唱するもので、診断、治療へ向けた重要な足がかりになると考え られます。
本成果は、2019 年 7 月 3 日に米国腎臓学会誌「Journal of American Society of Nephrology」のオンライ ン版に掲載されました。
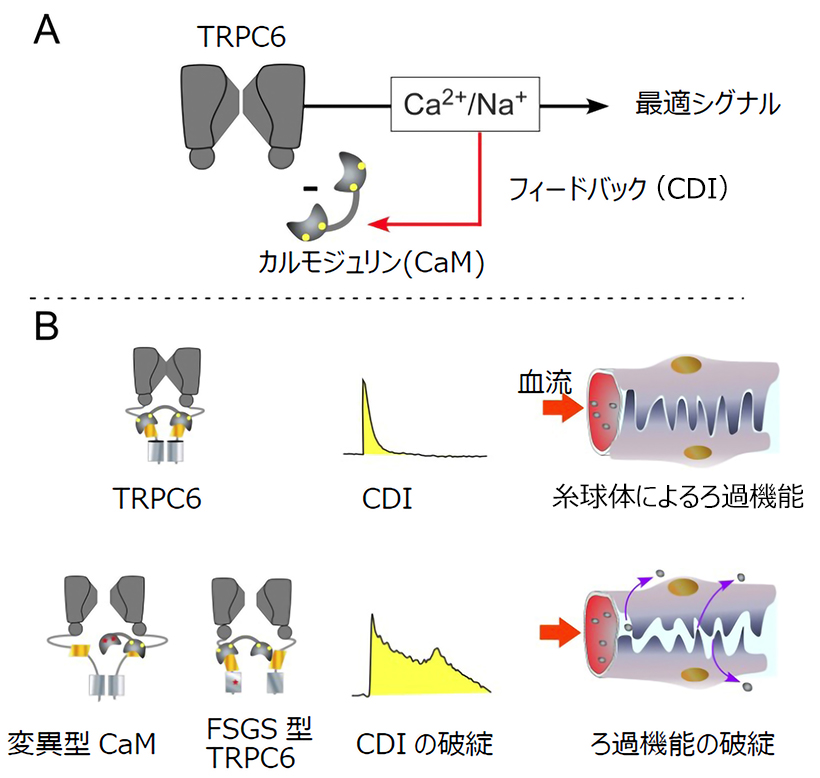
図 A: CDI の概念図。 TRPC6 チャネルを通過して 細胞内に流入した Ca2+がカルモジュリン(CaM)と 結合して TRPC6 に負のフィードバック制御(CDI)を 掛ける。
B: TRPC6 の CDI とポドサイト(腎臓糸球体上皮細 胞)の関連性。 (上): 通常の CDI が行われている状 態では Ca2+や Na+流入は一過的でありポドサイト の細胞形態が維持される。ろ過機能は正常。(下): 変 異型 CaM や FSGS 型 TRPC6 では CDI 制御が掛か り難くなり、Ca2+や Na+応答は持続的になる。ポド サイトの細胞形態に変化が生じ、タンパク質等が漏 出し FSGS(ネフローゼ症候群の一種)が発生する。
研究のポイント
●腎疾患患者、腎臓透析患者の増加が続いており、腎機能が破綻するメカニズムの解明が急務となってい る。
● 細胞膜上のカルシウムチャネルの一つ TRPC6 の分子機構を明らかにし、ブレーキ機構の破綻が巣状糸 球体硬化症発症の原因であるとの新しい概念を提唱した。
● 巣状糸球体硬化症の治療に際し TRPC6 チャネル活性を抑制することが重要であることを分子的に証明 するものでもあり、今後の治療へ向け大きな足がかりになると期待される。
1.背景
近年、高齢者のみならず就労年齢における腎疾患患者数、腎臓透析患者の増加傾向が続いており、腎機能破 綻機構の解明と治療戦略の明確化が急務になってきています。腎病変の一つ巣状糸球体硬化症(Focal Segmental Glomerulosclerosis :FSGS)はその多くがステロイド治療に抵抗性を示し、腎不全を引き起こす可 能性のある代表的な腎病変の一つです。15 年ほど前、家族性 FSGS の遺伝学的解析からカルシウムチャネル の一つ TRPC6 チャネルが本病変に関連することが報告されました(Reiser et al, Nature Genet, 2005、Winn et al, Science, 2005)。以来、今日まで 30 種類近くの TRPC6 変異体が世界中の様々な地域に住む患者さんか ら見つかっています。これらの変異体は一般的にチャネル活性の亢進を生じると言われていますが、どのよう な機構で活性が亢進するのか分かっていません。更に活性に影響を及ぼさない、もしくは活性が減弱する変異 体も存在するなど、TRPC6 チャネル単独では病態を説明することができていませんでした。この為、TRPC6 変異による病態発生メカニズムの詳細は混沌としており、効果的な治療方針の明確化のため、詳細な分子機構 の解明が求められていました。
2.研究手法・成果
TRPC6 は Ca2+ (カルシウムイオン)を細胞内に透過する膜蛋白質の一つであり、細胞内 Ca2+依存的に不活 性化する、Ca 2+ -dependent inactivation(CDI)と呼ばれる自己抑制的(ブレーキ)機構を保持しています。 我々はこの CDI 機構がどの様にして起こるのか明らかにするため、細胞内カルシウム結合タンパク質 Calmodulin(CaM)や TRPC6 の coiled-coil ドメインを介した分子複合体構造について、NMR (核磁気共鳴法) や FRET (蛍光共鳴エネルギー移動)等の手法を用いて解析しました。その結果、Ca2+と結合した CaM が TRPC6 の coiled-coil ドメイン近傍において橋渡し的に相互作用することで CDI を生じさせているメカニズムを見出 しました(1 ページの図 B、Normal CDI)。TRPC6 の coiled-coil ドメインには FSGS の変異が多数報告され ていたことから、変異型 coiled-coil ドメインの複合体形成に関して解析したところ、FSGS 型 coiled-coil ド メインは標準型に比べ複合体形成において強弱が見られました。また電気生理学的に機能的な解析をしたとこ ろ、評価した5種類全ての FSGS 型 TRPC6 において顕著な CDI の遅延を認めました。更に FSGS 型 TRPC6 チャネルや CDI 遅延を引き起こす CaM の変異体をポドサイトに発現させたところ、細胞骨格 (アクチンフィ ラメント)において病態様構造変化が引き起こされることを確認しました。このことは CDI の破綻が FSGS の 原因になることを初めて分子、細胞レベルで示唆する結果です。
3.波及効果、今後の予定
本研究の結果は TRPC6 チャネルの不活性化機構の発端を明らかにする基礎研究であると共に、CDI の破綻 が FSGS の発症原因であるという新しい概念を提唱するものです。日本人にも TRPC6 原因で FSGS を発症す る患者が報告されていますが、本研究により FSGS の治療に際し TRPC6 チャネル活性を抑制することが重要 であることを分子的に証明するものでもあり、今後の治療へ向け大きな足がかりになると考えています。
4.研究プロジェクトについて
本研究は、下記のメンバーによって行われました。
● 京都大学大学院工学研究科 合成 生物化学専攻 教授 森泰生 准教授 森誠之 博士課程学生 オノ ー ポラット、他 4人
● 京都大学大学院理学研究科 生物物理学専攻 教授 杤尾豪人、研究員今村香代
● 京都大学大学院工学研究科 分子工学専攻 教授 白川昌宏 博士課程学生 宇野雅俊 他 1人
● 福岡大学医学部生理学 教授 井上隆司、 講師 市川順 他 1 人
● 千葉大学医学部腎臓内科 教授 淺沼克彦
● Rush 大学 医学部 教授 Jochen Reiser
● 京都大学 エネルギー理工学研究所 エネルギー利用過程研究部門 教授 森井孝
本研究は、主に日本学術振興会 科研費 (基盤研究 C、生理学一般)「チャネロパシーによるカルシウム制御破 綻とポドサイト機能連関」(代表者:森誠之)の支援を受けて行われました。
<研究者のコメント>
当初は CDI の制御機構を明らかにするための基礎研究をやっていました。しかし、徐々に機構が分かるにつ れ、単なるメカニズムの解明に留まらず、FSGS 病態発症の解明に繋がるかもしれないことが見えてきたとき は本当に驚きました。共著者を代表して、コメント、ご支援を頂いた皆様、そして研究室の皆様に心よりお礼 申し上げたいと思います。今後、治療に向けた研究も進められればと考えています。
<論文タイトルと著者>
タイトル:Contribution of coiled-coil assembly to Ca2+/Calmodulin-dependent inactivation of TRPC6 channel and its impacts on FSGS-associated phenotypes(CDI に対するコイルドコイルドメイン 重合の寄与と FSGS 関連表現型に対する意義) 著 者:Onur Kerem Polat、 Masatoshi Uno、 Terukazu Maruyama、 Ha Nam Tran、 Kayo Imamura、 Chee Fah Wong、 Reiko Sakaguchi、 Mariko Ariyoshi、 Kyohei Itsuki、 Jun Ichikawa、 Takashi Morii、 Masahiro Shirakawa、 Ryuji Inoue、 Katsuhiko Asanuma、 Jochen Reiser、 Hidehito Tochio、 Yasuo Mori、 and Masayuki X. Mori
掲 載 誌:Journal of American Society of Nephrology
DOI:https://doi.org/10.1681/ASN.2018070756