2019-07-23 京都大学iPS細胞研究所
ポイント
- 細胞内には、細胞種によって異なる活性を持つマイクロRNA(miRNA)注1が存在する。
- 抗CRISPR注2タンパク質の一つであるAcrllA4をmiRNAで制御し、ゲノムの編集を制御するシステム「miR-AcrllA4スイッチ」を開発した。
- 「miR-AcrllA4スイッチ」は、標的miRNAの活性が高いときに、標的の細胞内ゲノムを編集できるオンシステムである。
- 本スイッチを用いて、HeLa細胞注3で特異的に活性の高い細胞内miRNAを感知し、HeLa細胞のゲノムを編集することに成功した。
1. 要旨
弘澤萌研究員(CiRA未来生命科学開拓部門)、齊藤博英教授(同部門)らの研究グループは、miRNA依存的に標的細胞ゲノムの編集を誘導する技術を開発しました。
ゲノム編集技術の一つであるCRISPR-Cas9において、DNAを切断する酵素としてCas9注2が用いられます。近年、Cas9の機能を阻害する抗CRISPRタンパク質「AcrllA4」が発見され、ゲノム編集をより精密に制御できるツールとして注目されています。また細胞内には、細胞ごとに異なる活性を持つmiRNAが存在し、細胞を識別するマーカーとしての利用が期待されています。研究グループは、miRNAとAcrllA4を利用することで、標的細胞を識別し、Cas9の活性を選択的に誘導する手法を新たに開発しました。具体的には、標的細胞において標的miRNAに応答するAcrllA4をCRISPR-Cas9システムと共導入し、miRNAの活性が高い時にCas9を機能させることで、標的細胞のゲノムの編集を行うことに成功しました。
この研究成果は2019年7月3日に米国科学誌「ACS Synthetic Biology」でオンライン公開されました。
2. 研究の背景
近年注目されているゲノム編集技術のひとつにCRISPR-Casシステムがあります。以前、本グループは細胞特異的にゲノム編集を行うために「miR-Cas9スイッチ」を開発しました (参考「細胞種に応じてゲノム編集を制御する技術を開発」)。しかしこのシステムは、miRNAの活性が高いときにゲノム編集を起こらなくするもので、標的細胞を特異的に識別するために適したmiRNAを探すことが煩雑でした。またRNAからなる人工回路を用いることで、miRNAの活性が高い時にゲノムの編集を引き起こすことにも成功しました(参考「細胞の機能を精密に制御する人工回路をRNAで構築:ヒトの細胞で成功」)が、標的以外の細胞においてもCas9の活性がみられることがありました。これは非標的細胞においてもゲノムが編集される可能性を示唆しています。
そこで研究グループは、近年発見された、Cas9の機能を阻害するタンパク質であるAcrllA4に着目しました。このAcrllA4をmiRNAにより制御することで、miRNAの活性が高い時にのみゲノム編集を誘導できると考えられます。また、人工回路を用いたシステムは、Cas9の翻訳を制御しますが、本システムではCas9の翻訳後にその活性を制御するため、標的細胞以外の細胞でのCas9の活性をより精密に抑えられることが期待されます。
3. 研究結果
1. 細胞内miRNAの活性が高い時にゲノムを編集する技術を開発した
まず、グループはCas9の活性を抑制するタンパク質AcrllA4に着目しました。そして、このAcrllA4を作る配列を含むmRNA注4の5’非翻訳領域(5′-UTR)注5に特定のmiRNAを認識する配列を組み込み、miR-AcrllA4スイッチと名付けました(図1、上)。
本スイッチをmiRNAの活性が低い細胞に導入すると、AcrllA4が作られ、Cas9とガイドRNA注2の複合体に結合してゲノムの編集をできなくします。一方、miRNAの活性が高い細胞では、miRNAがそれを認識する配列と結合することにより、AcrllA4の合成が抑制され、AcrllA4が作られません。そのため、Cas9が機能してゲノム編集が行われます(図1、下)。つまり、特定のmiRNAの活性が低い非標的細胞ではゲノム編集が起きず(オフ)、miRNAの活性が高い標的細胞ではゲノム編集が起きます(オン)。
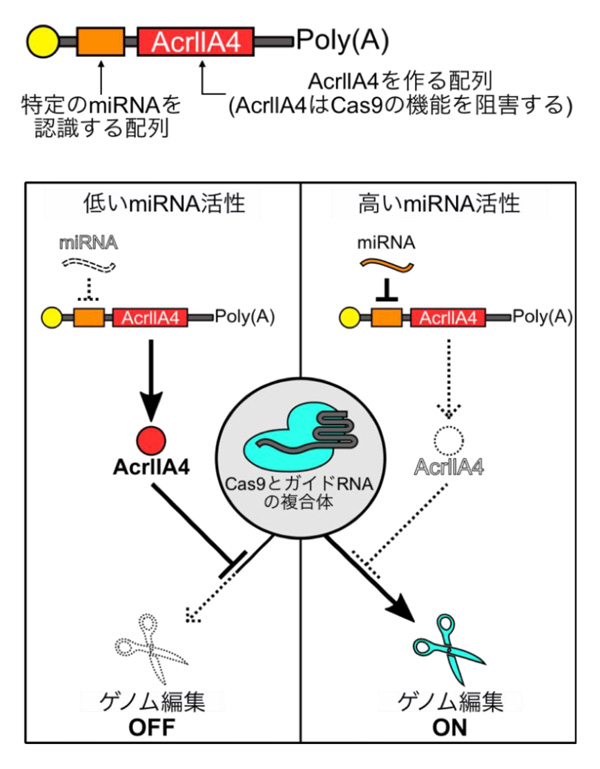
図1. miR-AcrllA4スイッチの構造(上)と働き(下)
2. 標的miRNAの活性が高い細胞で特異的にゲノム編集を実現した
次にグループは、標的とする細胞で本スイッチにてゲノムの編集を制御できるかを実験で調べるため、HeLa細胞で活性が高いmiRNA(miR-21)を検知するスイッチ(miR-21応答性AcrllA4スイッチ)、HeLa細胞では活性の低いmiRNA(miR-302a)を検知するスイッチ(miR-302a応答性AcrllA4スイッチ)、miRNAを感知する配列を持たない対照スイッチという3種類のスイッチを用意しました。
まず、HeLa細胞にmiR-21応答性 AcrllA4スイッチもしくは対照スイッチを、また、miR-21を阻害したHeLa細胞にmiR-21応答性 AcrllA4スイッチを導入し、AcrllA4の産生量を調べました。その結果、miR-21応答性AcrllA4スイッチのみの導入においてAcrllA4の産生が抑制されており、それがHeLa細胞内のmiR-21の活性に依存するものであることを確認しました(図2)。

図2. miR-21応答性 AcrllA4スイッチとmiR-21阻害剤をHeLa細胞に導入した。
HeLa細胞にmiR-21 AcrllA4スイッチを導入する(2と4)と、AcrllA4の産生が抑制され、バンドが検出されなかった(赤色で囲まれたところ)。(Mはマーカー)
1~4はそれぞれ下記をHeLa細胞内に導入している。
1: 対照スイッチ、2: miR-21応答性AcrllA4スイッチ、3: miR-21 応答性AcrllA4スイッチとmiR-21阻害剤、4: miR-21応答性AcrllA4スイッチとmiR-21阻害剤のネガティブコントロール
次に、緑色蛍光色素を作るEGFP遺伝子をゲノムに組み込んだHeLa細胞にmiR-21応答性 AcrllA4スイッチあるいは対照スイッチ、また、miR-21を阻害したHeLa細胞にmiR-21応答性 AcrllA4スイッチを導入し、72時間後にHeLa細胞の蛍光強度をフローサイトメトリー注6で計測しました。すると、miR-21応答性AcrllA4スイッチを導入したHeLa細胞では蛍光強度が低く、miR-21を阻害した上でmiR-21応答性AcrllA4スイッチを導入したHeLa細胞は高い蛍光強度を示しました(図3)。すなわち、miR-21に依存して、EGFP遺伝子を切断するゲノム編集が誘導されていることがわかりました。
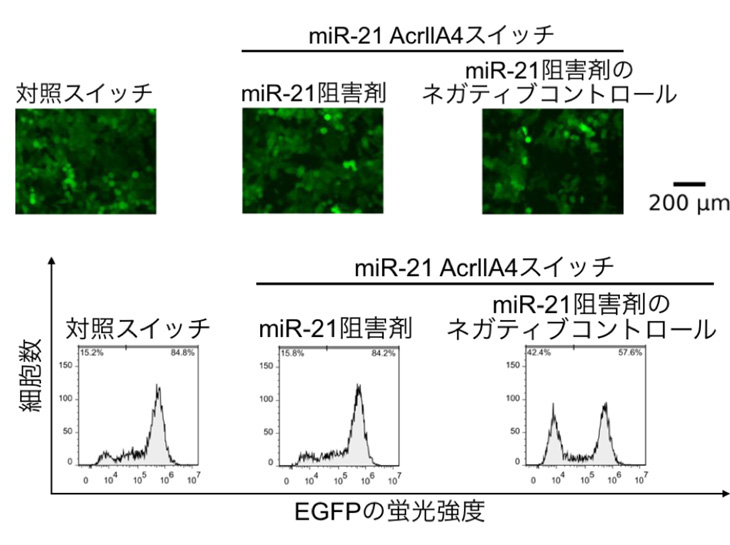
図3. HeLa細胞におけるmiR-21 AcrllA4応答性スイッチの働き
miR-21を阻害しないでHeLa細胞にmiR-21 AcrllA4応答性スイッチを導入する(右)と、AcrllA4が作られず、Cas9が機能してEGFP遺伝子が切断されるので蛍光強度が減少した。
また、HeLa細胞では本来活性の弱いmiR-302aを標的miRNAとして実験を行いました。具体的には、miR-302a応答性 AcrllA4応答性スイッチとmiR-302aの活性を模倣した人工miRNA (miR-302a mimic)を一緒にHeLa細胞に導入しました。すると、miR-302a mimicと、miR-302a AcrllA4応答性スイッチの両者を導入したHeLa細胞では蛍光強度が低く(ゲノム編集オン)、対照スイッチのみ、あるいはmiR-302a応答性 AcrllA4スイッチのみでは高い蛍光強度を示しました。
これらの結果より、本スイッチを用いることで、細胞特異的に活性の高いmiRNAを感知して、ゲノム編集を誘導できることが示されました。
最後に研究グループは、Cas9の切断活性をなくした変異体 (dCas9) に転写活性化因子 (VPR) を融合させたdCas9-VPRを用いることで、miRNAの活性の高い細胞において遺伝子発現の活性化を試みました。緑色蛍光色素を作るhmAG1遺伝子の発現がdCas9-VPRにより制御されるようにしたHeLa細胞に、miR-21 応答性AcrllA4スイッチあるいは対照スイッチ、またmiR-21を阻害したHeLa細胞にmiR-21応答性 AcrllA4スイッチを導入しました。すると、miR-21応答性 AcrllA4スイッチを導入したHeLa細胞では高い蛍光強度を示しましたが、対照スイッチを導入したHeLa細胞や、miR-21を阻害した上でmiR-21応答性 AcrllA4スイッチを導入したHeLa細胞では低い蛍光強度でした(図4)。この結果より本スイッチが、細胞種特異的に活性の高いmiRNAを感知し、遺伝子の切断だけでなく、遺伝子発現を誘導することも可能であることが示されました。
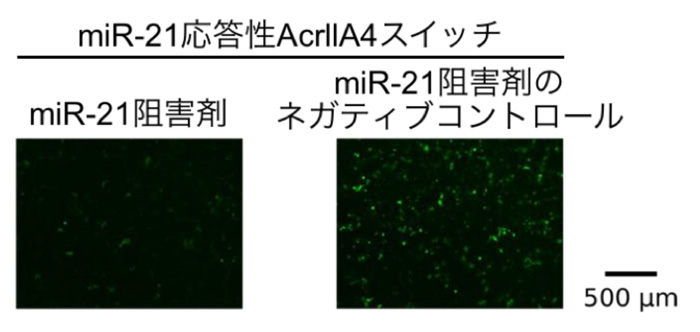
図4. HeLa細胞におけるmiR-21 応答性AcrllA4スイッチの働き
Cas9をdCas9-VPRという遺伝子活性化ができる変異体にしてmiR-21応答性 AcrllA4スイッチをHeLa細胞に導入した。miR-21を阻害しない場合(右)は、AcrllA4が作られず、dCas9-VPRが機能してhmAG1遺伝子の発現が誘導されることにより、蛍光強度が上昇した。
4. まとめ
本研究では、AcrllA4と細胞種により活性の異なるmiRNAを利用することで、標的miRNAの活性が高い細胞のゲノムを編集する技術を開発しました。また、これまでに開発した「miR-Cas9スイッチ」にあった問題点を改善することにも成功しました。より安全な遺伝子治療や創薬研究などに役立てるとともに、細胞特異的な遺伝子機能解析などの基礎研究での利用も期待できます。
5. 論文名と著者
- 論文名
Cell-type-specific CRISPR activation with microRNA-responsive AcrllA4 switch - ジャーナル名
ACS Synthetic Biology - 著者
Moe Hirosawa, Yoshihiko Fujita, and Hirohide Saito* - 著者の所属機関
- 著者の所属機関
- 京都大学iPS細胞研究所
*責任著者
6. 本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
- 日本学術振興会 科学研究費補助金 「基盤研究S」
- 公益財団法人 三菱財団
- 日本学術振興会 特別研究員制度
7. 用語説明
注1)マイクロRNA(miRNA)
20〜30塩基程度の長さの短いノンコーディング(タンパク質をコードしていない)RNA。相補的な配列を持つmRNA(メッセンジャーRNA)と結合して翻訳を抑制したり、mRNAを分解したりすることで、そのmRNAからのタンパク質の合成を抑制する働きをもつと考えられている。
注2) CRISPR
CRISPR:Clustered Regularly Interspaced Short Palindromic Repeatの略 細菌が持つウイルスに対する防御機構の一種。Cas9というDNA切断酵素と、切断させたい場所へとCas9を誘導するガイドRNAを使い、細菌に感染したウイルスのDNAを切断することで細菌をウイルス感染から守っている。ガイドRNAのターゲット配列を、細菌ウイルスではなく任意のヒトゲノム配列に変えてやることで、ヒト細胞内においてゲノム上の一箇所を見つけ出し、そこのDNAだけを特異的に切断することができる。
注3) HeLa(ヒーラ)細胞
ヒト由来の最初の細胞株。ヒト子宮頸がんから分離され株化された細胞で、世界中で広く利用されている細胞の1つ。
注4) mRNA
メッセンジャー(伝令)RNAのこと。DNA上の遺伝子情報はmRNAに転写された後、mRNAからタンパク質となり(翻訳され)、細胞内で機能する。
注5) 5’非翻訳領域(5′-UTR)
mRNA のうち、アミノ酸をコードする領域の上流(5’側)にあり、タンパク質に翻訳されない領域。
注6)フローサイトメトリー
流動細胞計測法。レーザー光を用いて光散乱や蛍光測定を行うことにより、水流の中を通過する単一細胞の大きさ、DNA量など、細胞の生物学的特徴を解析することができる。