近赤外線を用いて非侵襲的に神経細胞の活動を制御する
2018-02-09 理化学研究所
要旨
光遺伝学は、光で活性化されるイオンチャネル[3]やイオンポンプ[4]を神経細胞に発現させ、青色光や緑色光を照射することで、その神経細胞の活動を活性化したり抑制したりする技術で、近年の脳科学の進展に大きく貢献してきました。しかし、青色光や緑色光は脳組織を透過する際に減衰するため、脳深部の神経細胞の制御には、光ファイバーを脳組織に挿入する必要があります。そのため、ファイバー挿入による脳組織の損傷が避けられないという問題がありました。
今回、国際共同研究グループは、低エネルギーの近赤外線[5]を吸収し、高エネルギーの青色光や緑色光を放出するUCNPに着目しました。近赤外線は生体透過性が高く、体表に照射すると体の深部まで到達します。また、生体への影響はほとんどありません。国際共同研究グループはまず、ウイルスベクター[6]を用いて光活性型イオンチャネルであるチャネルロドプシン2(ChR2)[3]をマウス脳の特定領域に発現させ、同じ領域に青色光放出UCNPを注入しました。その後、頭上から近赤外線を照射すると、脳深部で近赤外線はUCNPにより青色光に変換され、近くの神経細胞のChR2を活性化し、その神経細胞の活動を活性化しました。また、同じ手法を使って、マウスの脳内で記憶を保持している海馬[7]の神経細胞を、脳組織を損傷させることなく活性化し、人為的に記憶を思い出させることに成功しました。さらに、近赤外線を緑色光に変換するUCNPを作製し、神経細胞の活動を抑える光活性型イオンポンプのアーキロドプシン3(Arch)[4]と組み合わせて、非侵襲的に脳深部の神経細胞の活動を抑制する方法も開発しました。
現在、精神疾患の治療などに用いられている経頭蓋磁気刺激法[8]は、活性化させる神経細胞を特定できません。今回、開発したUCNPを用いた非侵襲的光遺伝学法を応用することによって、標的の神経細胞だけを対象にした、より効率的で副作用の少ない治療法の開発が進むと期待できます。
本研究は、米国の科学雑誌『Science』(2月9日号)に掲載されるのに先立ち、オンライン版(2月8日付け:日本時間2月9日)に掲載されます。
※国際共同研究グループ
理化学研究所 神経回路・行動生理学研究チーム
チームリーダー トーマス・マックヒュー(Thomas J. McHugh)
基礎科学特別研究員 陳 碩 (シュオ・チェン)
研究支援パートタイマーアダム・ザカリー・ワイテマイヤー(Adam Zachary Weitemier)
研修生 何 林孟 (カ・リンモン)
研修生 王 希宇 (オウ・キウ)
研修生(研究当時) 陶 硯楸 (エンチュウ・トオ)
テクニカルスタッフI アーサー・ファン (Arthur J.Y. Huang)
東京大学大学院 医学系研究科
神経生理学
教授 狩野 方伸 (かのう まさのぶ)
助教 橋本谷 祐輝 (はしもとだに ゆうき)
神経細胞生物学
教授 岡部 繁男 (おかべ しげお)
講師 岩崎 広英 (いわさき ひろひで)
日本学術振興会外国人特別研究員(研究当時) ラクシミ・クマール・パラジュリ(Laxmi Kumar Prajuli)
慶應義塾大学 医学部 精神神経科学教室
准教授 田中 謙二 (たなか けんじ)
研究員 木村 生 (きむら いく)
シンガポール国立大学 化学科
准教授 シャオガン・リウ (Xiaogang Liu)(シンガポール科学技術研究庁 材料工学研究所)
博士課程 シャオ・ゼン (Xiao Zeng)
神経工学研究所
研究員 ダニエル・ローング・ティ(Daniel B Loong The)
ジョンホプキンス大学 医学部 生体医用工学科
准教授 アンジェロ・オール(Angelo H All)
背景
近年、脳科学は目覚ましい進歩を遂げており、記憶や情動といった機能を担う脳内回路の働きが次々と明らかになっています。その背景には、「光遺伝学」に代表される神経細胞の活動を制御する新しい技術があります。
光遺伝学は、光で活性化されるイオンチャネルやイオンポンプといったタンパク質を神経細胞に発現させ、青色光や緑色光を照射することで、その神経細胞の活動を活性化したり抑制したりする技術です。この技術により、特定の神経細胞の働きと動物の行動との因果関係を調べることができます。一方、いくつかの課題も残されています。例えば、青色や緑色の光は脳組織を透過する際に減衰してしまうため、脳深部の神経細胞を制御するには、脳内に光ファイバーを挿入する必要があります。従来法ではファイバー挿入による脳組織の損傷が避けられません。
生体を傷つけずに特定の神経細胞の働きを制御できる技術を開発するため、国際共同研究グループは、低エネルギーの近赤外線を吸収し高エネルギーの青色や緑色の光を放出する、「アップコンバージョン-ナノ粒子(UCNP)」に着目しました。近赤外線は生体透過性が高く、体表に照射するだけで体の深部まで到達します。また、生体への影響はほとんどありません。国際共同研究グループは、UCNPを光活性型イオンチャネルであるチャネルロドプシン2(ChR2)、光活性型イオンポンプであるアーキロドプシン3(Arch)と組み合わせることで、生体への損傷を最小限に留める新しい非侵襲的光遺伝学技術の開発を試みました。
研究手法と成果
国際共同研究グループはまず、近赤外線を吸収し青色光や緑色光を放出するランタノイド[9]添加UCNPを作製しました。神経活動の活性化のために、ツリウムイオン(Tm3+)とイッテルビウムイオン(Yb3+)を組み合わせ、ChR2が最も効率よく吸収する青色光を放出するUCNPとしました(図1A)。また神経活動の抑制には、Yb3+とエルビウムイオン(Er3+)を組み合わせ、Archが最も効率よく吸収する緑色光を放出するUCNPとしました(図1B)。
いずれも外側には、溶剤によりアップコンバージョンが抑制されるのを防ぐために、光学的に不活性なNaYFO4(Na:ナトリウム、Y:イットリウム、F:フッ素、O:酸素)の殻層を作り、さらにその外側をシリカ(SiO2)でコーティングして安定性を確保しました。作製したUCNPは、直径90ナノメートル(nm、1nmは10億分の1メートル)程度の大きさになりました。
実際に、青色光放出UCNPに980nmの近赤外線を当てると、450~475nmをピークとする青色光を放出することが確かめられました。また、マウス脳の頭蓋から4.2mmの位置にある腹側被蓋野(VTA)[10]という領域に青色光放出UCPNを注入して、頭上から近赤外線を当てたところ、ChR2を活性化させるのに十分な強度の青色光が検出できました。
脳の深部組織に近赤外線を到達させるには、その強度を上げる必要がありますが、それは同時に組織の温度を上昇させる可能性があります。しかし、マウス脳の深部組織に、UCPNの光転換を起こすのに必要な量の近赤外線照射をしても、組織に損傷を与えるような温度上昇は起こらないことが分かりました。また、シリカコーティングのUCPNは細胞毒性を示しませんでした。
そこで、マウス生体の脳内で、UCPNを用いた光遺伝学が可能かを調べました。まず、アデノ随伴ウイルスベクター[6]を用いて、マウス脳内VTA領域のドーパミン神経細胞[11]にChR2タンパク質を発現させ、4週間後に青色光放出UCNPを同じVTA領域へ注入しました。このマウス脳を取り出して作製したスライス標本に、980nmの近赤外線を当てると、VTA領域のドーパミン神経細胞の活動がみられました。また、この標本を電子顕微鏡[12]で観察したところ、UCNPのほとんどはシナプス間隙や細胞膜近くの細胞外の空間に分布しており、神経細胞に直接影響を与えないことが分かりました。
次に、この技術を生きているマウスに適用しました。アデノ随伴ベクターを用いて脳のVTA領域にChR2タンパク質を発現させ、その4週間後に青色光放出UCNPを注入したマウスを用意しました。このマウスの頭上から近赤外線を当て、線条体[13]という別の脳領域で放出される神経伝達物質ドーパミンの量を調べました(図2左)。その結果、近赤外線の照射に合わせて、線条体でドーパミンが放出されることが分かりました(図2右)。このことは、近赤外線と青色光放出UCNPを用いた非侵襲的な光遺伝学法により、生きた動物で効果的に神経細胞の活動の活性化が起こることを示しています。
続いて、緑色光放出UCNPとArchを組み合わせ、神経細胞の活動を抑制できるかを調べしました。麻酔下のマウスにカイニン酸[14]を投与すると、神経活動が過剰に活性化され、マウスはてんかん性発作を起こします。そこで、あらかじめ海馬の神経細胞の同期的活動に影響を与える内側中隔核[15]という領域にArchタンパク質を発現させ、緑色光放出UCNPを注入したマウスで、同じようにてんかん性発作を誘導しました。このマウスに近赤外線を照射したところ、てんかん性発作が治まりました。このことは、近赤外線と緑色光放出UCNPを用いた非侵襲的な光遺伝学法により、生きた動物で効果的に神経細胞の活動を抑制できることを示しています。
最後に、近赤外線とUCNPを用いた非侵襲的な光遺伝学法を用いて、生きたマウスの行動の変化を誘導できるかを調べました。海馬には、記憶を保持する「エングラム細胞[16]」と呼ばれる細胞が存在します。エングラム細胞でのみChR2タンパク質を発現する遺伝子改変マウスの海馬に、青色光放出UCNPを注入しました。このマウスを箱の中に入れ、軽い電気ショックを脚に与えました。すると、マウスは箱と嫌な体験を結びつけた恐怖記憶を保持する記憶エングラム細胞を形成し、同じ箱に入れるとその記憶を思い出してすくみました。しかし別の箱に入れると、その箱は嫌な体験とは結びついていないため、恐怖記憶は思い出されずすくみませんでした(図3A)。
ところが、マウスの頭上から近赤外線を照射して、恐怖の記憶エングラムを活性化させると、マウスは安全なはずの箱に入れられていてもすくむことが分かりました(図3B)。このことは、近赤外線とUCNPを用いた非侵襲的な光遺伝学法を用いれば、生きた動物の行動変化を誘導できることを示しています。
今後の期待
近年の脳科学の進歩により、脳内にあるさまざまな神経回路の働きが、私たちの行動や思考を担っていることが分かりつつあります。また、こうした神経回路の異常や破綻により、多くの精神疾患が引き起こされることも明らかになっています。
そこで、神経回路を構成する神経細胞の働きを活性化したり抑制したりすることで、こうした疾患を治療する試みが始まっています。経頭蓋磁気刺激法とよばれる技術は、頭蓋の上から非侵襲的に神経細胞の活動をある程度制御することが可能で、一部のケースにおいて精神疾患の治療に用いられています。一方、活性化したい神経細胞を特定できず、標的領域の周辺組織にも影響が出るという欠点があります。
今回国際研究チームが開発した近赤外線とUCNPを用いた非侵襲的な光遺伝学法を用いれば、生体に損傷を与えずに、ある特定の神経細胞だけを活性化したり抑制したりすることができ、精神疾患の新しい有効な治療法につながると期待できます。
原論文情報
Shuo Chen,Adam Z Weitemier,Xiao Zeng, Linmeng He, Xiyu Wang, Yanqiu Tao, Arthur JY Huang, Yuki Hashimotodani, Masanobu Kano, Hirohide Iwasaki, Laxmi Kumar Parajuli, Shigeo Okabe, Daniel B Loong Teh, Angelo H All, Iku Tsutsui-Kimura, Kenji F Tanaka, Xiaogang Liu and Thomas J McHugh, “Near-infrared Deep Brain Stimulation via Upconversion Nanoparticle-mediated Optogenetics.”, Science, doi: 10.1126/science.aaq1144
発表者
理化学研究所
脳科学総合研究センター 神経回路・行動生理学研究チーム
チームリーダー トーマス・マックヒュー (Thomas J. McHugh)
基礎科学特別研究員 陳 碩 (シュオ・チェン)
報道担当
理化学研究所 広報室 報道担当
産業利用に関するお問い合わせ
理化学研究所 産業連携本部 連携推進部
補足説明
-
- アップコンバージョン-ナノ粒子(UCNP)
- 長波長の光を短波長の光に変換すること(アップコンバージョン)のできるナノ粒子。
-
- 非侵襲的
- 皮膚も含めて生体に傷やダメージを与えないことを非侵襲的という。一方、生体に傷やダメージを与えることを侵襲的という。
-
- イオンチャネル、チャネルロドプシン2(ChR2)
- 生体内では細胞の内外にさまざまなイオンが存在するが、その濃度は細胞の内外で差がある。細胞膜などの生体膜上にあり、細胞の内外のイオンの濃度差を調節する分子のうち、イオンを濃度勾配に従って透過させるものをイオンチャネルという。光遺伝学で用いる光活性化型イオンチャネル、チャネルロドプシン2(ChR2)が青色光で活性化されると、細胞外から細胞内へNa+やCa2+などの陽イオンを透過する作用により膜電位が生じて、神経細胞が活性化する。
-
- イオンポンプ、アーキロドプシン3(Arch)
- 細胞膜などの生体膜上にあり、細胞の内外のイオンの濃度差を調節する分子のうち、イオンを濃度勾配に逆らって透過させるものをイオンポンプという。光活性化型イオンポンプであるアーキロドプシン3(Arch)が緑色光で活性化されると、細胞内から細胞外にH+をくみ出す作用により活動電位が生じにくくなり、神経細胞の活動が抑制される。
-
- 近赤外線
- 可視光の赤色よりも波長が長く、電波より波長の短い電磁波である赤外線のうち、波長が0.7~2.5マイクロメートル(μm、1μmは100万分の1メートル)のもの。可視光線に近い特性を持ち、赤外線カメラや赤外線通信、家電用のリモコンなどに応用されている。
-
- ウイルスベクター、アデノ随伴ウイルスベクター
- 遺伝子工学における任意の遺伝子を生体に運ぶための運び屋(ベクター)のうち、ウイルスを用いたものをウイルスベクターという。任意の遺伝子の組み替えウイルスが特定の細胞に感染する際に、任意の遺伝子がその細胞で働くようになる。アデノ随伴ウイルスベクターは、アデノ随伴ウイルスを用いたウイルスベクター。
-
- 海馬
- 側頭葉に位置し、記憶の書き込み、貯蔵、想起に重要な役割を果たす脳領域。
-
- 経頭蓋磁気刺激法
- 頭蓋骨の外側から磁気により刺激し、弱い電流を脳組織内に誘導して脳内の神経細胞を興奮させる非侵襲的な刺激方法。
-
- ランタノイド
- 周期表第6周期第3族の原子番号57から71までの15元素(La、Ce、Pr、Nd、Pm、Sm、Eu、Gd、Tb、Dy、Ho、Er、Tm、Yb、Lu)の総称。
-
- 腹側被蓋野(VTA)
- 脳幹に位置する中脳の領域の一つで、ドーパミン神経細胞が豊富に存在する。
-
- ドーパミン神経細胞
- 神経伝達物質のドーパミンを産生、放出する神経細胞。脳内のドーパミンは主に脳幹の腹側被蓋野と黒質緻密部という2つの領域にかたまって存在し、そこから脳のさまざまな領域に連絡してドーパミンを放出している。
-
- 電子顕微鏡
- 観察したい対象物に電子線を当てて拡大し観察する顕微鏡。光学顕微鏡では見ることのできない100ナノメートル(nm、1nmは10億分の1メートル)以下の物体の観察に適している。
-
- 線条体
- 大脳基底核の主要構成要素の一つで、被殻と尾状核から成る。神経回路における大脳皮質からの入力を担い、運動機能、学習や記憶などさまざまな機能に関与する。
-
- カイニン酸
- 海藻から分離された天然化合物。興奮性神経細胞で働くAMPA型グルタミン酸受容体やカイニン酸受容体に結合し活性化するため、この化合物を脳に投与すると、神経活動の過剰な活性化によりてんかん様の発作を起こす。
-
- 内側中隔核
- 大脳辺縁系の一部で、大脳半球の内側の左右の側脳室の間に位置する小さな領域。海馬と情報をやり取りしており、特に海馬における神経細胞の同期的活動を制御すると考えられている。
-
- エングラム細胞
- ヒトや動物の脳内ある記憶の痕跡を支える細胞。この神経細胞の活動パターンやそのつながりによって、記憶が維持されていると考えられている。
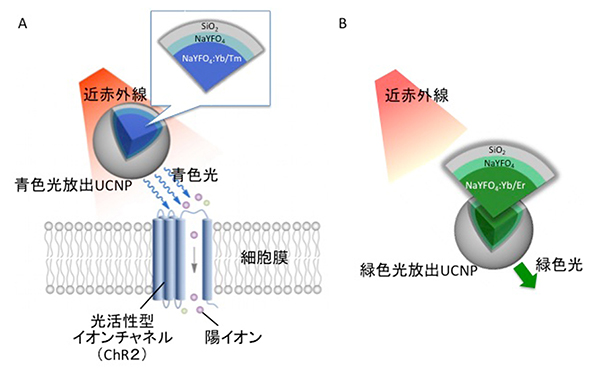
図1 アップコンバージョン-ナノ粒子(UCNP)
B) 緑色光放出UCNP。基本構造は青色光放出UCNPと同じ。近赤外線を吸収し、神経細胞の働きを抑制する陽イオンポンプ、アーキロドプシン3(Arch)と組み合わせることで、非侵襲的に神経細胞の働きを抑えることができる。
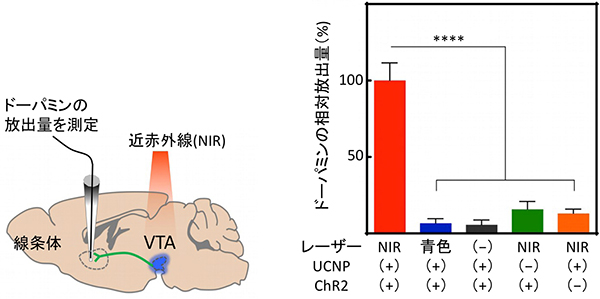
図2 青色放出UCNPを用いた光遺伝学によるドーパミン神経細胞の活性化
右) ドーパミン放出量の結果を示すグラフ。 VTA領域のドーパミン神経細胞にChR2が発現し、かつUCNPが存在するとき、近赤外線(NIR)を照射するとドーパミンの放出がみられた(赤)。照射するレーザーが青色の場合(青)や、何も照射しない場合(黒)では、ドーパミン放出はほとんどみられなかった。また近赤外線を照射しても、UCNPやChR2がない場合はドーパミン放出がみられなかった(緑、橙)。
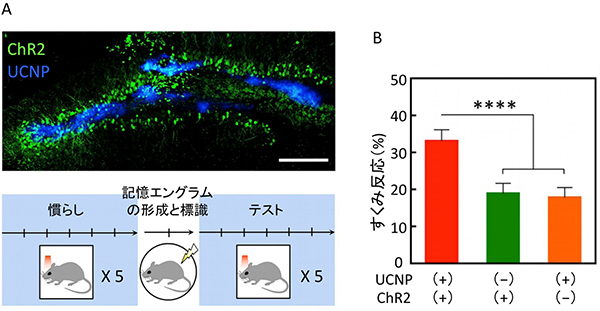
図3 青色光放出UCNPを用いた光遺伝学による記憶エングラムの活性化
B) ChR2の発現とUCNP 注入の有無によるマウスのすくみ反応時間の割合を示したグラフ。ChR2を発現し、UCNPを注入されたマウスは、近赤外線の照射に対し、安全な箱でもすくみ反応を示した(赤)。これに対し、ChR2を発現しない場合(緑)やUCNPを注入しない場合(橙)は、すくみ反応が小さかった。このことは、UCNPを用いた光遺伝学によって恐怖の記憶エングラムが活性化し、すくみ反応が誘導されたことを示している。