がん細胞のPD-L1/L2が、トロゴサイトーシスを駆使してがんを支持する単球/マクロファージへ受け渡される
2020-02-24 東海大学,日本医療研究開発機構
ポイント
- 古典的ホジキンリンパ腫(CHL)(注1)において、がん細胞(ホジキン細胞)から周りの単球・腫瘍関連マクロファージ(TAMs)(注2)へ、がん細胞の細胞膜にあるPD-L1/L2(注3)が受け渡されるトロゴサイトーシス(注4)という巧妙な現象が生じていることが明らかになりました。
- CHLの患者検体を用いた検討で、がん細胞と接触するTAMsのPD-L1/L2の発現は、がん細胞との接触がないTAMsと比べ高く、トロゴサイトーシスによるPD-L1/L2の移行が患者でも起こることが示唆されました。TAMsのPD-L1/L2増強はがん生存に有利な環境の形成に繋がります。CHLは抗PD-1抗体が非常によく効きますが、今回発見したトロゴサイトーシスがその理由の一因を説明し得ると考えられました。
- 今回の発見を更に発展して研究することで、周囲の免疫細胞ががんに及ぼす病態解明や、がん細胞と単球・TAMsの直接的な接触の阻害を狙った新たな治療法の開発に繋がり得ると期待されます。
背景
古典的ホジキンリンパ腫(CHL)は、血液の成分の1種であるリンパ球ががん化した病気の悪性リンパ腫の一つで、典型的には全身のリンパ節にしこりとして現れて発症します。CHLはがん組織中でのホジキン細胞の割合が全体の1%のみで、その周りにあるさまざまな免疫細胞ががん細胞を支持する環境(がん微小環境)(注5)が重要であるという特徴を持っています。CHLは抗PD-1抗体の奏効率が65~87%(多くの固形癌では奏効率20-30%程度)と特に効きやすいことからも、がん細胞の周りの免疫細胞の重要性は裏付けられます。CHLはPD-L1が腫瘍で多く発現しているものの、他にもPD-L1が高発現する癌腫はあるためこれだけでは抗PD-1抗体が著効する事実の全てを説明することはできません。CHLでホジキン細胞の周囲にはPD-1陽性T細胞も群がって集まり、ホジキン細胞だけでなく単球/腫瘍関連マクロファージ(TAMs)にもPD-L1が発現するため、ホジキン細胞のみならず、単球/TAMsもT細胞の抑制に働くと考えられ、その機序が重要と考えられてきました。しかし、この機序は不明な点が多く検討課題でした。
またホジキン細胞はしばしば周囲の免疫細胞と接触していますが、直接的な接触の意義は明らかでありませんでした。CHLにおける単球/TAMsは多いほど予後不良であることが知られておりその重要性が示唆されていました。そこで本研究ではホジキン細胞と単球・TAMsに注目し、両者の直接的な接触がPD-1/PD-L1・L2系に与える影響の解明に成功しました。
概要
東海大学医学部先端医療科学の川島 雅晴(東京慈恵会医科大学腫瘍・血液内科)大学院生、幸谷 愛教授、東海大学病理学カレーラス・エステバン・ジュアキム講師、中村 直哉教授らの研究グループは、先にB型肝炎ウイルス研究においてHBV肝炎においては、免疫細胞が肝臓に集まり、炎症を引き起こしているにもかかわらず、HBV感染肝細胞が排除されず、炎症が持続するメカニズムを研究しました。その過程で、HBV感染肝細胞が細胞外小胞という物質を使って単球/マクロファージにPD-L1を発現させることが、炎症の持続に重要であることを明らかにしました。この研究結果をヒントに、ホジキンリンパ腫における単球/マクロファージのPD-L1/L2に注目し、本研究ではホジキン細胞との直接的な接触が単球/TAMsのPD-L1/L2に与える影響について、先ずホジキン細胞株(L-1236、L-591、L-428)と正常人の単球とを用いて検証しました。単球とホジキン細胞株の共培養後に単球のPD-L1/L2が上昇するかを解析したところ、わずか1時間という短時間に単球のPD-L1/L2が増強することが分かりました(図1)。
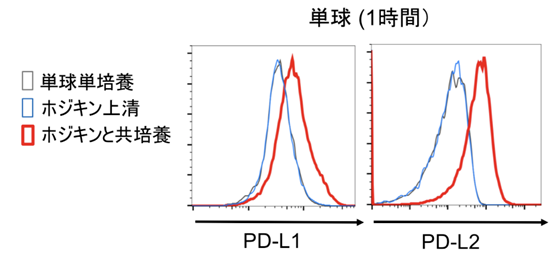
図1:ホジキン細胞と直接的に接触する単球のPD-1/L2は迅速に上昇する。単球とホジキン細胞株のL-1236を共培養した際に、共培養1時間後の単球のPD-L1/L2は上昇した(赤)。単球にL-1236の上清をかけたもの(青)では上昇しなかった。
そこで、単球のPD-L1/L2の増強が短時間での上昇であったことから、トロゴサイトーシスと呼ばれる直接的な接触を介した膜移動の現象に注目しました。試験管内で単球とホジキン細胞株の細胞膜を染め分けて共培養したところ、ホジキン細胞株から単球へ膜移動が見られ、またPD-L1/L2が単球に細胞膜と共に移動する像が顕微鏡で確認された(図2)ことから、トロゴサイトーシスによるPD-L1/L2の膜移動が実際に生じていることが分かりました。
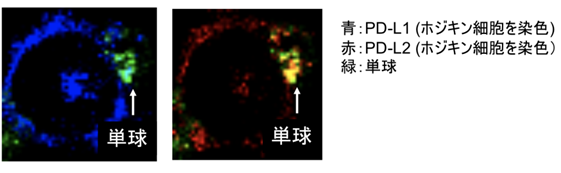
図2: PD-L1/L2はホジキン細胞から単球へ受け渡される。
ホジキン細胞株(L-1236)を染色したPD-L1/L2が、単球上に移動する像が見られた。
次にトロゴサイトーシスによるPD-L1/L2の膜移動が、図1で確認した単球のPD-L1/L2上昇につながるかを検証するため、CRISPR-Cas9(注6)を用いて、ホジキン細胞株のPD-L1/L2を欠損させました。このPD-L1/L2ノックアウト(KO)ホジキン細胞株と単球を共培養すると、膜移動するPD-L1/L2がなくなるため、単球のPD-L1/L2は上昇しなくなることが確認できました(図3)。以上から、ホジキン細胞株から単球へのトロゴサイトーシスにより、単球のPD-L1/L2が迅速に上昇することが証明されました。加えて、ホジキン細胞株から単球に移ったPD-L1がT細胞に抑制的に働くかどうかも検証し、試験管内では単球に移ったPD-L1がT細胞の機能を抑制する効果を獲得することも示しました。
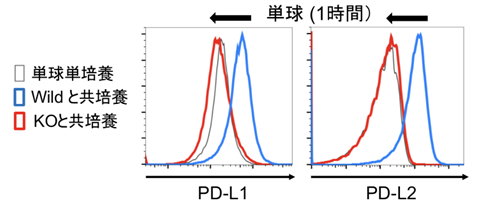
図3:迅速な単球のPD-L1/L2発現の上昇は、ホジキン細胞からのトロゴサイトーシスにより生じた。単球とホジキンPD-L1/L2 ノックアウト(KO)細胞の共培養(赤)では、ホジキンコントロール(Wild)細胞を共培養した際に上昇したPD-L1/L2 (青)がキャンセルされた。
更に、実際にCHL患者でトロゴサイトーシスが生じるかを検証するため、東海大学内の患者の病理検体38例を免疫染色により解析しました。ホジキン細胞と接触するTAMsのPD-L1/L2の発現と、非接触のPD-L1/L2の発現を比較しました。ホジキン細胞と接触するTAMsは非接触のTAMsと比べてPD-L1/L2ともに染色割合が高いことが明らかになり(図4)、CHL患者でトロゴサイトーシスが生じることが示唆されました。
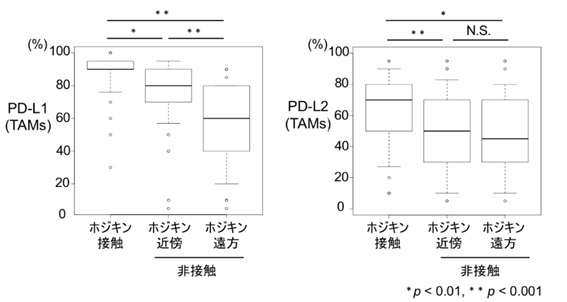
図4:がん細胞からTAMsへのPD-L1/L2の受け渡しが、患者でも起こることが示唆された。CHL患者」(N=38)において、ホジキン細胞に接触したTAMsは非接触のTAMsと比べて、 PD-L1/L2が上昇していた。
今後の展開
本研究の成果から、PD-L1/L2がトロゴサイトーシスによりホジキン細胞から周囲のTAMsに移ることが明らかになりました。特にCHLではPD-1陽性CD4陽性T細胞(注7)ががん細胞周囲に多いことが知られています。抗原提示細胞(注8)であるTAMsは主要組織適合抗原(MHC)(注9)分子を介してPD-1陽性のCD8陽性T細胞のみならず、CD4陽性 T細胞の免疫抑制にも働くため、トロゴサイトーシスによるTAMsのPD-L1/L2上昇が、がん微小環境の形成に重要な役割を果たしていることが示唆されました(図5)。今回の結果はCHLにおいて抗PD-1抗体の効果が高い理由の一つとして説明することができ、がん細胞とTAMsの直接的な接触を阻害することが有望な治療となり得ることが示されました。また、CHLにおいてがん細胞周囲に集まる他の免疫細胞や分子においても、トロゴサイトーシスが生じてがん微小環境に及ぼす意義があるか検証することは、今後の課題です。またがんのみならず、現在研究を行なっているB型肝炎の制御法開発においても、肝炎感染細胞が周りの細胞との直接的な接触を介して生存に有利な環境を形成している可能性はあり、検討すべき課題です。
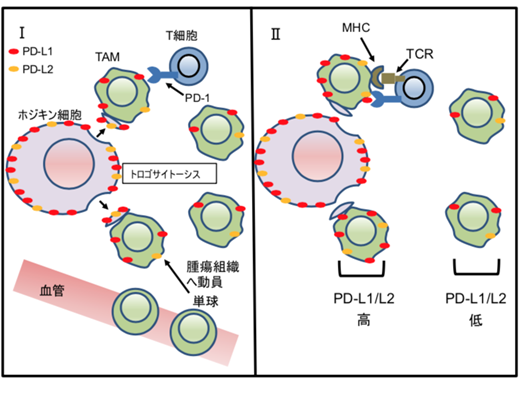
図5:今回明らかとなった古典的ホジキンリンパ腫のがん微小環境の模式図。
Ⅰ.腫瘍組織中へ動員されたTAMsはホジキン細胞からのトロゴサイトーシスによりPD-L1/L2 が迅速に上昇する。
Ⅱ. PD-L1/L2 が上昇したTAMsは、PD-1/ PD-L1、L2シグナルを介し腫瘍周囲に群がって集まるT細胞の機能抑制に働く。
用語
- (注1)古典的ホジキンリンパ腫(CHL: classical Hodgkin Lymphoma)
- 悪性リンパ腫の一種であり、日本では悪性リンパ腫の5~10%程度を占める。病理組織中にホジキン(Hodgkin/Reed-Sternberg)細胞という大型な単核/2核の細胞を認めるのが特徴である。
- (注2)腫瘍関連マクロファージ(TAMs: tumor-associated macrophages)
- 腫瘍組織に浸潤・集積するマクロファージで、免疫抑制的に働き腫瘍形成を促進する。これまでの研究から腫瘍マウスモデルでTAMsのPD-L1発現が活性化T細胞を抑制して、腫瘍促進に関わることも明らかになっている。
- (注3)PD-1/PD-L1, L2チェックポイント・シグナル伝達
- PD-1(programmed cell death-1)受容体は活性化T細胞の表面、一方PD-1のリガンドのPD-L1、PD-L2は一部の癌細胞、抗原提示細胞の表面上に発現する。T細胞の応答に抑制的に働く免疫チェックポイント・タンパク質である。PD-1/PD-L1, L2のチェックポイント阻害ががん治療に非常に有望なことは、抗PD-1抗体の登場で明らかになった。
- (注4)トロゴサイトーシス
- トロゴ(trogo-)は古代ギリシャ語源で「かじる」に相当し、ある細胞が別の細胞上のタンパク質を膜ごと奪い取る現象である。癌細胞から免疫細胞へ起こることはこれまで報告されているが、その意義はあまり分かっておらず今後の検証課題である。
- (注5)がん微小環境
- がん組織の中で形成される免疫から逃れるためのネットワークのことを指す。がん細胞は生存に有利となるための環境を、元々患者に存在するさまざま免疫細胞を免疫抑制的に促すことで、がんの局所で形成していく。
- (注6)CRISPR-Cas9
- DNA2本鎖を切断してゲノム配列の任意の場所の削除・置換・挿入を可能にした、遺伝子編集技術である。
- (注7)CD4陽性T細胞
- リンパ球の1種であるT細胞は、CD4陽性T細胞(ヘルパーT細胞)とCD8陽性T細胞(細胞傷害性T細胞)に大別される。CD4陽性T細胞の主な役割はCD8陽性T細胞など他の免疫系細胞にシグナルを送ることで、身体を病原体から守る役割を果たす。抗PD-1抗体はPD-1/PD-L1・L2系の免疫抑制を解除することでCD8陽性T細胞の活性を促し、がん細胞を攻撃することが知られている。一方、CD4陽性T細胞はCD8陽性T細胞の活性化を促すため、抗PD-1抗体によるCD4陽性T細胞のPD-1/PD-L1・L2系解除は、結果としてがん細胞の殺傷に繋がると考えられる。
- (注8)抗原提示細胞(APC: antigen-presenting cell)
- 体内に侵入した感染細胞などの断片を抗原として自己の細胞表面上に提示し、T細胞を活性化する細胞である。APCは細胞表面上に主要組織適合抗原 (MHC、注9参照)を持ち、ここに抗原をのせて提示する。抗原提示を行うことで、免疫反応が促されてがんの排除に働く。
- (注9)主要組織適合抗原
- 免疫反応に必要な多くのタンパクの遺伝子情報を内在する細胞膜の表面にある分子。体内のほとんどの有核細胞はMHCクラスⅠ分子を持ち、CD8陽性T細胞に抗原提示するが、APCはMHCクラスⅡ分子も持っており、これを介してCD4陽性T細胞への抗原提示を行える。
論文情報
- タイトル
- PD-L1/L2 protein levels rapidly increase on monocytes via trogocytosis from tumor cells in classical Hodgkin lymphoma
- 著者名
- Masaharu Kawashima, Joaquim Carreras, Hiroshi Higuchi, Ryutaro Kotaki, Takahiro Hoshina, Kazuki Okuyama, Naoto Suzuki, Masatoshi Kakizaki, Yuji Miyatake, Kiyoshi Ando, Masafumi Nakayama, Shinjiro Umezu, Ryouichi Horie, Yuriko Higuchi, Koko Katagiri, Susumu Goyama, Toshio Kitamura, Kenji Chamoto, Shingo Yano, Naoya Nakamura, and Ai Kotani
- 雑誌名
- Leukemia
本研究は
東京慈恵会医科大学大学院研究助成金
「研究課題名:腫瘍と単球の直接接触阻害により、単球のPD-L1/L2チェックポイント阻害を促す新規免疫治療の試み」(研究者名:川島 雅晴)
国立研究開発法人日本医療研究開発機構(AMED)の肝炎等克服緊急対策研究事業「B型肝炎に関する病態生理の新たな解明に基づく制御法開発 (研究開発代表者:大塚 基之)」における分担研究開発課題「RNAを起点としたcccDNA制御と核酸アナログの安全な中止を目指した基礎的検討」(研究開発担当者:幸谷 愛、課題番号:19fk0210054s0201)、
革新的先端研究開発支援事業(PRIME) ソロタイプ「画期的医薬品等の創出をめざす脂質の生理活性と機能の解明」研究開発領域(研究開発総括:横山 信治)における研究開発課題「炎症がん由来エクソソームにおける脂質の役割」(研究開発担当者:幸谷 愛)、
国立研究開発法人科学技術振興機構(CREST)の戦略的創造研究推進事業「細胞外微粒子に起因する生命現象の解明とその制御に向けた基盤技術の創出」(研究開発代表者:渡邉力也)における研究開発課題「細胞外微粒子の1粒子解析技術の開発を基盤とした高次生命科学の新展開」(研究開発分担者:幸谷 愛)、
上原記念生命科学財団研究推進特別奨励金「研究テーマ:ウイルス癌由来エクソソームの新機能」(研究者名:幸谷 愛)、
の一環として行われました。
お問い合わせ先
研究に関する窓口
東海大学医学部 基盤診療学系先端医療科学
教授 幸谷 愛
AMED事業に関するお問い合わせ先
戦略推進部 感染症研究課
(肝炎等克服緊急対策研究事業)