触媒反応によるアルツハイマー病治療の実現に一歩前進
2018-03-16 科学技術振興機構(JST)
ポイント
- アルツハイマー病発症につながると考えられるアミロイドβペプチド(Αβ)凝集体を短波長の光の照射により無毒化する光触媒を開発してきたが、より生体との適合性の高い波長の光で働く触媒が望まれていた。
- 生体組織への透過性の高い近赤外光の照射によりΑβの凝集を抑える光触媒を開発し、アルツハイマー病モデルマウスの脳内においてΑβの量を減少させることに成功した。
- 触媒反応を用いる新しいアルツハイマー病治療法の確立につながることが期待される。
JST 戦略的創造研究推進事業において、東京大学 大学院薬学系研究科 金井 求 教授、ERATO 金井触媒分子生命プロジェクト 相馬 洋平 グループリーダー(講師相当)、東京大学 大学院薬学系研究科 富田 泰輔 教授らの研究グループは、近赤外光の照射によりマウス脳内のアミロイドβペプチド(Αβ)の凝集注1)体を減少させる光触媒注2)の開発に成功しました。
Αβの凝集体が神経細胞を傷つけること(細胞傷害性)がアルツハイマー病発症につながると考えられています。そのため本研究グループは、生体内で触媒反応注3)を引き起こしてΑβの凝集体の形成を阻害することによるアルツハイマー病の治療法の確立に挑戦しています。これまでに開発した触媒は、Αβの酸素化注4)による凝集の阻害や細胞傷害性の低減に成功しています。また近年は副作用を低減する目的で、Αβ以外の生体分子注5)には作用せず、細胞傷害性を持つΑβ凝集体だけに作用する触媒も開発しています。しかし、これらの触媒をΑβと反応させるには、人体に影響のある短波長の光が必要で、光による細胞傷害性の高さや、生体組織への透過性の低さが課題でした。
光触媒自体を医薬として応用するには、より生体との適合性の高い光で働くことのできる触媒が必要であると考え、生体組織への透過性が高い近赤外光の照射により活性化する光触媒を開発しました。マウスの皮膚を透過した近赤外光は光触媒を活性化し、皮下に存在するΑβ凝集体を酸素化し、凝集を抑えました。さらに、アルツハイマー病モデルマウスの脳内におけるΑβの量を減少させることにも成功しました。
今後、触媒によるΑβの酸素化が細胞傷害性を抑制し、アルツハイマー病の症状を改善するかどうか検証を重ねることで、触媒反応を用いた新しいアルツハイマー病治療法の確立につながると期待されます。
本研究成果は、2018年3月15日(米国東部時間)に「Chem」誌オンライン速報版で公開されます。
本成果は、以下の事業・プロジェクトによって得られました。
戦略的創造研究推進事業 総括実施型研究(ERATO)
研究プロジェクト
「金井触媒分子生命プロジェクト」
研究総括
金井 求(東京大学 大学院薬学系研究科 教授)
研究期間
平成23年8月~平成29年3月
上記研究課題では、複雑な構造を持つ医薬候補物質を短い工程で、かつ地球環境を汚染せずに合成できる汎用金属を用いた触媒の開発や、触媒自体が医薬となる人工触媒システムの開発を通して、触媒化学から医薬への貢献を目指します。
たんぱく質は適切に折り畳まれ固有の立体構造を形成することで、それぞれ固有の機能を担いますが、誤って折り畳まれるとアミロイド凝集体と呼ばれるオリゴマー注6)や線維注7)の塊を形成します。アミロイド凝集体による細胞傷害性はさまざまな疾患を引き起こすと報告されており、アミロイドβペプチド(Αβ)の凝集体による神経細胞の傷害と、これに伴うアルツハイマー病の発症は、その一例と考えられています。
アルツハイマー病は近年増加傾向にある疾患で、認知機能の低下を主症状とします。日本国内の患者数は2025年に466万人、2060年には約600~800万人に達すると予想されています(出典:日本における認知症の高齢者人口の将来推計に関する研究班、「日本における認知症の高齢者人口の将来推計に関する研究:平成26年度総括・分担研究報告書:平成26年度厚生労働科学研究費補助金厚生労働科学特別研究事業」(2015))。しかし、認知症は他疾患と比較して、治療満足度や治療に対する薬剤の貢献度が低くなっています。
本研究グループでは、触媒反応を利用した新しいアルツハイマー病治療法の確立を目指しています。これまでに光照射によりΑβ凝集体のみを選択的に酸素化し、Αβの凝集性や細胞傷害性を抑制させる触媒を開発してきました。この触媒は、生命活動にとって必要な生体分子とは反応せず、凝集体を形成したΑβのみに反応するという特徴があり、これは副作用を低減する観点で大変重要な性質となります。しかし、これまで開発した触媒は細胞傷害性が高い上、生体組織への透過性が低い短波長の光を照射する必要がありました。そこで本研究グループは、臨床で応用可能な近赤外光で作用する光触媒の開発に取り組みました。
紀元前から伝わる健康素材であり、今日でもスパイスなどに使われるウコンに含まれるクルクミンという化合物は、Αβと親和性が高いことが知られています。この性質を利用し、Αβとの結合により蛍光を発する色素も開発されています。しかし、これらの化合物には光触媒として酸素化を起こす機能はありません。酸素化を起こすためには、Αβと結合しやすい酸素を発生させる必要があります。本研究グループは、クルクミンの構造を基に、近赤外光を照射することにより結合しやすい酸素を効率的に産生し、Αβを酸素化できる独自の光触媒を開発しました。
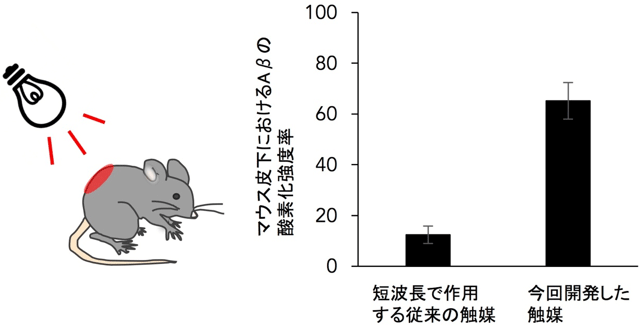
今回開発した光触媒は生きた細胞が存在する状況でも機能し、Αβ凝集体に由来する細胞傷害性を低減させることができました。また、生体組織への透過性が高い近赤外光を照射することで、マウスの皮下に存在するΑβの酸素化を実現しました(図1)。本成果はアルツハイマー病のみならず、糖尿病のようにたんぱく質の凝集が原因で引き起こされるさまざまな末梢系の疾患にも、触媒反応で治療する方法論を応用できる可能性を示すものです。さらに、アルツハイマー病モデルマウスの脳内に触媒を投与し、近赤外光を照射したところ、脳内のΑβ凝集体の量が約半分と顕著に減少することも明らかとなりました(図2)。
今後、マウス体内でのΑβ凝集体の酸素化がアルツハイマー病に特有の症状を改善するかなど、検討を進めます。同時に、触媒を経口から投与可能な構造に改変するなど、さらに医薬品として適合した形へと改良を進めます。触媒反応を用いた新しいアルツハイマー病治療法へと展開できれば、将来、触媒自体を医薬として利用するという新しい治療法をさまざまな難治性疾患に提供できると期待されます。
![]()
図1 マウス皮下におけるΑβの光酸素化
これまで開発した短波長光で作用する光触媒では、マウス皮下におけるΑβ凝集体の酸素化効率は低いが(棒グラフの左側)、近赤外光で作用する新規光触媒の場合は皮下においても効率的な酸素化が可能である(棒グラフの右側)。
![]()
図2 触媒の処置によるアルツハイマー病モデルマウスの脳内Αβ量の変化
アルツハイマー病モデルマウスに触媒を投与し、近赤外光を照射することを7回繰り返すと、触媒による処置をしていない場合と比べてΑβ量が顕著に減少した。棒グラフの左側に比べ、右側の棒グラフではΑβ量が半減している。
![]()
図3 今回の成果の概念図
近赤外光の照射によりマウス脳内のΑβを酸素化する(水中の酸素をΑβへ移す)触媒の開発に成功した。酸素化されたΑβの凝集性や細胞傷害性は低い。触媒の化学構造において、Bはホウ素、Nは窒素、Oは酸素、Fはフッ素、Brは臭素をそれぞれ指す。赤色の結合の回転(緑矢印により表記)により、触媒が生命活動にとって必要な生体分子とは反応せず、凝集したΑβのみに反応するという特徴を出すことができる。
- 注1) 凝集
- 分子が集合して1つに固まること。
- 注2) 光触媒
- 光を当てることで特定の反応を進行させやすくする分子。
- 注3) 触媒反応
- 特定の反応を進行させやすくする分子(触媒)の作用によって進行する化学反応。
- 注4) 酸素化
- 物質が酸素と結合する化学反応で酸化の一種。
- 注5) 生体分子
- 生体内に含まれ生命活動に重要な働きを持つ分子の総称。たんぱく質、脂質、核酸、ホルモン、アミノ酸など。
- 注6) オリゴマー
- 数個~数十個の分子が集まった小さな集合体。
- 注7) 線維
- 細い糸のような形状をした巨大な集合体。
“Near-Infrared Photoactivatable Oxygenation Catalysts of Amyloid Peptide”
(近赤外光で活性化可能なアミロイドペプチドに対する酸素化触媒)
doi: 10.1016/j.chempr.2018.02.008
金井 求(カナイ モトム)
ERATO 金井触媒分子生命プロジェクト 研究総括
東京大学 大学院薬学系研究科 教授
相馬 洋平(ソウマ ヨウヘイ)
ERATO 金井触媒分子生命プロジェクト グループリーダー(講師相当)
大山 健志(オオヤマ タケシ)
科学技術振興機構 研究プロジェクト推進部
科学技術振興機構 広報課