2020-08-25 北海道大学,理化学研究所,株式会社リガク,日本医療研究開発機構
ポイント
- わずかな試料から生理条件に近いタンパク質の立体構造を測定できる構造解析法を開発。
- タンパク質−リガンド複合体構造を簡単なピペット操作のみで半自動的に測定可能。
- 製薬企業などでの創薬候補化合物探索のスピードアップに期待。
概要
北海道大学大学院工学研究院の真栄城正寿助教、渡慶次学教授、同総合化学院修士課程の竹田怜央氏、理化学研究所放射光科学研究センターの上野剛専任技師、山本雅貴グループディレクター、株式会社リガクらの研究グループは、タンパク質と創薬候補化合物(リガンド)の複合体の3次元立体構造を生体に近い室温条件で測定できる方法を開発しました。
標的となるタンパク質の立体構造情報に基づいた薬剤設計方法であるStructure-based Drug Design(SBDD)*1やFragment-based Drug Design(FBDD)*2は、製薬企業をはじめとした創薬研究において広く利用されています。一般的にタンパク質の立体構造は、タンパク質の単結晶を用いたX線結晶構造解析*3によって決定されています。しかし、従来の測定法では、X線による結晶の損傷を防ぐために約−170℃に凍結した結晶試料を用いて測定されており、生体内での立体構造との違いが指摘されていました。また、タンパク質とリガンド複合体の構造決定では、①結晶作製、②複合体調製、③測定、④解析・構造決定と煩雑で時間がかかる操作や多量の結晶試料が必要でした。
研究グループは、マイクロ流体デバイス*4と大型放射光施設「SPring-8」*5のビームライン(BL26B2)、自動データ処理システム(KAMO)を組み合わせることで、数µLの試料から室温条件においてタンパク質の立体構造を簡便に決定できる測定法の開発に成功しました。また、タンパク質とリガンド複合体の調製から構造決定までのプロセスを半自動的に行い、6種類の新規複合体の構造決定に成功しました。今後、デバイスの大規模化を進めることで創薬開発など産業利用への応用が期待されます。
なお、本研究成果は、日本標準時2020年8月25日(火)18時(グリニッジ標準時2020年8月25日(火)9時)公開のChemical Science誌に掲載される予定です。
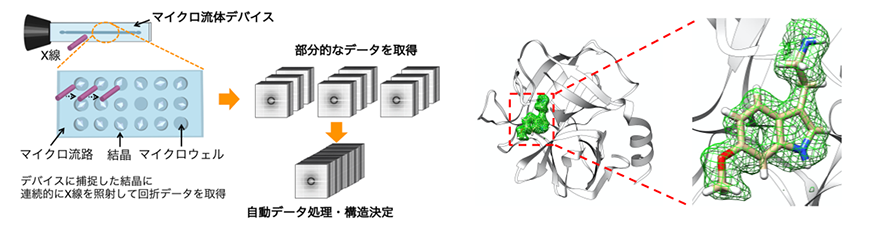
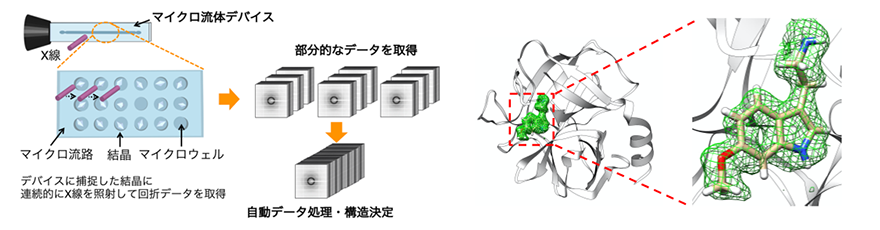 今回開発した測定法のイメージ(左)と決定したタンパク質−リガンド複合体の立体構造(右)
今回開発した測定法のイメージ(左)と決定したタンパク質−リガンド複合体の立体構造(右)
背景
製薬企業や大学などにおける創薬研究では、標的とするタンパク質の3次元立体構造情報を基に創薬候補化合物(リガンド)が設計されています。このような創薬手法はSBDDやFBDDと呼ばれ、抗インフルエンザ薬であるタミフルはSBDDで開発された代表的な医薬品です。また、新型コロナウイルス(SARS-CoV-2)においても、ウイルス表面のスパイクタンパク質の立体構造を基に治療薬の開発が進んでいます。
一般的にタンパク質の立体構造は、タンパク質の単結晶にX線を照射して得られる回折パターンから決定されています(X線結晶構造解析)。X線結晶構造解析では、作製したタンパク質の結晶をループ(ナイロンの輪)で拾い、ループをX線回折計に設置してX線照射・解析・構造決定を行うという流れで結晶を1個ずつ測定しています。しかし、現在主流となっているX線結晶構造解析は、放射線損傷による結晶(試料)の劣化を防ぐために約−170℃に凍結した結晶試料を用いるため、生体内でのタンパク質の立体構造との違いが指摘されていました。また、タンパク質とリガンドの複合体の測定では、①結晶作製、②複合体調製、③測定、④解析・構造決定と多くの煩雑で時間がかかる操作が必要です。室温条件で高精度にタンパク質の立体構造を決定するためには、試料の乾燥を防ぐためにキャピラリー等へ封入し、測定中に劣化した結晶を交換するため、この煩雑な操作を数十回繰り返す必要がありました。そのため、生体に近い室温条件で簡便にタンパク質−リガンド複合体の立体構造を測定できる方法が強く求められていました。
研究手法
研究グループは、100~300µmのウェル(くぼみ)を集積化したマイクロ流体デバイスを作製し、タンパク質の結晶をウェルに配置させて、大型放射光施設「SPring-8」のビームライン(BL26B2)において連続的にX線を照射、回折データを取得・構造解析する測定方法を開発・考案しました(図1)。さらに、作製したデバイスと回折データの自動処理システム(KAMO)を組み合わせて測定の半自動化に取り組み、タンパク質−リガンド複合体の構造解析に応用しました。
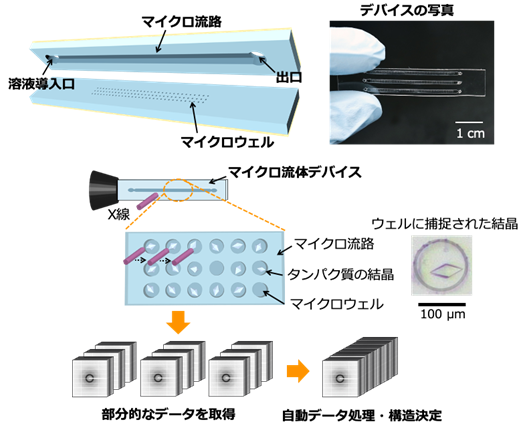
図1.開発したマイクロ流体デバイスと測定コンセプト
研究成果
研究グループは、開発したマイクロ流体デバイスに結晶懸濁液をピペット操作によって導入するだけで、タンパク質の結晶が自動的にウェルに捕捉されることを確認しました。また、測定対象の結晶サイズに合わせてウェルサイズを設計することで、効率良く1個の結晶を1個のウェルに捕捉できることを見出しました。これによって、①ウェル中の結晶が劣化しない範囲で回折データを取得、②異なるウェルの結晶にX線を再照射して回折データを取得する、③複数の結晶から回折データを取得して立体構造を決定する、というプロセスの半自動化が可能となりました。一方で、本測定法では、複数の結晶から多数の回折データを取得するため、回折データの処理が課題と考えられていました。この課題を解決するために、研究グループは本測定法と以前に理化学研究所が開発した回折データの自動処理システム(KAMO)との組み合わせに取り組みました。その結果、図1に示す測定コンセプトのように、デバイスに捕捉された結晶に連続的にX線を照射して回折データを取得し、得られたデータをKAMOによって自動処理することで生体に近い室温条件でタンパク質の立体構造を決定することに成功しました。
さらに研究グループは、本測定法をタンパク質−リガンド複合体の構造解析にも応用しました。開発したマイクロ流体デバイスでは、一度捕捉された結晶はウェルから流出しないため、図2のように作製したデバイスによって、結晶を捕捉した後にマイクロ流体デバイスにリガンド溶液を導入するだけで、タンパク質−リガンド複合体結晶の同時調製を実現しました。これによって、トリプシンというタンパク質と8種類のリガンドとの複合体の構造解析に成功しました。また、その中の6種類は、これまでに報告がない新規な複合体構造でした。さらに、室温条件と凍結条件で測定した複合体構造を比較した結果、凍結条件で得られた立体構造情報からは、本来のリガンド認識部位とは異なる部位にもリガンドが結合していることが明らかになりました。これは、凍結条件下で得られた複合体構造が、生理条件における複合体構造と異なることを示唆しており、室温におけるリガンド探索と構造解析が創薬において重要であることがわかりました。
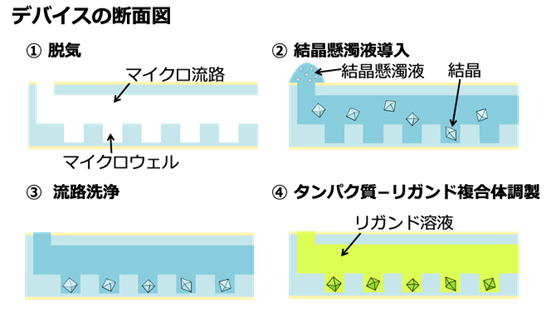
図2.開発したデバイスによるタンパク質−リガンド複合体の調製方法。ピペット操作のみで②結晶懸濁液導入、③流路洗浄、④タンパク質−リガンド複合体調製が可能。
今後への期待
本測定法によって、創薬候補化合物の探索・開発の加速が期待されます。創薬候補化合物の探索には膨大な数の測定が必要です。マイクロ流体デバイスは、一つのデバイスに数千~数万個のウェルを集積化することができます。将来的には、結晶懸濁液やリガンド溶液の送液までを自動化することでタンパク質−リガンド複合体の構造解析の完全自動化が可能になると期待され、創薬候補化合物探索のスピードアップも期待されます。
謝辞
本研究は、文部科学省・日本学術振興会科学研究費助成事業若手研究(19K15596)、挑戦的研究(萌芽)(19K22403)、日本医療研究開発機構(AMED)「創薬等ライフサイエンス研究支援基盤事業(BINDS)「創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化(SPring-8/SACLAにおけるタンパク質立体構造解析の支援及び高度化)」(JP20am0101070)、旭硝子財団、島津科学技術振興財団の助成を受けて実施されました。
論文情報
- 論文名
- Room-temperature crystallography using a microfluidic protein crystal array device and its application to protein – ligand complex structure analysis(マイクロ流体デバイスを用いた室温での結晶構造解析とタンパク質ーリガンド複合体構造解析への応用)
- 著者名
- 真栄城正寿1、2、伊藤翔3、4、竹田怜央5、上野剛2、石田晃彦1、谷博文1、山本雅貴2、3、渡慶次学1(1北海道大学大学院工学研究院、2理化学研究所放射光科学研究センター、3兵庫県立大学生命理学研究科、4株式会社リガク、5北海道大学大学院総合化学院)
- 雑誌名
- Chemical Science(化学全般の専門誌)
- DOI
- 10.1039/d0sc02117b
- 公表日
- 日本標準時2020年8月25日(火)18時(グリニッジ標準時2020年8月25日(火)9時)(オンライン公開)
用語解説
- *1 Structure-based Drug Design(SBDD)
- 標的としているタンパク質の立体構造情報に基づいた薬剤設計方法。
- *2 Fragment-based Drug Design(FBDD)
- 標的としているタンパク質に対して多数の低分子化合物との複合体構造を解析し、その立体構造情報を基に薬剤を設計する方法。
- *3 X線結晶構造解析
- タンパク質の結晶にX線を照射して得られる回折データから、タンパク質の立体構造を決定する分析法。
- *4 マイクロ流体デバイス
- 流路幅が数µm~数百µmの微小な流路をもつデバイス。
- *5 大型放射光施設「SPring-8」
- 理化学研究所が所有する、兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す施設。SPring-8の名前はSuper Photon ring-8 GeVに由来する。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げた時に発生する細くて強力な電磁波のこと。SPring-8では、遠赤外線から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。
お問い合わせ先
北海道大学大学院工学研究院 助教 真栄城正寿(まえきまさとし)
理化学研究所放射光科学研究センター 専任技師 上野剛(うえのごう)
株式会社リガク応用技術センター単結晶構造解析グループ 研究員 伊藤翔(いとうしょう)
配信元
北海道大学総務企画部広報課
理化学研究所広報室報道担当
株式会社リガク広報宣伝課
AMED事業について
日本医療研究開発機構(AMED)創薬事業部医薬品研究開発課
創薬等ライフサイエンス研究支援基盤事業(BINDS)