2021-02-16 京都大学iPS細胞研究所
ポイント
- ヒトiPS細胞由来エリスロポエチン注1)産生細胞は腎性貧血の新規治療薬開発に使用できる有用なツールである。
- ビタミンAの代謝産物であるレチノイン酸は、低酸素シグナルと協調してヒトiPS細胞由来エリスロポエチン産生細胞におけるエリスロポエチン産生を制御していることを示した。
- レチノイン酸は既存の腎性貧血治療薬の効果を増強し、マウスの腎性貧血を改善することを示した。
1. 要旨
慢性腎不全では赤血球の産生に必須であるエリスロポエチンというホルモンの産生が不十分となり、貧血を起こします。エリスロポエチン産生を制御する因子の一つとして、これまでに低酸素シグナルである低酸素誘導性因子(HIF; hypoxia-inducible factor)が同定されていますが、その他の詳細な機序は明らかではありませんでした。
片桐 直子 研究員(京都大学CiRA増殖分化機構研究部門、リジェネフロ株式会社)、人見 浩史 教授(関西医科大学iPS・幹細胞再生医学講座)、西山 成 教授(香川大学医学部薬理学教室)、長船 健二 教授(京都大学CiRA増殖分化機構研究部門)らの研究グループは、ビタミンAの代謝産物であるレチノイン酸が、低酸素誘導性因子と協調してiPS細胞由来エリスロポエチン産生細胞におけるエリスロポエチンの産生を制御していることを明らかにしました。また、腎不全による貧血を起こしたマウスにレチノイン酸を投与すると、既存の腎性貧血治療薬の一つであるPHD(prolyl hydroxylase domain-containing protein)阻害剤の作用を増強して、貧血が改善されることを示しました。
この研究結果は、2021年2月16日(英国時間)に英科学雑誌「Scientific Reports」で公開されました。
2. 研究の背景
エリスロポエチンは赤血球の産生に必要不可欠なホルモンで、成人では腎臓で産生されます。そのため、慢性腎不全の患者さんでは貧血が起こり、身体のだるさやふらつきを引き起こします。このような腎性貧血に対しては、主としてヒト遺伝子組み換えエリスロポエチン製剤の投与が行われていますが、副作用の可能性やコストの問題から、より安全で安価な新規治療薬の開発が期待されています。しかしながら、エリスロポエチンの産生を制御する因子の一つとして、低酸素シグナルである低酸素誘導性因子は既に明らかになっていましたが、その他の詳細なメカニズムは不明でした。
研究グループはこれまでに、iPS細胞からエリスロポエチン産生細胞を分化誘導するプロトコールを開発し(Hitomi et al., 2017、CiRAニュース 2017年9月28日)、今回はその細胞を用いてエリスロポエチンの産生機序を解明することに取り組みました。
3. 研究結果
1) レチノイン酸は低酸素シグナルと協調してエリスロポエチンの産生を制御することを明らかにした
食物から摂取されるビタミンAの代謝産物であるレチノイン酸は、マウスの胚発生の初期においてエリスロポエチンの産生を制御することが報告されていることから、iPS細胞由来エリスロポエチン産生細胞におけるレチノイン酸の働きを調べました。
レチノイン酸、あるいは、エリスロポエチン制御因子として既知の低酸素シグナル単独の刺激では、エリスロポエチン産生量の増加はわずかであったのに対し、両者を併用することでエリスロポエチン産生量は顕著に増加しました(図1)。
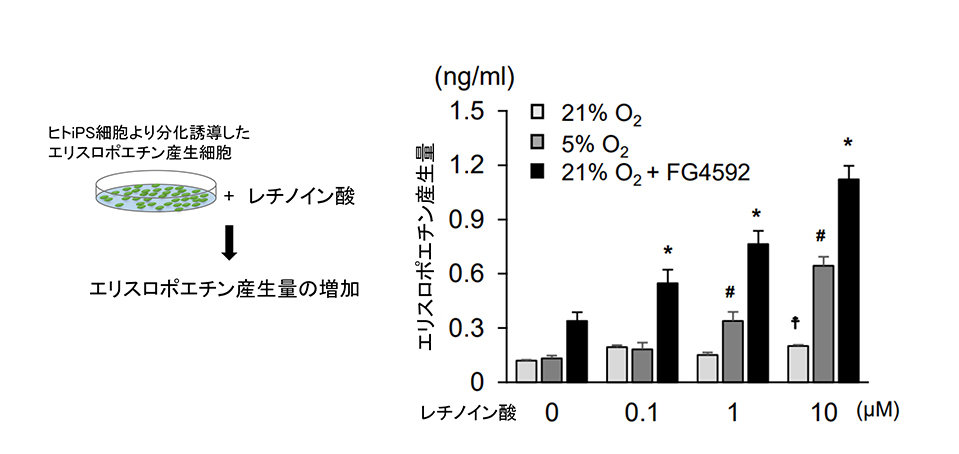
図1. ヒトiPS細胞由来エリスロポエチン産生細胞にレチノイン酸(ATRA)を投与した際のエリスロポエチン産生量。21% O2は正常の酸素濃度、5% O2は低酸素濃度を示す。FG4592は低酸素シグナルを増強するPHD阻害剤。
2) クロマチン注2)構造の変化がレチノイン酸によるエリスロポエチン産生機序に関与している可能性を示した
低酸素シグナルによるクロマチン構造の変化が、レチノイン酸のエリスロポエチン産生制御領域への作用を可能にしているという仮設を立て、ATAC-sequencing注3)を用いてクロマチンの開閉状態の変化を調べました(図2)。エリスロポエチン遺伝子の転写開始点の近傍に、低酸素状態において開いている部位が存在することがわかり、同領域にモチーフ解析を行うことで、その部位に結合してエリスロポエチンの産生制御に作用する可能性のある13個のタンパク質が明らかになりました。
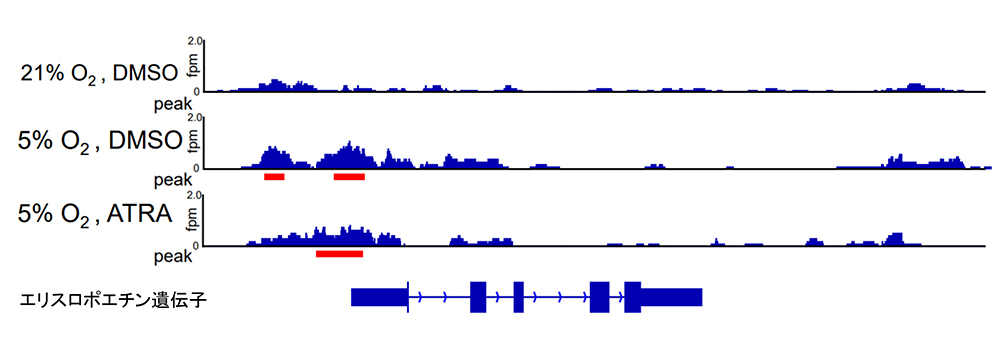
図2. ATAC-sequencingのシグナル図。赤線はpeak call領域で、クロマチン構造が開いている領域を示す。DMSOはレチノイン酸(ATRA)を溶かしている溶剤。ATRAの比較対照として使用。
3) 低酸素シグナルを増強するPHD阻害剤はレチノイン酸の存在下においてマウスの腎性貧血を改善することを示した
マウス体内においても、レチノイン酸と低酸素シグナルの協調したエリスロポエチン産生制御機構が存在するのかを調べました。まず、摘出した成体マウスの腎組織を用いて、レチノイン酸および低酸素シグナル増強因子であるPHD阻害剤FG4592の併用によりエリスロポエチン産生量が増加することを確かめました。次に、慢性腎不全により貧血を起こしたマウスにおいても、レチノイン酸の存在下においてPHD阻害剤による貧血の改善効果が認められることを示しました(図3)。
PHD阻害剤は既に腎性貧血治療薬として臨床で使用されていますが、レチノイン酸は食物により摂取したビタミンAの代謝産物であり、体内で生合成することができないことから、ビタミンA欠乏症の患者さんにおいてはPHD阻害剤の効果を期待できない場合があることを示唆しています。
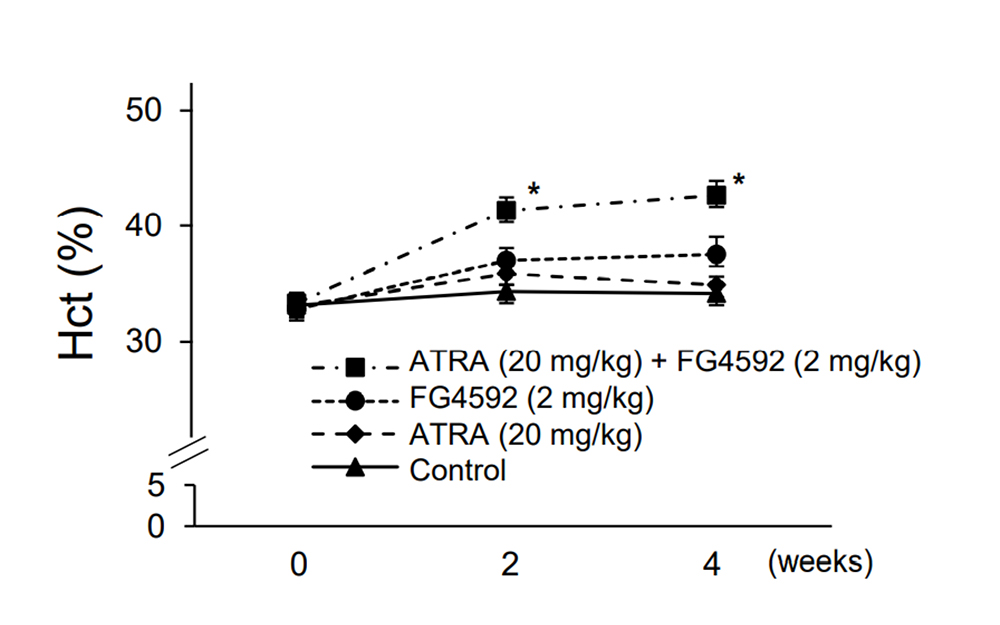
図3. 腎性貧血マウスの治療開始後のヘマトクリット注4)の推移を示す。
ATRA:レチノイン酸、FG4592:PHD阻害剤。
4. まとめ
本研究では、ヒトiPS細胞由来エリスロポエチン産生細胞においてレチノイン酸と低酸素シグナルが協調してエリスロポエチン産生を制御していることを示しました。また、腎性貧血の動物モデルを用いて、レチノイン酸がエリスロポエチン産生に関与していることを初めて示しました。今後、ヒトiPS細胞由来エリスロポエチン産生細胞を用いた新規の腎性貧血治療薬の開発が期待されます。
5. 論文名と著者
- 論文名
Retinoic acid regulates erythropoietin production cooperatively with hypoxia-inducible factors in human iPSC-derived erythropoietin-producing cells - ジャーナル名
Scientific Reports - 著者
Naoko Katagiri1*, Hirofumi Hitomi2, Shin-Ichi Mae1, Maki Kotaka1, Li Lei3, Takuya Yamamoto4,5,6,7, Akira Nishiyama3, Kenji Osafune1**
* 筆頭著者 ** 責任著者 - 著者の所属機関
- 京都大学 CiRA増殖分化機構研究部門
- 関西医科大学 iPS・幹細胞再生医学講座
- 香川大学 医学部薬理学教室
- 京都大学 CiRA未来生命科学開拓部門
- 京都大学 高等研究院ヒト生物学高等研究拠点 (ASHBi)
- 革新的先端研究開発支援事業 (AMED-CREST)
- 国立研究開発法人理化学研究所 革新知能統合研究センター
iPS細胞連携医学的リスク回避チーム
6. 本研究への支援
本研究は、下記機関より支援を受けて実施されました。
- 国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
「技術開発個別課題」「iPS細胞研究中核拠点」 - 日本学術振興会(JSPS)科研費[18K19542]
- 第一三共生命科学研究振興財団
7. 用語説明
注1) エリスロポエチン
赤血球の産生に必須のホルモンで、成体では腎臓で産生される。
注2) クロマチン
ゲノムDNAが核内に存在するために折りたたまれて濃縮されたもの。ヒストンというたんぱく質に巻きついて存在している。クロマチンの開閉構造の変化は遺伝子発現の調節に関与する場合がある。
注3) ATAC-sequencing (Assay for Transposase-Accessible Chromatin with high-throughput sequencing)
網羅的オープンクロマチン領域解析のこと。トランスポゼースという酵素を利用して、クロマチンが開いている部位を全ゲノムDNAに対し網羅的に調べる手法。
注4) ヘマトクリット
血液における赤血球の割合。貧血の場合、低値を示す。