2020-07-22 理化学研究所
理化学研究所(理研)生命医科学研究センター免疫シグナル研究チームの今西貴之上級研究員、斉藤隆チームリーダーらの共同研究グループは、T細胞[1]の病原体センサーがT細胞を活性化する分子機構を明らかにしました。
本研究成果は、感染症や自己免疫疾患[2]の新たな治療法の開発に貢献すると期待できます。
ウイルスや細菌などの病原体が私たちの体に侵入すると、病原体センサーの「Toll様受容体(TLR)[3]」が感知し、自然免疫応答およびその後の抗原特異的な獲得免疫を誘導して、病原体を排除することが知られています。TLRは、主に樹状細胞[4]やマクロファージ[5]などの自然免疫[6]を担当する細胞に発現し機能していることが知られていますが、近年、獲得免疫[6]の中心的担い手であるT細胞にも発現し、T細胞の「Toll様受容体2(TLR2)」が感染免疫応答だけでなく、自己免疫疾患や抗腫瘍免疫にも重要な役割を果たすことが報告されています。
今回、共同研究グループは、TLR2がT細胞を活性化する分子機構を解析しました。その結果、T細胞抗原受容体(TCR)[7]を介したT細胞の活性化に伴って、TLR2の下流の「TIRAP」と呼ばれるシグナル伝達分子の発現が誘導され、発現したTIRAPによってTLR2を介するシグナルが活性化されて、T細胞が病原体に反応できるようになるメカニズムが明らかになりました。
本研究成果は、オンライン科学雑誌『Cell Reports』(7月21日付:日本時間7月22日)に掲載されます。
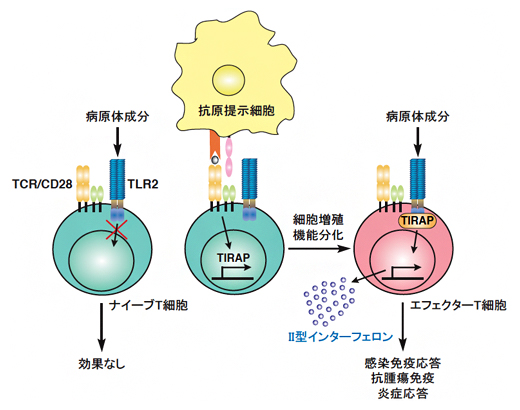
T細胞の病原体センサーToll様受容体2(TLR2)がT細胞を活性化するメカニズム
背景
私たちの体を防御する免疫システムでは、まず身体に侵入した病原体を感知することが重要で、免疫を担う細胞には、病原体を見分けるセンサーとしてパターン認識受容体[3]が備わっています。パターン認識受容体は、病原体に特有の構造を認識して、迅速な自然免疫応答を誘導するとともに、その後には抗原特異的な獲得免疫応答の活性化を効果的に誘導することが知られています。
「Toll様受容体2(TLR2)」は、細胞表面に発現するパターン認識受容体の一つで、TLR1またはTLR6と二量体を形作ることにより、細菌や真菌、ウイルスなどの幅広い病原体の成分を認識することが知られています。TLR2は、自然免疫をつかさどる樹状細胞やマクロファージなどの細胞のみならず、獲得免疫の中心を担うT細胞にも発現して機能し、感染免疫や抗腫瘍免疫、自己免疫疾患の誘導に重要な役割を果たすことが報告されています。
斉藤隆チームリーダーらは、抗原にさらされたことのないナイーブT細胞[8]はTLR2によって活性化されないのに対して注1)、ナイーブT細胞が活性化して分化したエフェクターT細胞[9](感染防御に重要なTh1細胞[9]や、ウイルスや腫瘍の排除に重要な活性化CD8T細胞など)は、直接TLR2によって活性化されることを明らかにしてきました注2)。しかし、なぜナイーブT細胞は活性化されないのかなど、TLR2によるT細胞活性化のメカニズムは不明のままでした。そこで今回、共同研究グループはTLR2によるT細胞活性化の分子機構を調べました。
注1)2014年4月10日プレスリリース「アレルギー反応を引き起こす新たな誘導因子を発見」
注2)Imanishi, T., et al. TLR2 directly triggers Th1 effector functions. J. Immunol. 178:6715-6719, 2007.
研究手法と成果
エフェクターT細胞は、TLR2のリガンド(受容体を活性化する分子)で活性化されるのに対して、ナイーブT細胞は活性化されません。そこで、共同研究グループは、ナイーブT細胞と、エフェクターT細胞の一種であるTh1細胞におけるTLR2の下流のシグナル伝達分子の発現の違いを調べました。その結果、これらの細胞では、TLR2を介する活性化シグナルに必須の役割を果たすアダプター分子[10]「TIRAP」の発現が異なることを見いだしました。TIRAPの発現は、ナイーブT細胞ではほとんどありませんが、ナイーブT細胞をTCR刺激で活性化すると上昇し、Th1細胞に分化した後でも、TIRAPの発現は維持されることが明らかになりました(図1)。実際、ナイーブT細胞をTLR2リガンドで刺激しても、TLR2の下流のシグナル分子であるNF-κB[11]やERK[11]の活性化の誘導は認められませんでした(図1)。
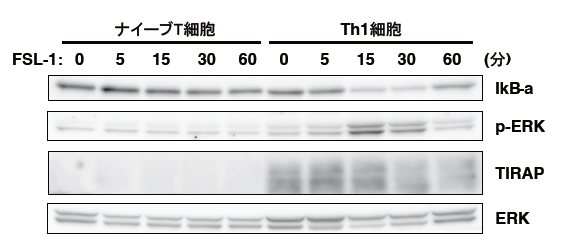
図1 ナイーブT細胞とエフェクターTh1細胞におけるTIRAPの発現
ナイーブT細胞またはエフェクターTh1細胞をTLR2のリガンド(FSL-1)で刺激した後のシグナル分子ERKのリン酸化(p-ERK)とTIRAP、IkB-aの発現量を解析した。濃い部分ほど、その分子が多く発現することを示す。Th1細胞ではTIRAPが発現し、ERKのリン酸化やIkB-aの分解(NF-κBの活性化)が認められるのに対して、ナイーブT細胞ではTIRAPの発現がほとんど認められず、ERKのリン酸化やIkB-aの分解も誘導されなかった。
Th1細胞の培養には、T細胞の増殖因子であるインターロイキン-2(IL-2)が必要です。そこで次に、IL-2がTIRAPの発現に及ぼす影響を調べました。その結果、高い濃度のIL-2で培養する条件で分化したTh1細胞は、低い濃度のIL-2で培養した場合のTh1細胞に比べて、TIRAPの発現が高くなることが明らかになりました。また、TIRAPの発現レベルに比例して、高い濃度のIL-2で培養したTh1細胞は、低い濃度で培養した細胞よりも、TLR2リガンドによって誘導されるⅡ型インターフェロン(IFN-γ)[12]の産生やNF-κB、ERKの活性化が高いことも認められました。以上のことから、T細胞では、TCR刺激によってTIRAPの発現が初めて誘導され、IL-2があるとその発現が維持されることが分かりました。
そこで、TCRとIL-2の刺激によるTIRAPの発現誘導のメカニズムを調べました。TCRとIL-2の刺激によってT細胞の増殖を誘導するには、栄養センサーとして知られるmTOR複合体1(mTORC1)[13]の活性化が必須です。共同研究チームは、mTORC1がTIRAPの発現に与える影響を調べるため、mTORC1の阻害剤ラパマイシンの存在する条件でTh1細胞を培養しました。その結果、ラパマイシンの存在下で培養したTh1細胞は、TIRAPの発現が低いことが分かりました。また、Th1細胞をTLR2リガンドで刺激するとmTORC1の活性化が誘導されたことから、その生理的意義を調べました。その結果、ラパマイシンの存在下でmTORC1活性を抑制した条件で、TLR2リガンドでTh1細胞を刺激すると、IFN-γの産生が著しく抑制されることが明らかになりました。
以上のことから、T細胞は、TCR刺激およびIL-2によるmTORC1の活性化を介してTIRAPの発現を誘導し、このTIRAPによってTLR2シグナルを誘導し、エフェクターT細胞を活性化して、IFN-γの産生を誘導することが明らかになりました(図2)。
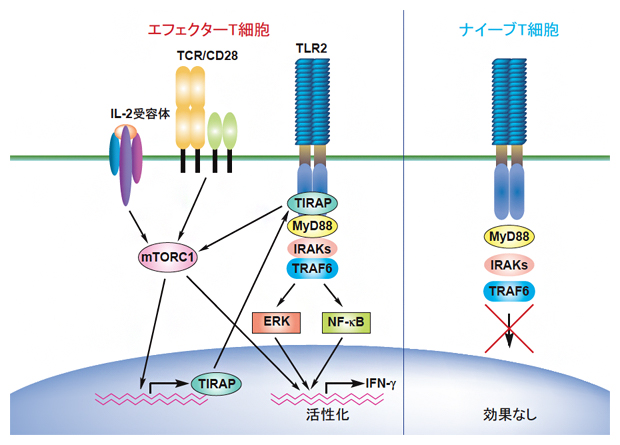
図2 TIRAPの発現誘導とTIRAPによるTLR2を介するエフェクターT細胞活性化の誘導
ナイーブT細胞ではTIRAPが発現していないため、TLR2によるT細胞の活性化が誘導できない。一方、TCR刺激によってナイーブT細胞が活性化されて、エフェクターT細胞に分化すると、TCRやIL-2シグナルによってmTOR複合体1(mTORC1)が活性化され、TIRAPの発現を誘導する。このTIRAPによって、TLR2を介したエフェクターT細胞の活性化が可能になる。
今後の期待
今回の研究成果により、T細胞に発現するTLR2によってT細胞が活性化される詳細なメカニズムが明らかになりました。TIRAPは、TLR2以外のTLRの下流でも活性化シグナルを伝達するアダプター分子であり、ヒトにおいてもさまざまなTLRがT細胞で機能していることが報告されています。そのため、今回の発見に基づき、TIRAP、mTORC1およびそれらの関連分子の機能制御によって、感染症やがん、自己免疫疾患に対する新たな治療薬の開発へとつながると期待できます。
補足説明
1.T細胞
免疫を担うリンパ球の一種。細胞表面に発現するT細胞抗原受容体(TCR)を介して、樹状細胞などの抗原提示細胞が提示する抗原を認識し、活性化する。活性化したT細胞は、サイトカイン(細胞同士の情報伝達を行うタンパク質の総称)を分泌するヘルパー細胞や、がんや感染細胞を殺すキラー細胞などのエフェクター細胞に分化する。
2.自己免疫疾患
免疫系に異常をきたし、自己の正常な細胞や組織を異物として認識して、攻撃することによって誘導される疾患の総称。代表的なものに関節リウマチがある。
3.Toll様受容体(TLR)、パターン認識受容体
病原体に特有の分子パターンを認識する受容体をパターン認識受容体という。Toll様受容体(TLR)はその一つで、ほかにRIG-I様受容体(RLR)、NOD様受容体(NLR)、C型レクチン受容体(CLR)などがある。
4.樹状細胞
自然免疫を担う免疫細胞の一種で、皮膚組織や粘膜に存在し、表面に多くの突起を持つ。異物を取り込んで活性化すると、リンパ節や脾臓などの二次リンパ器官に移動して抗原特異的なT細胞に抗原を提示し、T細胞を活性化する。
5.マクロファージ
自然免疫を担う免疫細胞の一種で、体内に侵入した異物を取り込み消化すること(貪食作用)を主な役割とする。
6.自然免疫、獲得免疫
自然免疫は、体に侵入してきた病原体を迅速に感知し、感染初期の生体防御を誘導する機構で、樹状細胞やマクロファージなどが担当する。自然免疫の活性化は、その後の獲得免疫の発動にも重要である。獲得免疫は、感染後期に誘導される免疫機構で、高い特異性や長期に応答を記憶できることを特徴とする。これらの特長から、同じ病原体に感染した際に効率良く排除できるシステムである。主に、リンパ球のT細胞とB細胞が担当する。
7.T細胞抗原受容体(TCR)
T細胞の細胞表面に発現する受容体で、抗原提示細胞の細胞表面に提示される主要組織適合抗原複合体(MHC)タンパク質と抗原の複合体を認識して、T細胞を活性化する。
8.ナイーブT細胞
抗原にさらされたことのないT細胞のこと。抗原提示細胞からの抗原刺激を受けることにより、活性化され、機能分化してTh1細胞やTh2細胞などのエフェクターヘルパーT細胞に分化する。
9.エフェクターT細胞、Th1細胞
エフェクターT細胞はナイーブT細胞が抗原刺激により活性化し、機能的に分化したT細胞。Th1細胞は、細胞内に寄生する細菌やウイルスなどの病原体の排除を促すエフェクターヘルパーT細胞の一種。Th2細胞は、細胞外に寄生する寄生虫などの排除を誘導するエフェクターヘルパーT細胞であるが、一方で花粉やハウスダストなどに対するアレルギー反応を誘導することも知られている。ほかに細胞外増殖性の細菌の排除に重要なTh17細胞などがある。
10.アダプター分子
酵素活性は持たないが、他のシグナル伝達分子と相互作用するドメインを持って会合することにより、シグナル伝達の役割を担う分子である。
11.NF-κB、ERK
NF-κBは転写因子、ERKはリン酸化酵素で、ともに細胞の増殖や生存、サイトカインの産生に重要なタンパクである。獲得免疫や自然免疫担当細胞の活性化に重要な役割を果たす。
12.Ⅱ型インターフェロン(IFN-γ)
主にTh1細胞やCD8T細胞から産生されるインターフェロンファミリーで、IFN-γのみからなる。IFN-γは、マクロファージを活性化して細菌貪食や殺菌機能を高める。
13.mTOR複合体1(mTORC1)
mTORは、エネルギーや栄養、増殖因子などの環境シグナルに反応して活性化が調節されるタンパク質リン酸化酵素で、複数のタンパク質による複合体mTORC1およびmTORC2を形成する。mTORC1は、タンパク合成を活性化し、細胞の増殖を促進する。
共同研究グループ
理化学研究所 生命医科学研究センター
免疫シグナル研究チーム
チームリーダー 斉藤 隆(さいとう たかし)
上級研究員 今西 貴之(いまにし たかゆき)
テクニカルスタッフ 海野 緑(うんの みどり)
テクニカルスタッフ(研究当時) 小林 若菜(こばやし わかな)
(現 粘膜免疫研究チーム)
テクニカルスタッフ 米田 奈津美(よねだ なつみ)
大阪大学 免疫学フロンティア研究センター
教授 審良 静男(あきら しずお)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究C「細胞質DNAセンサーによるT細胞の活性化制御機構の解明(研究代表者:今西貴之)」、同基盤研究S「T細胞活性化制御の時空間的構造的解析(研究代表者:斉藤隆)」による支援を受けて行われました。
原論文情報
Takayuki Imanishi, Midori Unno, Wakana Kobayashi, Natsumi Yoneda, Shizuo Akira, and Takashi Saito, “mTORC1 signaling controls TLR2-mediated T cell activation by inducing TIRAP expression”, Cell Reports, 10.1016/j.celrep.2020.107911
発表者
理化学研究所
生命医科学研究センター 免疫シグナル研究チーム
チームリーダー 斉藤 隆(さいとう たかし)
上級研究員 今西 貴之(いまにし たかゆき)
報道担当
理化学研究所 広報室 報道担当