細胞凝縮の機能不全は、先天性奇形、一般的な疾患、がんなどに関連する疾患メカニズムである Malfunction of cellular condensates is a disease mechanism relevant for congenital malformations, common diseases, and cancer
2023-02-08 マックス・プランク研究所
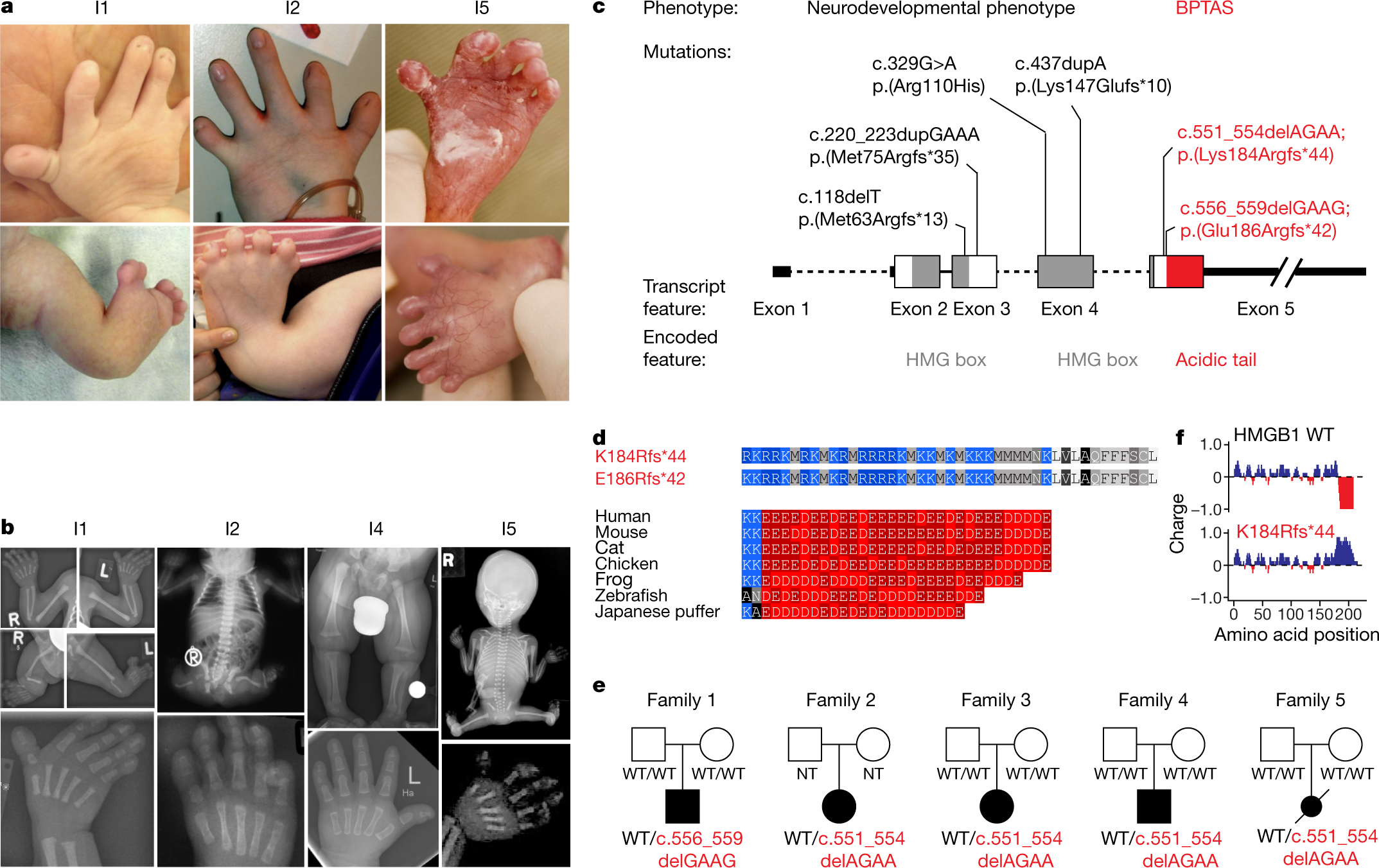
◆BPTA症候群の患者は、短い指と付加的な足指を特徴とする手足の奇形、脚の脛骨の欠損、脳の縮小を特徴とする。研究チームが発見したように、BPTASは特殊な遺伝子変化によって、必須タンパク質が核小体(細胞核にある大きなタンパク質性の液滴)に移動してしまうことで発症します。その結果、核小体凝縮体の機能が阻害され、発達障害を発症するのです。
◆ベルリンにあるマックス・プランク分子遺伝学研究所、シュレスヴィヒ・ホルシュタイン大学病院、そして世界中から集まった研究者たちとの協力により、このチームは新しい診断への扉を開き、他の多くの病気の解明や将来の治療法につながる可能性を持っているのです。
◆シャリテ医科人類遺伝学研究所の臨床遺伝学者であるマーティン・メンサ教授らは、この病気の原因を探るため、5人の患者のゲノムを解読し、すべての患者でHMGB1というタンパク質の遺伝子に変化が生じていることを突き止めた。このタンパク質は、細胞核内の遺伝物質を組織化し、遺伝子の読み取りなど、他の分子とDNAとの相互作用を促進する役割を担っている。
◆さらに詳しく調べてみると、HMGB1の変異の種類によって、異なる結果をもたらすことが明らかになった。配列決定データから、重度の奇形を持つ患児では、HMGB1遺伝子の最後の3分の1の読み枠がシフトしていることがわかった。
◆タンパク質に翻訳された後、対応する領域は、負電荷のアミノ酸構成単位ではなく、正電荷のアミノ酸構成単位を備えるようになった。これは、3文字で割り切れない数の遺伝子の文字が配列中に欠けている場合に起こり得ることで、正確に連続した3文字が常にタンパク質の1つの構成要素をコードしているからである。
◆細胞核の中の核小体も凝集体であり、顕微鏡で見ると、拡散した暗い斑点として見える。ここには、正電荷を帯びた尾部をもつ多くのタンパク質が好んで滞留している。これらの多くは、タンパク質合成に必要な機械を提供しており、この凝縮体は細胞機能に不可欠である。
◆研究チームは、単離したタンパク質を用いた実験や細胞培養の結果から、正電荷の分子尾部をもつ変異型タンパク質HMGB1も核小体に引き寄せられることを確認している。
◆そこで研究チームは、数千人分のゲノムデータのデータベースを検索し、同様の事例を探した。その結果、66個のタンパク質について、600以上の類似した変異を特定することができた。この変異は、タンパク質の尾部に生じた変異によって読み取り枠が移動し、より正電荷で、より「脂っぽい」状態になっていた。これらの変異のうち101個は、これまでにいくつかの異なる疾患との関連が指摘されていた。
◆研究チームは、細胞培養アッセイで13の変異遺伝子を選択した。13例中12例で、変異タンパク質は核小体に局在する傾向があった。また、変異タンパク質の約半数は核小体の機能を低下させており、BPTA症候群の発症メカニズムに類似していた。
◆しかし、「BPTASのような先天性遺伝病は、我々の新しい知識を持ってしても、ほとんど治療不可能です」とホーン氏は言います。「子宮の中で既に奇形が発生しているのですから、発生する前に薬で治療しなければならないのです。これは非常に難しいことです」。
◆しかし、腫瘍疾患もまた、遺伝的に決定されることが多いのです。「細胞凝縮とそれに伴う相分離は、細胞の基本的なメカニズムであり、癌にも関与しています」とHniszは付け加えます。細胞凝縮とそれに伴う相分離は、細胞の基本的なメカニズムであり、癌にも関与しています。このため、標的療法を開発できる可能性は、はるかに高いのです”。
<関連情報>
- https://www.mpg.de/19845284/0206-moge-protein-droplets-may-cause-many-types-of-genetic-disease-151795-x
- https://www.nature.com/articles/s41586-022-05682-1
希少遺伝性疾患における相分離異常と核小体機能障害 Aberrant phase separation and nucleolar dysfunction in rare genetic diseases
Martin A. Mensah,Henri Niskanen,Alexandre P. Magalhaes,Shaon Basu,Martin Kircher,Henrike L. Sczakiel,Alisa M. V. Reiter,Jonas Elsner,Peter Meinecke,Saskia Biskup,Brian H. Y. Chung,Gregor Dombrowsky,Christel Eckmann-Scholz,Marc Phillip Hitz,Alexander Hoischen,Paul-Martin Holterhus,Wiebke Hülsemann,Kimia Kahrizi,Vera M. Kalscheuer,Anita Kan,Mandy Krumbiegel,Ingo Kurth,Jonas Leubner,Ann Carolin Longardt,Jörg D. Moritz,Hossein Najmabadi,Karolina Skipalova,Lot Snijders Blok,Andreas Tzschach,Eberhard Wiedersberg,Martin Zenker,Carla Garcia-Cabau,René Buschow,Xavier Salvatella,Matthew L. Kraushar,Stefan Mundlos,Almuth Caliebe,Malte Spielmann,Denise Horn & Denes Hnisz
Nature Published:08 February 2023
DOI:https://doi.org/10.1038/s41586-022-05682-1
Abstract
Thousands of genetic variants in protein-coding genes have been linked to disease. However, the functional impact of most variants is unknown as they occur within intrinsically disordered protein regions that have poorly defined functions1,2,3. Intrinsically disordered regions can mediate phase separation and the formation of biomolecular condensates, such as the nucleolus4,5. This suggests that mutations in disordered proteins may alter condensate properties and function6,7,8. Here we show that a subset of disease-associated variants in disordered regions alter phase separation, cause mispartitioning into the nucleolus and disrupt nucleolar function. We discover de novo frameshift variants in HMGB1 that cause brachyphalangy, polydactyly and tibial aplasia syndrome, a rare complex malformation syndrome. The frameshifts replace the intrinsically disordered acidic tail of HMGB1 with an arginine-rich basic tail. The mutant tail alters HMGB1 phase separation, enhances its partitioning into the nucleolus and causes nucleolar dysfunction. We built a catalogue of more than 200,000 variants in disordered carboxy-terminal tails and identified more than 600 frameshifts that create arginine-rich basic tails in transcription factors and other proteins. For 12 out of the 13 disease-associated variants tested, the mutation enhanced partitioning into the nucleolus, and several variants altered rRNA biogenesis. These data identify the cause of a rare complex syndrome and suggest that a large number of genetic variants may dysregulate nucleoli and other biomolecular condensates in humans.


