2020-07-22 東京大学,日本医療研究開発機構
発表者
小坂元陽奈(東京大学大学院薬学系研究科 薬科学専攻 博士課程2年)
小幡史明(東京大学大学院薬学系研究科 薬科学専攻 講師)
三浦正幸(東京大学大学院薬学系研究科 薬科学専攻 教授)
発表のポイント
- 特定の組織にネクローシス(細胞壊死)を誘導した場合に見られる、全身での炎症応答と寿命の短縮は、無菌条件下では強く抑制されることを示しました。
- 腸以外の組織の壊死が発端となり、腸内フローラが変化することで、全身性の炎症応答が増悪するという、遠隔的な宿主-細菌間相互作用の一端を新たに明らかにしました。
- 腸内フローラの乱れによる、疾患の悪性化機構のさらなる理解につながることが期待されます。
発表概要
ネクローシス(細胞壊死)は細胞内にあるべき物質を周囲に放出・拡散することで炎症応答を引き起こすことが知られており、健康状態に大きな影響を与えるとされています。しかし、その詳細な分子メカニズムは明らかになっていませんでした。
東京大学大学院薬学系研究科博士課程2年の小坂元陽奈大学院生、小幡史明講師、三浦正幸教授らは、ショウジョウバエの翅で限局的にネクローシスを誘導した時に観察される、全身性の炎症応答や個体寿命の短縮が、無菌条件下において大幅に抑制されることを見出しました。この結果は、免疫の活性化がネクローシス細胞由来の内在性因子のみならず、共生微生物によって引き起こされることを示唆します。そこで、腸内フローラ(細菌叢)を解析したところ、ネクローシス誘導個体での腸内ではGluconobacterという細菌が増殖していることが明らかになりました。Gluconobacterは、通常のショウジョウバエ個体においては免疫応答を惹起しません。しかし、ネクローシス誘導個体においては増殖したGluconobacterが過剰な炎症応答と寿命短縮を引き起こす原因細菌種であることが示されました。
本研究は、宿主-細菌間相互作用を介した病態悪化機構の一端を解明するものであり、局所壊死を発端とした全身炎症の制御に腸内フローラの正常化が重要なファクターとなる可能性を示唆しています。
発表内容
①研究の背景
炎症性の細胞死であるネクローシスは、組織の壊死を伴う様々な病態において頻繁に観察されます。ネクローシス細胞の周囲で起こる炎症応答は、細胞膜の破裂と共に周囲に放出された、本来細胞内に留まっているべき内在性の分子に対して惹起されると考えられてきました。このようなネクローシスは、それとは対照的な炎症を伴わない細胞死であるアポトーシス(注1)がうまく起こらなかった場合にも誘発されます。筆者らのグループは先行研究において、ショウジョウバエの翅上皮細胞でのみアポトーシス経路を担う分子を遺伝学的に阻害することで、ネクローシスを誘導できるモデルを確立しました。このネクローシス誘導個体では、Toll経路(哺乳類TLR経路、注2)、Imd経路(哺乳類TNFR経路、注3)の二つの自然免疫応答が、同時にかつ全身性に活性化することがわかっています。しかし、翅に起因する局所的なネクローシスが全身性の免疫活性化に至る詳細な分子機構については不明な点が数多く残されていました。
②研究内容
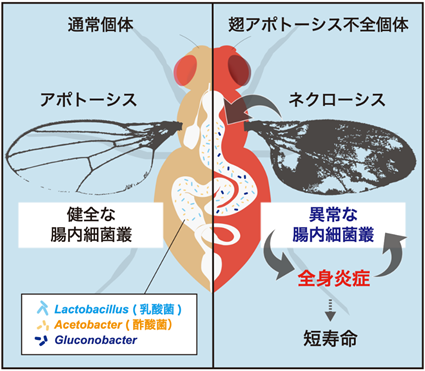
まず、ネクローシス誘導個体の免疫活性化における、腸内フローラの寄与を調べるため、ハエを無菌状態で飼育した上で自然免疫の活性化度合いを評価しました。自然免疫の活性評価には二つの免疫経路(Toll経路、Imd経路)の各々の経路の下流で誘導される、DrosomycinやDrosocinといった抗菌ペプチドの遺伝子発現を用いました。その結果、両免疫経路が無菌状態で有意に抑制されることが明らかになりました。ネクローシス誘導個体では免疫の活性化と共に、短命になるという表現型を示しますが、これも抗生物質処理によって大幅に改善することが分かりました。したがって、ネクローシスの誘導によってもたらされるこれらの病態は、腸内細菌に起因していることが示唆されます。無菌操作によって特に強く抑制されたImd経路は、腸内細菌との相互作用を持つことが知られていたため、筆者らは、ネクローシス誘導個体で起きる腸内フローラの変化が、全身性のImd経路活性化の原因になっているのではないかと考えました。ショウジョウバエの腸内細菌組成はヒトやマウスと比較すると極めて単純で、乳酸菌Lactobaciilus属と酢酸菌Acetobacter属がそのほとんどを占めています。ネクローシス誘導個体の腸内フローラ(細菌叢)を解析したところ、これらに加えて、Gluconobacter属の細菌が増殖していることを発見しました。Gluconobacterは、酢酸菌の一種であり、野生のショウジョウバエの腸内にも存在していることが報告されています。また、ネクローシスを誘導していない個体にGluconobacterを摂食させても免疫活性化を惹起しないことから、Gluconobacterは本来共生細菌の一種であると考えられました。しかしながら、ネクローシス誘導個体においては、Gluconobacterを単独で与えるだけでImd経路の過剰な活性化や短寿命といった表現型が引き起こされることから、この細菌が病態悪化の原因であることが明らかになりました(図1)。
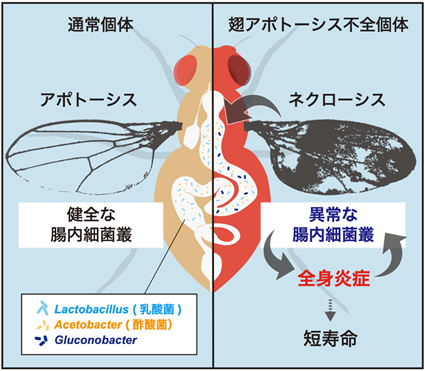
図1.ネクローシス誘導個体における全身炎症のモデル図ショウジョウバエの翅細胞のアポトーシスを抑制することで、ネクローシス(細胞壊死)が誘導され、腸内フローラ(細菌叢)のバランス失調(Gluconobacterの増殖)を介して全身炎症・短命がもたらされる。
③社会的意義・今後の予定
腸内細菌は、宿主の中に存在しながら宿主とは全く異なるゲノムを持った別個の生命体であり、その組成の変化が個体全体の健康状態を大きく左右します。しかし、腸内フローラを変化させる要因と、それが宿主にもたらす結果については未だ多くが謎に包まれています。本研究では、シンプルな腸内細菌組成を持ち、また遺伝学的な解析が容易なショウジョウバエの利点を生かして、遠隔的な組織のダメージが腸内フローラに影響し、その中の単一細菌種が病態悪化に関与していることを実験的に示しました。この結果は、これまであまり注視されていなかった腸内細菌叢の健全化が、ネクローシスを伴う病態の予後に影響する可能性を示唆しています。今後、腸組織以外での傷害が、腸内における特定の細菌の増殖を促す分子的メカニズムや、当該細菌由来の免疫惹起因子の同定をすることにより、効果的な炎症抑制を目指した医療への応用へとつながることが期待されます。
本研究は、主に国立研究開発法人日本医療研究開発機構(AMED)の革新的先端研究開発支援事業(PRIME)「微生物叢と宿主の相互作用・共生の理解とそれに基づく疾患発症のメカニズム解明」研究開発領域における研究開発課題「腸内細菌により駆動される成人病胎児起源説DOHaDの分子機構解明」、同「老化メカニズムの解明・制御プロジェクト」における分担研究開発課題「老化臨界期を決める体内機構の一環で行われました。また、文部科学省科学研究費基盤研究(S)「細胞死を起点とした細胞外コミュニケーションの発動と生理機能(16H06385)」、武田科学振興財団、持田記念医学薬学振興財団からの支援を受けて行われました。
発表雑誌
- 雑誌名:
- Cell Reports (2020) 32, 107938
- 論文タイトル:
- Local necrotic cells trigger systemic immune activation via gut microbiome dysbiosis in Drosophila
- 著者名:
- Hina Kosakamoto, Toshitaka Yamauchi, Yoriko Akuzawa-Tokita, Kei Nishimura, Tomoyoshi Soga, Takumi Murakami, Hiroshi Mori, Kyosuke Yamamoto, Ryo Miyazaki, Akiko Koto, Masayuki Miura* and Fumiaki Obata*
- DOI番号:
- 10.1016/j.celrep.2020.107938
用語解説
- (注1)アポトーシス
- カスパーゼと呼ばれるタンパク質分解酵素が活性化して実行される細胞死で、プログラム細胞死で多く見られる。速やかに細胞が除去される際に、細胞の内容物を周囲に撒き散らすこと無く細胞が死ぬため、静かな、あるいはクリーンな細胞死と呼ばれる。線虫からヒトまで高度に保存された一群のカスパーゼ活性化経路を介しているため、ショウジョウバエにおいても遺伝学的に抑制することが可能である。
- (注2)Toll経路
- ヒトにおけるToll様受容体(TLR)経路と相同性のある自然免疫経路。細菌を認識した受容体からの刺激を受けて、細胞内でNF-κB(炎症や免疫応答などにおいて中心的役割を果たす転写因子のひとつ)を活性化することで免疫応答を惹起する。ショウジョウバエでは主にグラム陽性細菌などの細胞壁構成因子であるリシン型ペプチドグリカンを認識して活性化する。ショウジョウバエの遺伝学的解析で見つかった自然免疫経路であり、2011年ノーベル生理学賞受賞の理由となった。
- (注3)Imd経路
- ヒトにおける腫瘍壊死因子受容体(TNFR)経路と相同性のある自然免疫経路。細菌を認識した受容体からの刺激を受けて、細胞内でNF-κBを活性化することで免疫応答を惹起する。ショウジョウバエでは主にグラム陰性細菌などの細胞壁構成因子であるDAP型ペプチドグリカンを認識して活性化する。腸における主要な免疫経路であり、近年では同経路の活性調節不全が腸内フローラを変化させることや、寿命を決定することが報告されている。
お問い合わせ先
研究に関すること
東京大学大学院薬学系研究科 薬科学専攻
講師 小幡史明(おばたふみあき)
事業に関すること
革新的先端研究開発支援事業
日本医療研究開発機構
シーズ開発・研究基盤事業部 革新的先端研究開発課
老化メカニズムの解明・制御プロジェクト
日本医療研究開発機構
疾患基礎研究事業部 疾患基礎研究課