2020-07-22 京都大学
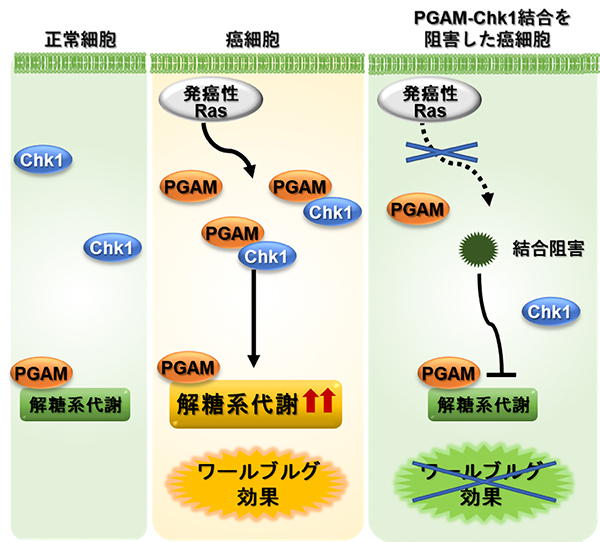
近藤祥司 医学部附属病院准教授、三河拓己 医学研究科研究員らの研究グループは、発癌における解糖系代謝亢進において、解糖系酵素ホスホグリセリン酸ムターゼ(PGAM)と結合する蛋白が重要であることを解明しました。
近年の抗癌剤は、癌の特性に注目して開発された「分子標的薬」が主流です。癌細胞では解糖系代謝が亢進し(ワ―ルブルグ効果と呼ぶ)、解糖系代謝を標的とした抗癌剤治療の可能性は古くから指摘されていました。しかし、解糖系代謝は通常細胞でも重要なエネルギー供給の代謝経路であり、単なる解糖系代謝阻害剤は副作用が大きく実用化できていませんでした。
本研究では、癌細胞では、PGAMとシグナル伝達因子であるChk1キナーゼがよく結合し、協調的に解糖系代謝を制御することを見出しました。逆にPGAMとChk1の結合を阻害すると癌の増殖や解糖系代謝が低下しました。そして、PGAMとChk1の結合による解糖系代謝亢進には、PGAMの酵素活性は関与しませんでした。以上より、癌特有のワールブルグ効果の分子機構を解明し、副作用の少ない解糖系代謝調整薬の開発の道を開きました。今回見出された「PGAMの非酵素活性」により、通常細胞の解糖系には影響の少ない形で、癌でのワールブルグ効果阻害剤の開発が期待できます。
本研究成果は、2020年6月24日に、国際学術誌「iScience」に掲載されました。

図:本研究の概要図