2020-09-03 理化学研究所
理化学研究所(理研)生命医科学研究センターゲノム免疫生物学理研白眉研究チームのニコラス・F・パリッシュ理研白眉研究チームリーダー、劉暁渓基礎科学特別研究員(研究当時)、小出りえ特別研究員、ゲノム解析応用研究チームの寺尾知可史チームリーダーらの共同研究グループは、日本人の大規模なゲノム解析を行い、一部のヒトゲノムに「ヒトヘルペスウイルス6(HHV-6)[1]」のゲノム全長に類似したDNA配列が組み込まれていることを発見しました。
本研究成果は、HHV-6とその宿主であるヒトの共進化[2]メカニズムを明らかにする上での新たな手掛かりになると期待できます。
ヒトゲノムの約8%は、「内在性ウイルス配列[3]」と呼ばれる古代のウイルス由来の配列で占められており、その多くは数百万年前にヒトの祖先のゲノムに入り込んだと考えられています。
今回、共同研究グループは、日本人7,485人の全ゲノム配列を解析した結果、日本人の約200人に1人がゲノムにHHV-6由来のDNA(内在性HHV-6)の配列を持つことを明らかにしました。これらの内在性HHV-6配列は、約3万年前に東アジア人の祖先のゲノムに入り込んだと考えられます。また、内在性HHV-6配列のほとんどは、ゲノムの複製や老化に関連するとされるテロメア[4]領域に組み込まれていることが分かりました。
本研究は、オンライン科学雑誌『PLoS Genetics』(8月10日付)に掲載されました。
背景
ヒトゲノムの約8%は、「内在性ウイルス配列」と呼ばれる古代のウイルス由来の配列で占められており、その多くは数百万年前にヒトの祖先のゲノムに入り込んだと考えられています。当初、ゲノム中の内在性ウイルス配列は機能を持たない、いわゆる”ジャンクDNA”だと考えられていました。しかし最近の研究により、内在性ウイルス配列の一部が、胎盤形成や神経伝達に関与することや、病原性ウイルスの感染を防御する因子として働く場合があることが分かってきました。
内在性ウイルス配列のほとんどは、生活環の中で宿主ゲノムに組み込まれる性質を持つレトロウイルス[5]に由来しています。ヒトゲノムに存在する非レトロウイルス型の内在性ウイルス配列としては、RNAウイルスであるボルナ病ウイルスに関連するウイルス配列が知られていました。
今回共同研究グループは、一部のヒトゲノムから非レトロウイルス型の内在性ウイルス配列である内在性HHV-6を見つけました。内在性HHV-6は、突発性発疹の原因ウイルスであるHHV-6に由来するDNA配列です。HHV-6は、免疫抑制などによって再活性化することが知られており、さまざまな神経疾患との関連が指摘されています。
研究手法と成果
共同研究グループは、日本で最大級の全ゲノムプロジェクトであるバイオバンク・ジャパン[6]によって集められた日本人7,485人の全ゲノム配列を解析したところ、ヒトゲノム中にヒトヘルペスウイルス6(HHV-6)のゲノム全長に類似したDNA(内在性HHV-6)の配列を発見しました。
次に、内在性HHV-6配列と現存のHHV-6配列がどのように関連するかを解析しました。その結果、内在性HHV-6配列の一つが、現代の中国人と日本人のゲノムにおいて、同じ染色体ゲノム上の位置に組み込まれていることが明らかになりました。HHV-6は、中国大陸と日本列島が陸続きだった約3万年前に、中国人と日本人の共通祖先のゲノムに組み込まれ、その後、縄文時代(約1万6,000年前~3,000年前)に内在性HHV-6をゲノムに持つ日本人が日本に渡ったと考えられます(図1)。このことは、数万年もの間、内在性HHV-6がヒト染色体と共進化してきたことを示しています。
また、これらの古代ウイルスの配列は、ヒトゲノムのテロメア領域に挿入されていることが分かりました(図1)。テロメアとは染色体の末端部にある塩基配列で、その長さはヒトの老化に関係していると考えられています。テロメアは主に6塩基の繰り返し配列から構成され、繰り返しの多い配列は従来のシーケンス法による決定が難しいため、今回共同研究グループは長鎖DNAの解析を得意とするナノポアシーケンス技術[7]を用いて、内在性HHV-6のヒトゲノム上の位置を同定しました。
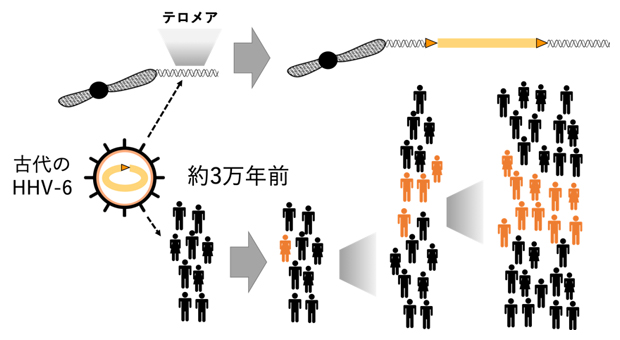
図1 ヒトヘルペスウイルス6(HHV-6)の内在化過程
ヒト染色体 (上) とヒト集団 (下) から見たHHV-6の内在化を表す。
上:古代にHHV-6のゲノムが、テロメアと呼ばれる染色体の末端部に組み込まれた。
下:祖先のヒト集団では、ほとんどのヒトはゲノムにHHV-6を持っていなかった。しかし、約3万年に一部のヒトがHHV-6に感染し、HHV-6のゲノムがヒト染色体に組み込まれたと考えられる。ゲノムに組み込まれたHHV-6は、遺伝情報として親から子へと伝わり、やがて多くのヒトが内在性HHV-6をゲノムに保持することになる。
HHV-6は、塩基配列や抗原性、細胞指向性[8]の違いから二つの種類(HHV-6A、HHV-6B)に分類されますが、興味深いことにHHV-6AとHHV-6Bは、どちらも同じ22番染色体の長腕のテロメア領域に挿入されていました。このゲノム挿入部位の選択性についてはまだ詳しく分かっていませんが、HHV-6配列がこの領域に挿入されることでテロメアの長さが維持され、DNA損傷が回避されるなど、宿主であるヒトにとって有利に働いている可能性が考えられます。
また、一部のヒトゲノムに、内在性HHV-6が過去に組換え[9]を起こして再活性化した痕跡が残されていることも明らかになりました(図2)。先行研究で、in vitro(試験管内)で内在性HHV-6が再活性化し、その痕跡として細胞のゲノムにウイルスゲノムの一部が残されていることが報告されていました注1)。しかし、ヒトゲノムに内在性HHV-6再活性化の痕跡を直接見いだしたのは、今回が初めてです。今回、ヒトゲノムに入り込んだHHV-6がヒト染色体内部で組換えを起こし、感染性を回復し得る可能性が示されたことから、今後、内在性HHV-6再活性化のリスクをより詳しく調べる必要があると考えられます。
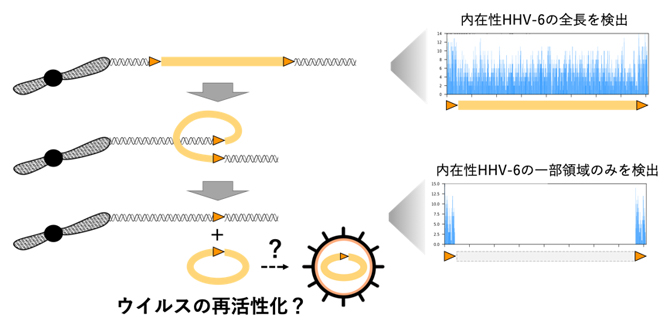
図2 HHV-6再活性化の概念図
HHV-6は、ゲノムの両端にDR(direct repeat)と呼ばれる同一の配列(オレンジ三角形)を持つ。組換えの過程で、DRの間に存在するウイルスゲノムの大部分の配列(黄色線)が切断されることが分かっている。先行研究で、in vitro(試験管内)でHHV-6の組換えが起こることが示されており、ウイルスゲノムの組換えが潜伏感染から感染性HHV-6が再活性化する機構の一つの過程であると考えられている。今回、ヒトゲノムに「solo-DR」と名付けたウイルスゲノムの一部(オレンジ三角形)が残されていることを発見した。この内在性HHV-6は、全ゲノム配列のリードをウイルスゲノムにマッピングした際に、特徴的なパターンを示す(右下)。
注1)Huang, Y et al, Human telomeres that carry an integrated copy of human herpesvirus 6 are often short and unstable, facilitating release of the viral genome from the chromosome. Nucleic Acids Res. 2014; 42, 315-327
今後の期待
本研究成果は、HHV-6とヒトの共進化メカニズムを解き明かす上で、新たな手掛かりになると考えられます。また、今後、生体内での内在性HHV-6の役割を詳しく解析することで、内在性HHV-6のウイルス感染防御や老化における新たな機能の発見にもつながると期待できます。
今回、一部のヒトゲノムに、内在性HHV-6が組換えによって再活性化した痕跡が残されていることが示されました。しかし内在性HHV-6がどのような機序で染色体内から再活性化するのか、また再活性化したウイルスがどのような病態と関連するかについては、未解明の点が多く残されています。今後の研究で、内在性HHV-6が疾患発症のリスク因子となる可能性をより詳しく調べる必要があると考えられます。
補足説明
1.ヒトヘルペスウイルス6
ロゼオロウイルス属に分類される、二本鎖DNAをゲノムに持つウイルス。小児期にほとんどのヒトが感染する突発性発疹の主な原因とされ、90%以上の成人の体内に潜伏感染していると考えられている。HHV-6の再活性化は、脳炎、アルツハイマー病、多発性硬化症を含む多くの神経疾患との関連が示唆されている。
2.共進化
異なる二つ以上の種が相互作用しながら共に進化すること。
3.内在性ウイルス配列
過去に感染したウイルスが宿主の生殖細胞ゲノムに入り込み、ゲノムの一部として子孫に遺伝されるようになったウイルス由来配列。代表的なものに内在性レトロウイルスがある。
4.テロメア
6塩基の繰り返し配列からなる染色体の末端部にある構造。ゲノム複製や老化に重要であると考えられている。テロメラーゼによるテロメアの伸長は、2009年にノーベル生理学医学賞の受賞対象となった。
5.レトロウイルス
逆転写酵素をもつ1本鎖RNAウイルス。レトロウイルスは複製の過程で、逆転写酵素によってウイルスゲノムRNAをDNAに変換し、宿主のゲノムに入り込むという特徴を持つ。
6.バイオバンク・ジャパン
世界最大級の疾患バイオバンク。ゲノムDNAや血清サンプルを収集し、研究者へ試料やデータの提供を行っている。現在は東京大学医科学研究所内に設置されている。
7.ナノポアシーケンス技術
Oxford Nanopore Technologies社が提供するシーケンス解析技術。膜にナノポアと呼ばれるナノサイズの穴が埋め込まれており、ナノポアをDNA分子が通り抜けるときに生じる電流の変化によって、塩基配列を解析できる。
8.細胞指向性
ウイルスがどの細胞に効率良く感染するかという標的細胞への親和性のこと。
9.組換え
二つの類似した塩基配列の間で、互いの配列が入れ替わること。
共同研究グループ
理化学研究所 生命医科学研究センター
ゲノム免疫生物学理研白眉研究チーム
チームリーダー ニコラス・F・パリッシュ(Nicholas F.Parrish)
(理研 開拓研究本部 Parrishゲノム免疫生物学理研白眉研究チーム 理研白眉研究チームリーダー)
基礎科学特別研究員(研究当時) 劉 暁渓(リュウ・ギョウケイ)
(現 ゲノム解析応用研究チーム 研究員)
特別研究員 小出 りえ(こいで りえ)
特別研究員 アンセルモ 鎌田 治郎(Anselmo Kamada Jiro)
ゲノム解析応用研究チーム
チームリーダー 寺尾 知可史(てらお ちかし)
研究員 小杉 俊一(こすぎ しゅんいち)
特別研究員(研究当時) 的場 奈々(まとば なな)
がんゲノム研究チーム
チームリーダー 中川 英刀(なかがわ ひでわき)
上級研究員 藤田 征志(ふじた まさし)
基盤技術開発研究チーム
チームリーダー 桃沢 幸秀(ももざわ ゆきひで)
副センター長 久保 充明(くぼ みちあき)
理化学研究所革新知能統合研究センター
遺伝統計学チーム
チームリーダー 田宮 元(たみや げん)
研究員 松崎 素道(まつざき もとみち)
藤田医科大学医学部 小児科学
教授 吉川 哲史(よしかわ てつし)
講師 河村 吉紀(かわむら よしき)
助教 三浦 浩樹(みうら ひろき)
東京大学医科学研究所 感染症国際研究センタ― 感染制御系システムウイルス学分野
准教授 佐藤 佳(さとう けい)
博士研究員 伊東 潤平(いとう じゅんぺい)
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 クリニカルシークエンス分野
教授 松田 浩一(まつだ こういち)
東京大学医科学研究所 人癌病因遺伝子分野
教授 村上 善則(むらかみ よしのり)
東京大学大学院理学系研究科 生物科学専攻生物学科
准教授 大橋 順(おおはし じゅん)
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 複雑形質解析分野
教授 鎌谷 洋一郎(かまたに よういちろう)
ドイツベルリン自由大学 ウイルス学研究所
博士研究員 アムル・アスワッド(Amr Aswad)
原論文情報
Liu, X., Kosugi, S., Koide, R., Kawamura, Y., Ito, J., Miura, H., Matoba, N., Matsuzaki, M., Fujita, M., Kamada, A.J., Nakagawa, H., Tamiya, G., Matsuda, K., Murakami, Y., Kubo, M., Sato, K., Momozawa, Y., Ohashi, J., Terao, C., Yoshikawa, T., Parrish, N.F., Kamatani, Y., “Endogenization and excision of human herpesvirus 6 in human genomes”, PLoS Genetics, 10.1371/journal.pgen.1008915
発表者
理化学研究所
生命医科学研究センター ゲノム免疫生物学理研白眉研究チーム
理研白眉研究チームリーダー ニコラス F・パリッシュ(Nicholas F. Parrish)
(理研 開拓研究本部 Parrishゲノム免疫生物学理研白眉研究チーム 理研白眉研究チームリーダー)
基礎科学特別研究員(研究当時) 劉 暁渓(リュウ・ギョウケイ)
特別研究員 小出 りえ(こいで りえ)
ゲノム解析応用研究チーム
チームリーダー 寺尾 知可史(てらお ちかし)
報道担当
理化学研究所 広報室 報道担当