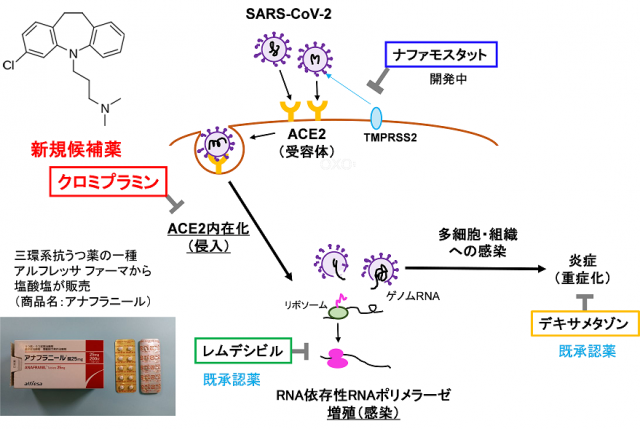
2021-03-18 理化学研究所,東京工業大学
理化学研究所(理研)開拓研究本部田中生体機能合成化学研究室の田中克典主任研究員(東京工業大学物質理工学院応用化学系教授)、チャン・ツンチェ特別研究員らの研究チームは、生体内に導入できる「人工金属酵素[1]」によって薬剤の骨格を構築できる遷移金属触媒反応[2]を開発しました。
本研究成果は、生体内の疾病標的部位で薬効を示す化合物を合成する可能性を示しており、「プロドラッグ[3]」の新たな戦略としての応用が期待できます。
遷移金属触媒や人工金属酵素を生体内に導入し、生体内で触媒反応を行うことで、疾病部位で選択的に薬剤の活性を向上させる研究が注目を集めています。特に、可溶性タンパク質のアルブミンと遷移金属触媒を複合化させた人工金属酵素は、生体内環境でも触媒活性を示すことが知られています。
今回、研究チームは、アルブミンに金(Au)触媒を導入した人工金属酵素を開発し、この人工金属酵素が強い細胞毒性を示すフェナントリジニウム構造を形成する化学反応を触媒できることを示しました。また実際に、がん細胞でこの化学反応を行うことで薬効を示す化合物を合成した結果、がん細胞に対する増殖抑制効果を示すことが明らかになりました。
本研究は、科学雑誌『Angewandte Chemie, International Edition』の掲載に先立ち、オンライン版(3月14日付)に掲載されました。
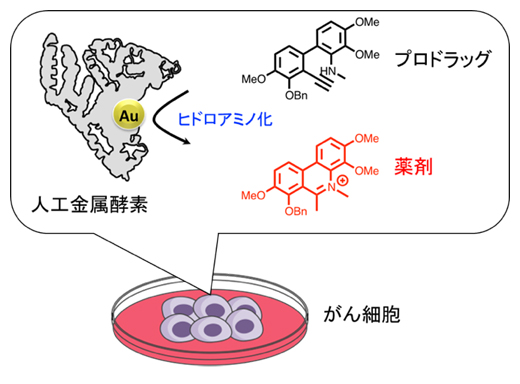
アルブミンと金触媒からなる人工金属酵素を用いたがん細胞での薬剤合成
背景
薬剤を用いた治療において、薬剤が疾病部位以外の場所に作用することは、副作用の発生につながります。そのため、疾病部位で選択的に薬剤の効能を向上させる上で、「プロドラッグ」を用いた戦略が近年注目されています。プロドラッグは、生体内の標的部位における化学反応によって薬効が向上する薬剤であり、副作用を軽減させるための戦略として用いられています。これまでのプロドラッグでは、保護基[4]を導入して活性を低下させた薬剤を生体内に投与し、標的部位における生体内反応によって保護基を除去することで、薬剤の活性を復活させる戦略がとられてきました(図1A)注1)。
しかしこの戦略は、アミノ基やヒドロキシ基といった保護基を導入できる官能基を持つ薬剤にしか利用できず、多くの薬剤はこのような官能基を持っていないという問題点がありました。そのため、プロドラッグの適用範囲を広げるには、薬剤の新たな活性化手法を開発する必要がありました。
今回、研究チームは、「生体内金属触媒によって薬剤の骨格を構築させることで活性を制御する」という新たなプロドラッグ活性化の実現を目指しました(図1B)。
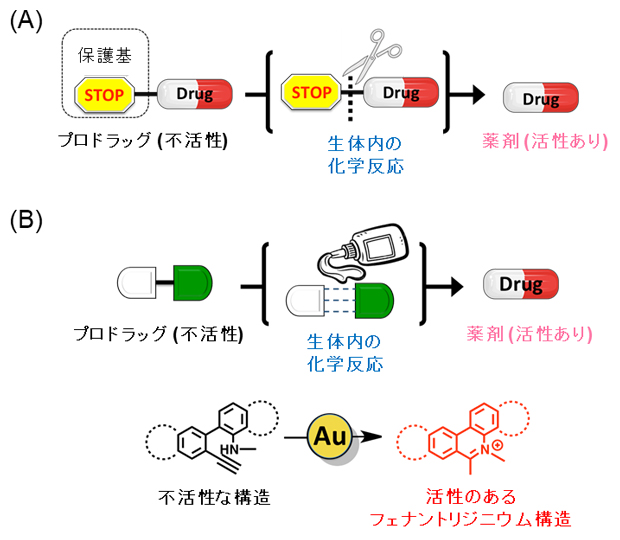
図1 従来のプロドラッグ戦略と新たなプロドラッグ戦略
(A)これまでのプロドラッグの活性化。保護基の脱離反応を用いる。
(B)新たなプロドラッグの活性化。薬剤分子の骨格構築により、保護基を導入する官能基がなくてもプロドラッグを活性化できる。
注1)2020年9月2日プレスリリース「生体内の金属触媒反応で薬効と物性を制御する」
研究手法と成果
フェナントリジニウム構造を持つ化合物は、細胞のDNAに結合することで細胞増殖を抑制することが知られています。そこで研究チームは、アルキン(三重結合を持つ化合物)とアミン(アンモニアの水素を炭化水素基などで置換した化合物)を持った前駆体構造を、金(Au)触媒によってヒドロアミノ化反応を起こさせ、がん細胞でフェナントリジニウム構造を合成する戦略を考案しました。
さまざまな前駆体を用いて調べた結果、生体内と似た環境である緩衝液中や細胞培養液中において、さまざまな金触媒を加えた条件でヒドロアミノ化反応が速やかに進行することが分かりました(図2A)。また、細胞毒性を示す薬剤2を、毒性を示さないプロドラッグ1から合成することにも成功しました(図2B)。
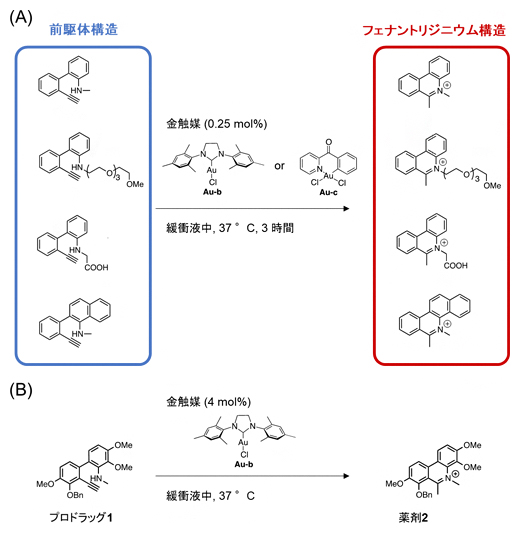
図2 金触媒によるフェナントリジニウム構造の構築
(A)緩衝液中で進行したヒドロアミノ化反応。
(B)緩衝液中において一般的な金触媒(Au-b)を用いると、三重結合を持つプロドラッグ1がヒドロアミノ化反応によりフェナントリジニウム構造を持つ薬剤2へ変換された。
実際にこの化学反応によって、A549細胞(ヒト肺胞基底上皮腺がん細胞)[5]にプロドラッグ1と金触媒(Au-1)を作用させる実験を行いました。その結果、プロドラッグ1のみを作用させたがん細胞やAu-1のみを作用させたがん細胞では、細胞の増殖が阻害されなかったのに対し、プロドラッグ1とAu-1の両方を作用させたがん細胞では、細胞増殖が抑制されました(図3)。これは、がん細胞存在下においてもAu-1によってプロドラッグ1が薬剤2に変換されたためです。
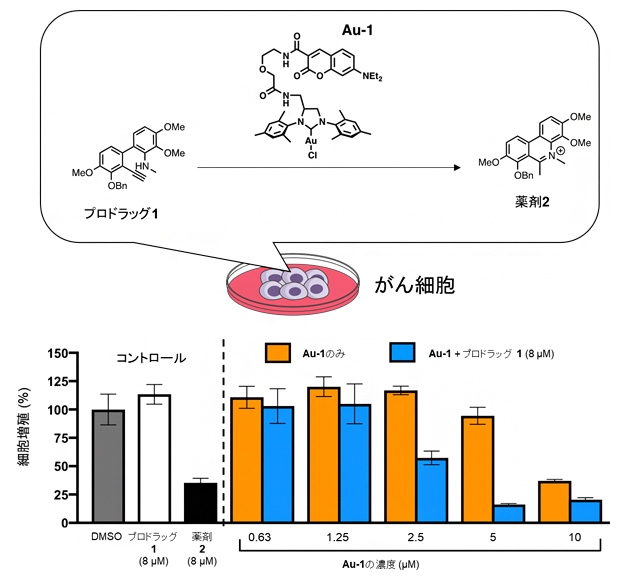
図3 がん細胞存在下でのプロドラッグから薬剤への変換
プロドラッグ1のみを作用させたがん細胞(白)や金触媒(Au-1)のみを作用させたがん細胞(オレンジ)は増殖が阻害されなかった。一方、プロドラッグ1とAu-1の両方を作用させたがん細胞(青)は増殖が抑制された。
しかし、これまでの実験で用いられてきた金触媒は、グルタチオン[6]などの生体内分子とも反応するため、生体内では触媒活性が低下するという問題点があります。上記の実験でも、がん細胞で薬剤を合成するためには、プロドラッグ1の50%以上の濃度の金触媒(Au-1)を細胞に作用させる必要がありました。一方で、これまで研究チームは、可溶性タンパク質のアルブミンとルテニウム触媒を複合化した人工金属酵素が、グルタチオンなどが多く存在する生体内に似た環境でも触媒活性を保つことを報告しています注2)。そこで、この手法を応用し、Au-1を導入した人工金属酵素を開発することにしました。
Au-1は疎水性リガンド[7]であるN-ジエチルアミノクマリン構造を持つことから、アルブミンの疎水性ポケットに配位し、アルブミンと金の複合体を形成することができました(図4A)。アルブミン・金複合体はヒドロアミノ化反応を触媒したことから、Au-1を活性中心に持つ「人工金属酵素albumin-Au-1」の開発に初めて成功しました。
さらに、一般的な金触媒(Au-b)では、グルタチオンやアルギニンなどの生体内低分子によって触媒活性が低下する一方、albumin-Au-1を用いた条件では、これらの低分子や細胞溶解液を加えても触媒活性が低下しませんでした(図4B)。このことから、開発したalbumin-Au-1が生体内や細胞内においても触媒活性を保つ可能性が示されました。albumin-Au-1ではAu-1の活性中心が疎水性ポケットに保護されているため、親水性の生体内低分子が反応できないのに対し、疎水性の基質はalbumin-Au-1と反応できるために、生体内低分子の存在下でも化学反応が進行すると考えられます。
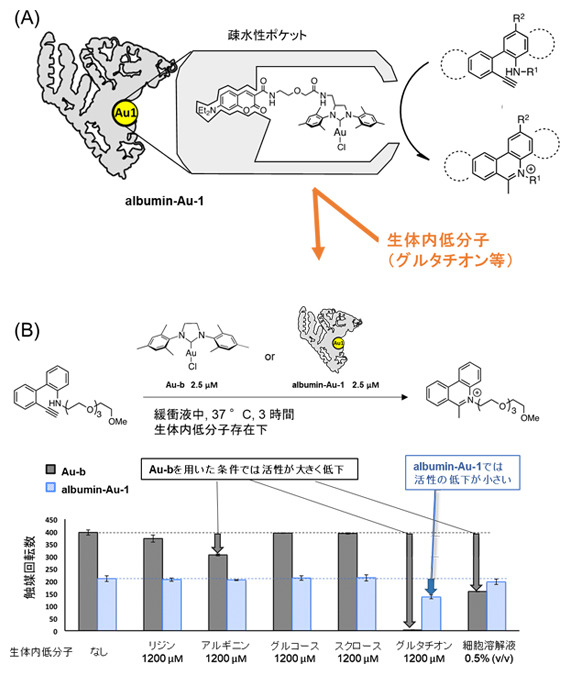
図4 金触媒を用いたアルブミン人工金属酵素の開発
(A)アルブミンタンパク質と金触媒(Au-1)を用いた人工金属酵素(albumin-Au-1)は、グルタチオンなどの生体内低分子の影響を受けず、アミノヒドロ化反応を起こす。
(B)生体内低分子の金触媒反応への影響。一般的な金触媒(Au-b)では、アルギニンやグルタチオンや細胞溶解液によって触媒活性が低下した。しかし、albumin-Au-1を用いた条件では、触媒活性が低下しなかった。
次に、albumin-Au-1をプロドラッグ1とともにA549がん細胞に作用させたところ、albumin-Au-1のみを用いた条件よりも低濃度でプロドラッグ1を活性化し、細胞増殖を抑制できることが分かりました(図5)。
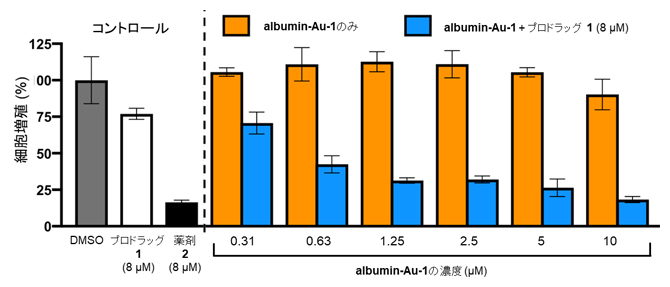
図5 人工金属酵素を用いたがん細胞での薬剤合成
プロドラッグ1のみを作用させた細胞(白)や人工金属酵素(albumin-Au-1)のみを作用させたがん細胞(オレンジ)では、細胞の増殖が阻害されなかったのに対し、albumin-Au-1とプロドラッグ1の両方を作用させたがん細胞(青)では、細胞増殖が抑制された。
注2)2019年7月2日プレスリリース「触媒的「現地合成」によるがん治療」
今後の期待
今回の研究では、金触媒によって薬剤の骨格を生体内で構築するという新たなプロドラッグ戦略を開発しました。従来のプロドラッグ戦略は、保護基を導入できる薬剤にしか適用できませんでした。一方で、今回開発した手法では保護基を導入する官能基がなくても、薬剤の骨格を直接構築することで薬効を制御できるため、プロドラッグ戦略の適用範囲を広げることができます。
さらに、生体内に導入可能な人工金属酵素によっても、このプロドラッグの活性化が行えることが本研究で示されました。アルブミンを用いた人工金属酵素は、酵素の表面を糖鎖修飾することで標的細胞に選択的に輸送されることが明らかになっています注3-5)。今後、生体内の標的細胞に輸送された人工金属酵素で今回の化学反応を行うことができれば、生体内のがん細胞で薬剤を合成することも可能になると考えられます。
注3)2017年2月15日プレスリリース「狙った臓器で金属触媒反応を実現」
注4)2018年7月4日プレスリリース「がんを糖鎖のパターンで認識」
注5)2020年10月21日プレスリリース「糖鎖の不均一性を秩序よく高次化してがんを見つける」
補足説明
1.人工金属酵素
タンパク質と金属触媒で複合体を形成させ、天然のタンパク質では触媒できない化学反応を触媒できるようにした酵素。金属触媒の活性中心がタンパク質内の疎水性ポケット内に配置されることを利用して、生体内の低分子による不活性化を回避することで、生体内でも金属触媒の活性を保持できる人工金属酵素も開発されている。
2.遷移金属触媒反応
周期表の第3族から第11族までに属する遷移金属元素により触媒される化学反応。これらの元素は特定の官能基に対して強い親和性を示すため、さまざまな有機化学反応を触媒することが知られている。
3.プロドラッグ
生体内の薬剤標的部位での化学反応によって、薬効を示す分子に変換されるようにデザインされた薬剤。標的部位選択的に活性を示すことから副作用の軽減が期待できる。標的部位での化学反応には、生体内の酵素による触媒反応や生体内の低分子との反応が主に用いられる。また、近年は生体内に導入した遷移金属触媒によって分子の変換を行う研究も進められている。
4.保護基
反応性の高い官能基に導入することで、反応性を低下させられる官能基。有機合成においては、特定の官能基の反応性を低下させて副反応を防ぐために用いられる。また、プロドラッグの戦略としては、薬剤の活性を一時的に低下させるためにも用いられる。
5.A549がん細胞
ヒト肺胞基底上皮腺がん細胞株。がん細胞のモデル株として試験管内の実験などに多く用いられる。
6.グルタチオン
グルタミン酸、システイン、グリシンからなるトリペプチド。細胞内に高濃度で存在し、活性酸素種や生体分子と反応することで細胞を守るなど、生命維持に重要な役割を果たしている。
7.リガンド
特定の生体分子と結合することで、生理的な作用を発揮する物質のこと。一般的には受容体に結合する分泌因子(ホルモンや成長因子など)を指すことが多い。
研究チーム
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(東京工業大学 物質理工学院 応用化学系 教授)
特別研究員 チャン・ツンチェ(Chang Tsung-che)
研究員 ケンワード・ヴォン(Kenward Vong)
特別研究員 山本 智也(やまもと ともや)
研究支援
本研究は、日本医療研究開発機構 (AMED) 先端的バイオ創薬等基盤技術開発事業「糖鎖付加人工金属酵素による生体内合成化学治療(領域代表者:田中克典)」による支援を受けて行われました。
原論文情報
Tsung-che Chang, Kenward Vong, Tomoya Yamamoto, and Katsunori Tanaka, “Prodrug activation by gold artificial metalloenzyme-catalyzed synthesis of phenanthridium derivatives via hydroamination”, Angewandte Chemie, International Edition, 10.1002/anie.202100369
発表者
理化学研究所
開拓研究本部 田中生体機能合成化学研究室
主任研究員 田中 克典(たなか かつのり)
(東京工業大学 物質理工学院 応用化学系 教授)
特別研究員 チャン・ツンチェ(Chang Tsung-che)
報道担当
理化学研究所 広報室 報道担当
東京工業大学 総務部 広報課