2021-04-02 京都大学iPS細胞研究所,日本医療研究開発機構
ポイント
- 骨格筋幹細胞注1)を純化するための細胞表面にある目印としてCDH13とFGFR4を見出した
- 純化した細胞は移植した筋ジストロフィーモデルマウスの筋肉を再生した
- 今回の純化方法は骨格筋の細胞移植治療に有用と考えられる
要旨
Nalbandian Minas大学院生(CiRA臨床応用研究部門)、櫻井英俊准教授(CiRA臨床応用研究部門)らの研究グループは、ヒトiPS細胞から骨格筋幹細胞へと分化誘導する際に有用な2つの新たなマーカーとしてCDH13およびFGFR4を見出しました。
デュシェンヌ型筋ジストロフィー(DMD)のような骨格筋疾患の治療法として期待されるものの一つに、ヒトiPS細胞から作製した骨格筋幹細胞の移植があります。しかし、その医療応用には、骨格筋幹細胞の純度を高める方法の開発が必要です。本研究ではMYF5遺伝子の発現を骨格筋分化の指標として、骨格筋を形成する能力のある細胞を選別する2つのマーカーとして、CDH13とFGFR4を見出しました。それぞれのマーカーをもとに選択された細胞は、マウスに移植すると骨格筋を効率よく再生し、DMDモデルマウスの体内で、ジストロフィンの発現を回復させました。これらの結果から、CDH13とFGFR4が、骨格筋幹細胞を純化するマーカーとして有力な候補であると考えられます。
この研究成果は2021年4月2日(日本時間)に「Stem Cell Reports」で公開されます。
研究の背景
DMDは、筋肉にあるジストロフィンというタンパク質が欠損することによって発症する進行性の重篤な筋疾患で、根本的な治療法は開発されていません。ジストロフィンを骨格筋に再生する方法として、細胞移植治療が期待されています。
私たちの体の中では日々、筋肉の再生が行われています。その際、骨格筋のそばに存在しているサテライト細胞注2)と呼ばれる細胞が、骨格筋の再生や修復に重要な役割を果たしています。よって、サテライト細胞を使った再生医療が試みられてきましたが、サテライト細胞を採取することは難しく、採取出来たとしてもそれを増やすことが困難であり、今まで実現に至っていません。そのため、iPS細胞などから人工的に骨格筋幹細胞をつくる方法が期待されています。櫻井准教授らの研究グループはこれまでに、筋再生能の高い骨格筋幹細胞を分化させる方法を開発しています(2020年7月3日CiRAニュース「筋ジストロフィーモデルマウスにおけるヒトiPS細胞由来骨格筋幹細胞の移植効果を確認」)。しかし、iPS細胞から骨格筋幹細胞を作成する過程で多数のほかの種類の細胞ができてしまうため、臨床応用をする上では、より高い純度で必要な細胞だけ選別する技術が必要でした。これまでにも純化する方法はいくつか報告がありましたが、実際に動物モデルへの移植を行うと、混ざってしまったほかの細胞の影響で線維化するなど、正常な筋再生が起こりませんでした。そこで本研究では、より高度に純化するためのマーカーを探しました。
研究結果
1.筋再生能をもった細胞表面で働くマーカータンパク質の同定
骨格筋幹細胞へ分化した細胞と分化する前の細胞とで遺伝子の発現を比較し、骨格筋幹細胞の表面で特徴的に発現しているタンパク質として、CDH13およびFGFR4を見出しました。
DMD患者さんから作製したiPS細胞(DMD)と、その細胞をゲノム編集により遺伝子を修復したiPS細胞(DMD-corrected)から、それぞれ骨格筋幹細胞へと分化誘導し、FGFR4陽性細胞(FGFR4+)と陰性細胞(FGFR4-)に分離しました。FGFR4+はFGFR4-と比べて筋細胞への分化が効率よく起きていることが確認できました。また、遺伝子を修復した細胞ではジストロフィンタンパク質(DYSTROPHIN)も検出されました(図1)。
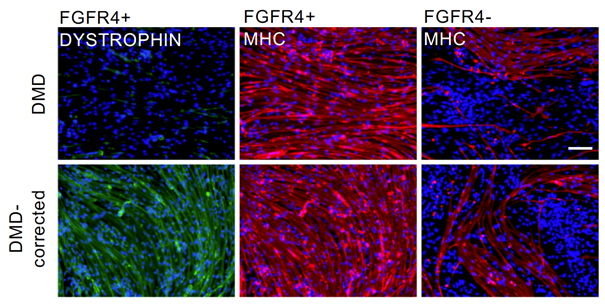
図1 FGFR4陽性細胞の筋分化能力(in vitro)FGFR4-と比べてFGFR4+の方がMHC(筋肉の分化を示すミオシン重鎖、赤色)の量が多く、筋細胞への分化効率がよい。また、遺伝子修復した細胞では、FGFR4+でジストロフィンタンパク質(緑色)が検出された。図中のバーは200μmを示す。
また、CDH13についても同様の結果が得られました。CDH13およびFGFR4を指標として純化した細胞は、細胞レベルで十分な筋分化能力を持ち、遺伝子を修復したDMD患者由来iPS細胞を用いた場合に、ジストロフィンタンパク質の発現も回復していることが示されました。
2.DMDモデルマウスでの筋再生
CDH13およびFGFR4を指標に純化した細胞が、細胞治療で使用可能かどうか調べるために、CDH13陽性細胞(CDH13+)あるいはFGFR4陽性細胞(FGFR4+)をDMDのモデルマウスに移植し、生着したかどうかを調べました。その結果、陰性細胞と比べて高い効率で生着していることがわかりました。さらに、DMD遺伝子を修復した細胞では、ジストロフィンタンパク質の発現もみられました。
また、CDH13あるいはFGFR4陽性細胞を移植すると、生体内のサテライト細胞と同様に、基底膜注3)の内部に存在していることがわかりました(図2)。また、幹細胞に特徴的な遺伝子である、PAX7の発現が見られ、骨格筋幹細胞として働いていると期待されます。これらの結果から、移植した細胞は骨格筋幹細胞のプールとして働いていると考えられます。CDH13およびFGFR4は細胞治療の可能性を持った筋再生細胞を効率よく純化できるマーカーであることが示されました。
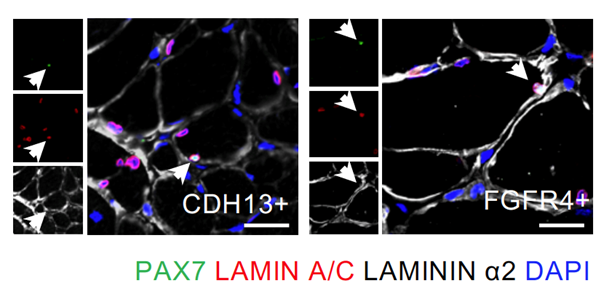
図2 CDH13陽性細胞およびFGFR4陽性細胞の生着移植した細胞(青色)のうち一部は、Pax7(緑色)陽性の細胞があり、基底膜(LAMININ α2)(白色)の中に存在している。
3.CDH13およびFGFR4とほかのマーカーとの比較
PAX7の発現量を指標に細胞の純化の度合いを比較したところ、CDH13やFGFR4はこれまでのマーカーと比べて高い純化効率となり、FGFR4では約95%の濃縮効率が得られました(図3)。
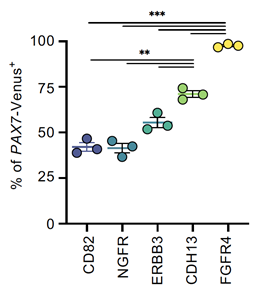
図3 純化度合いの比較
本研究の意義と今後の展望
DMDの進行に伴って失われるジストロフィンを補うために、細胞移植療法が注目されていますが、これまでの細胞では純度が低く、安全性と治療効果は見いだされていませんでした。今回、CDH13およびFGFR4をマーカーとして細胞を純化することで、筋再生能をもった細胞を高い純度で得ることができました。この結果は、骨格筋に関する細胞移植医療の実現に貢献すると期待されます(図4)。
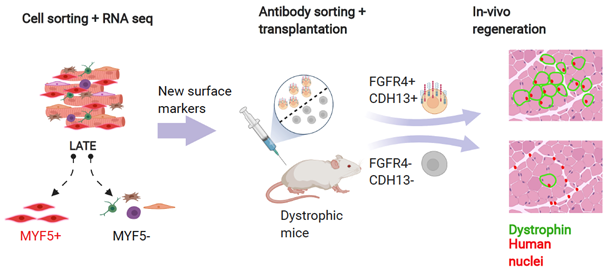
図4 本研究の概要
論文名と著者
- 論文名
- “Characterization of hiPSC-Derived Muscle Progenitors Reveals Distinctive Markers for Myogenic Cell Purification Toward Cell Therapy”
- ジャーナル名
- Stem Cell Reports
- 著者
- Minas Nalbandian1, Mingming Zhao1, *, Mitsuru Sasaki-Honda1, Tatsuya Jonouchi1, Antonio Lucena-Cacace1, Takuma Mizusawa2, Masahiko Yasuda2, Yoshinori Yoshida1, Akitsu Hotta1, and Hidetoshi Sakurai1, * *責任著者
- 著者の所属機関
-
- 京都大学iPS細胞研究所(CiRA)
- 公益財団法人 実験動物中央研究所
本研究への支援
本研究は、下記機関より資金的支援を受けて実施されました。
国立研究開発法人日本医療研究開発機構(AMED)再生医療実現拠点ネットワークプログラム
「iPS細胞研究中核拠点」「疾患特異的iPS細胞の利活用促進・難病研究加速プログラム」
用語説明
- 注1)骨格筋幹細胞
- 骨格筋系の細胞へと分化することができる幹細胞。
- 注2)サテライト細胞
- 骨格筋系幹細胞のうち、生体内で筋線維の外側に張り付いている成人型の細胞。
- 注3)基底膜
- 細胞層と細胞層の間に存在する薄い膜。
お問い合わせ先
京都大学iPS細胞研究所(CiRA)
国際広報室 和田濵
AMED事業に関するお問い合わせ先
日本医療研究開発機構
再生・細胞医療・遺伝子治療事業部 再生医療研究開発課