2021-09-09 理化学研究所,千葉大学
理化学研究所(理研)生命医科学研究センター免疫器官形成研究チームの古関明彦チームリーダー(千葉大学大学院医学研究院細胞分子医学教室教授)、椙下紘貴特別研究員(研究当時、千葉大学大学院医学研究院細胞分子医学教室大学院生)らの国際共同研究グループは、エピジェネティクス[1]因子の「ポリコム複合体[2]」の一つである「PRC1.1[2]」が細胞分化時における転写抑制に重要であることを発見しました。
本研究成果は、ES細胞[3]やiPS細胞[3]において細胞分化のコントロールが必要な再生医療やがん・疾患などの理解につながり、治療法開発の基礎的知見になると期待できます。
ポリコム複合体は、発生や分化に関わる遺伝子の転写抑制に重要であることは明らかになっていましたが、それらの遺伝子が転写抑制されるメカニズムについてはよく分かっていませんでした。
今回、国際共同研究グループは、ポリコム複合体の一つであるPRC1.1の構成因子であるPCGF1[4]を欠損させたES細胞を胚様体[5]に分化させることで、ポリコム複合体の一つであるPRC1.1が細胞分化時に起こる転写抑制状態の形成に重要であることを発見しました。
本研究は、オンライン科学雑誌『Nature Communications』(9月9日付)に掲載されます。
背景
分化・発生において、ゲノムDNAのユークロマチン領域[6]の遺伝子が適切に転写抑制されることが細胞の運命決定に重要です。細胞の状態が変わるとき、必要な遺伝子の転写はオンになり、不要な遺伝子の転写はオフに切り替わります。その転写抑制に重要な役割を担う因子の一つとして知られているのが「ポリコム複合体」です。
細胞分化や発生に関連する重要な遺伝子の多くは、ゲノムDNA上のプロモーター[7]にCpGアイランド(シトシンとグアニンが連続する配列を多く含む領域)と呼ばれる部分を持っています。このCpGアイランドにポリコム複合体が集積することで、ヒストンの翻訳後修飾などのエピジェネティクスを介して下流の遺伝子の転写が抑制されると考えられています。
ポリコム複合体は、構成する因子の違いにより大きく分けてPRC1[2]、PRC2[2]の2種類に分けられていますが、近年の研究により、PRC1はさらに6種類のサブタイプ(PRC1.1~PRC1.6)に区分されることが明らかになりました。これらの6種類のポリコム複合体は、それぞれ特徴的なPCGF因子(PCGF1~PCGF6)を持っています(図1)。
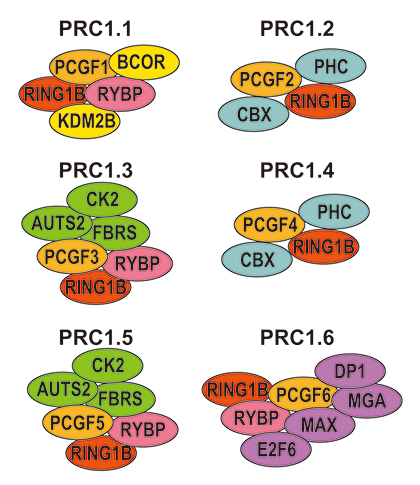
図1 ポリコム複合体PRC1の6種類のサブタイプ
PRC1には、PRC1.1~PRC1.6の六つのサブタイプがあり、それぞれPCGF1~PCGF6(橙色)を持つ。本研究ではPRC1.1の機能に注目している。
従来の知見および本研究でも示しているように、ES細胞など細胞分化を伴わない安定的な培養条件では、これらのPCGF因子を欠損させてもポリコム複合体による転写抑制は影響されません。しかし、PRC1を構成する共通因子であるRING1A/Bを欠損させると激しい脱抑制(転写がオフからオンになる)が起こり、細胞は維持されなくなります。一方、マウス個体においてそれぞれのPCGF因子を欠損させると、胚性致死や四肢の奇形が生じます。このように、PRC1が生命機能において重要な役割を果たすことは明らかでしたが、細胞分化や発生に関わる遺伝子が転写抑制されるメカニズムはよく分かっていませんでした。
そこで、国際共同研究グループはそれぞれのPRC1の機能を解明するために、ES細胞から胚様体への細胞分化に伴って起こる転写抑制時のそれぞれのPCGFの役割を調べることにしました。
研究手法と成果
国際共同研究グループは、6種類のPRC1複合体(PRC1.1~PRC1.6)の転写抑制機構を明らかにするために、構成因子のPcgf1~Pcgf6をそれぞれ欠損させた遺伝子組換えマウスのES細胞を作製し、解析しました。各マウスES細胞を胚様体に分化誘導し、次世代シーケンサー[8]を用いて網羅的な遺伝子発現解析を行った結果、Pcgf1を欠損させた細胞では、細胞分化に伴い発現がオンからオフになる遺伝子群で転写抑制が十分に起こらないことが判明しました。
そこで、Pcgf1を欠損させたマウスES細胞を胚様体に分化誘導し、分化に伴い転写抑制される遺伝子群におけるポリコム複合体の集積の変化を、次世代シーケンサーを用いたクロマチン免疫沈降法[9]およびCUT & Tag法[10]により調べました。すると、野生型マウスES細胞では、胚様体への分化に伴い、転写抑制される遺伝子群で、ポリコム複合体関連因子(RING1B)の標的遺伝子(Tbx3遺伝子など)のプロモーター群への結合が上昇したのに対し、Pcgf1欠損マウスES細胞では、ポリコム複合体関連因子の結合は減少し、その結果標的遺伝子の発現が上昇しました(図2)。
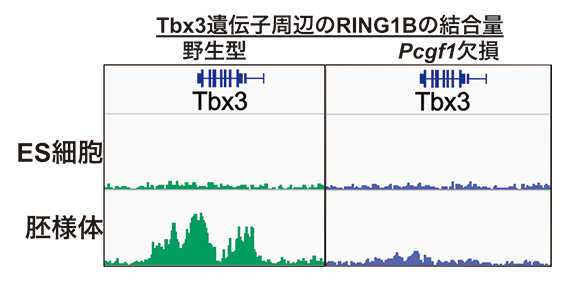
図2 Pcgf1を欠損させたマウスES細胞と胚様体のTbx3遺伝子へのポリコム複合体の集積
Tbx3遺伝子はES細胞で発現オンになっており、胚様体に分化させると発現がオフになる。野生型では、オフになるのに伴ってポリコム複合体関連因子(RNG1B)が集積する(左)。しかし、PRC1.1を構成する特徴的な因子のPcgf1を欠損させた場合、胚様体においてRNG1Bが集積せず(右)、結果として十分な転写抑制状態を形成できなかった。
細胞分化にはさまざまな環境刺激が加わり、環境刺激に依存した間接的な影響を捉えている可能性がありました。そこで、より直接的にプロモーターの不活性化とポリコム複合体の結合の関係を調べるために、人工的にサイレンシング(遺伝子発現の抑制)を起こす「ドキシサイクリン(Dox)誘導性遺伝子抑制システム」を独自に開発しました。このシステムでは、ドキシサイクリン(Dox)誘導性マーカー遺伝子上の薬剤(Dox)応答性プロモーターの上流に、ポリコム複合体への結合領域を組み込むことでサイレンシングを起こします。
このシステムを野生型マウスES細胞に導入したところ、Dox除去によるプロモーター不活性化に伴ったポリコム複合体の集積が見られました。一方、このシステムをPcgf1欠損マウスES細胞に導入し、薬剤誘導的にサイレンシングを起こしたところ、細胞分化で得られた知見と同様に、別のポリコム複合体であるPRC1.2やPRC2の結合量が大きく減少することが分かりました。
以上の結果から、ポリコム複合体PRC1のサブタイプの一つであるPRC1.1(PCGF1複合体)は転写の不活性化に伴い、クロマチン状態が抑制状態に遷移する際に他のポリコム複合体(PRC1.2とPRC2)の集積を促進する役割があることが明らかになりました(図3)。
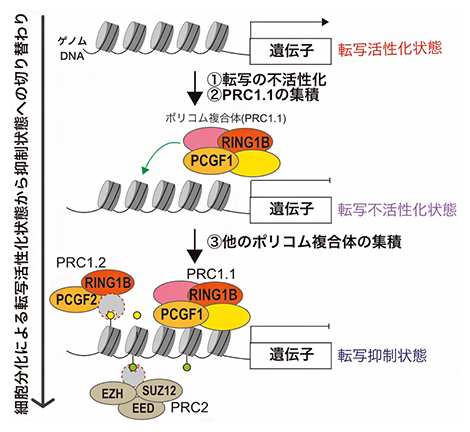
図3 本研究で明らかにしたポリコム複合体PRC1.1による転写抑制状態形成の概要
本研究ではES細胞から胚様体への分化時に新たに抑制される遺伝子(転写がオンからオフに切り替わる遺伝子)の制御に、PRC1.1が重要であることを示した。転写活性化状態でPRC1.1は、転写の不活性化に伴いゲノムDNA上に集積し(①②)、転写不活性化状態を形成する。さらに、他のポリコム複合体(PRC1.2やPRC2)を集積させ(③)、転写抑制状態を形成する。
今後の期待
遺伝子の発現調節メカニズムの解明は、形態形成だけでなく、細胞の正常な分化・脱分化の過程の解明など、発生に関わるさまざまな研究において重要視されています。
今後、さらにポリコム複合体による遺伝子発現制御の詳細な仕組みを明らかにし、遺伝子発現のオン・オフの切り替えの核心に迫ることで、ES細胞やiPS細胞における細胞分化のコントロールが必要な再生医療やがん・疾患などの理解につながり、治療法開発の基礎的知見になると期待できます。
補足説明
1.エピジェネティクス
先天的に遺伝されるDNA配列によるものではなく、後天的な遺伝子発現制御メカニズム(DNAのメチル化やヒストン修飾など)の総称。
2.ポリコム複合体、PRC1、PRC2、PRC1.1
ポリコム複合体は、複数のポリコムタンパク質が集合した複合体で、大きく分けてPRC1とPRC2の2種類に区分される。PRC1はヒストンH2Aの119番目のアミノ酸残基であるリジンのモノユビキチン化(H2AK119ub1)、PRC2はヒストンH3の27番目のアミノ酸残基であるリジンのメチル化(H3K27me3)により、それぞれ抑制性のヒストン修飾を行う。PRC1.1はPRC1のサブタイプの一つ。
3.ES細胞、iPS細胞
ES細胞(胚性幹細胞)は、受精卵が分化してできた発生初期の胚の細胞から作られ、全ての細胞に分化する能力を持つ。iPS細胞(人工多能性幹細胞)は、線維芽細胞などの分化細胞に、3~4個の転写因子を導入するなどして作られた多分化能を持つ細胞。
4.PCGF1
PRC1のサブタイプを規定するPRC1構成因子の一つ。PCGF因子には、PCGF1からPCGF6まである。PCGF1を持つPRC1はPRC1.1、PCGF2を持つPRC1はPRC1.2と区分される。
5.胚様体
ES細胞を浮遊培養によって分化させた細胞凝集塊。三胚葉(外胚葉、中胚葉、内胚葉)に分化できる状態の細胞。
6.ユークロマチン領域
遺伝子が多くコードされ、転写が頻繁に行われているクロマチン領域。ポリコム複合体による遺伝子の発現制御の多くはユークロマチン領域で行われる。
7.プロモーター
ゲノムDNA上でRNAに書き写される領域の近くにあり、遺伝子を発現させる機能を持つ領域。
8.次世代シーケンサー
多量のDNA断片の配列を解読する機械。本研究では、クロマチン免疫沈降法やCUT&Tag法で得られたポリコム複合体の結合しているクロマチン領域のDNAを、次世代シーケンサーを用いて解析することでゲノムDNA上の結合領域を明らかにした。
9.クロマチン免疫沈降法
目的とするタンパク質の特異的抗体を用いて、クロマチンを精製する方法。この手法により、目的とするタンパク質が結合しているDNAを回収できる。
10.CUT & Tag法
目的とするタンパク質の特異的抗体を用いて、クロマチンにDNAバーコードを標識する方法。クロマチン免疫沈降法と同様に、目的とするタンパク質が結合しているDNAを回収できる。
国際共同研究グループ
理化学研究所
生命医科学研究センター 免疫器官形成研究チーム
チームリーダー 古関 明彦(こせき はるひこ)
(千葉大学 大学院医学研究院 細胞分子医学教室 教授)
特別研究員(研究当時) 椙下 紘貴(すぎした ひろき)
(千葉大学 大学院医学研究院 細胞分子医学教室 大学院生、現 東京大学 国際高等研究所 ニューロインテリジェンス国際研究機構(WPI-IRCN) 特任助教)
上級研究員 近藤 隆(こんどう たかし)
研究員 伊藤 伸介(いとう しんすけ)
研究員 藥師寺(上夏井) 那由他 (やくしじ(かみなつい) なゆた)
専任研究員 ジャファル シャリフ (Jafar Sharif)
特別研究員 原地 美緒(はらち みお)
情報統合本部 医療データ数理推論チーム
チームリーダー 川上 英良(かわかみ えいりょう)
かずさDNA研究所 オミックス医科学研究室
染色体工学ユニット長 中山 学(なかやま まなぶ)
千葉大学大学院 医学研究院 細胞分子医学教室
講師 大日向 康秀(おおひなた やすひで)
オックスフォード大学
教授 ロバート・クローゼ(Robert J. Klose)
研究員 ニール・ブラックリッジ (Neil P. Blackledge)
研究支援
本研究は、日本医療研究開発機構(AMED)革新的先端研究開発支援事業ユニットタイプ「エピゲノム研究に基づく診断・治療へ向けた新技術の創出」研究領域(研究総括:山本雅之(東北大学大学院医学系研究科教授)における研究課題「エピジェネティクスによるエンハンサー動態制御メカニズムの解明と細胞機能制御への応用(研究代表者:古関明彦)」、日本学術振興会(JSPS)新学術領域研究(研究領域提案型)「多様かつ堅牢な細胞形質を支える非ゲノム情報複製機構」(領域代表 中西真)における研究課題「ポリコム群による抑制ドメインの複製機構の解明(研究代表者:古関明彦)」、同科学研究費補助金基盤研究(A)「ポリコム群抑制クロマチン形成におけるCpG配列認識の意義の解明(研究代表者:古関明彦)」による支援を受けて行われました。
原論文情報
Hiroki Sugishita, Takashi Kondo, Shinsuke Ito, Manabu Nakayama, Nayuta Yakushiji-Kaminatsui, Eiryo Kawakami, Yoko Koseki, Yasuhide Ohinata, Jafar Sharif, Mio Harachi, Neil P. Blackledge, Robert J. Klose and Haruhiko Koseki*, “Variant PCGF1-PRC1 links PRC2 recruitment with differentiation-associated transcriptional inactivation at target genes”, Nature Communications, 10.1038/s41467-021-24894-z
発表者
理化学研究所
生命医科学研究センター 免疫器官形成研究チーム
チームリーダー 古関 明彦(こせき はるひこ)
特別研究員(研究当時) 椙下 紘貴(すぎした ひろき)
(現 東京大学 国際高等研究所 ニューロインテリジェンス国際研究機構(WPI-IRCN) 特任助教)
報道担当
理化学研究所 広報室 報道担当
千葉大学 亥鼻地区事務部総務課企画係