治療層別化のための新たな診断基準になる可能性
2021-04-01 国立がん研究センター
1.発表者
永澤 慧(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 特任研究員)
津川 浩一郎(聖マリアンナ医科大学 乳腺内分泌外科教室 教授)
小池 淳樹(聖マリアンナ医科大学 病理学教室 教授)
太田 智彦(聖マリアンナ医科大学大学院 応用分子腫瘍学教室 教授)
大西 達也(国立研究開発法人国立がん研究センター東病院 乳腺外科 科長)
土原 一哉(国立研究開発法人国立がん研究センター先端医療開発センタートランスレーショナルインフォマティクス分野 分野長)
鈴木 穣(東京大学大学院新領域創成科学研究科 メディカル情報生命専攻 教授)
2.発表のポイント
- 非浸潤性乳がん(注1)の進展に関わる因子としてGATA3遺伝子異常の存在を同定しました。
- 空間トランスクリプトーム解析(注2)を用いて、GATA3遺伝子異常をもつがん細胞の特徴を明らかにしました。
- 従来の臨床病理学的因子に加えて、本研究で同定したゲノム科学的リスク因子を用いることで、非浸潤性乳がんのより精密な個別化医療に貢献することが期待されます。
3.発表概要
東京大学大学院新領域創成科学研究科の永澤 慧特任研究員と鈴木 穣教授らのグループは、国立がん研究センター東病院 大西達也乳腺外科長、聖マリアンナ医科大学乳腺内分泌外科学教室津川浩一郎教授、同病理学教室小池淳樹教授らとの共同研究により、非浸潤性乳がんの進展に関わる候補因子を同定しました。乳がんにおいて、非浸潤性乳がん(DCIS : Ductal Carcinoma in situ)は、浸潤がん(IDC : Invasive Ductal Carcinoma)の前駆病変と位置づけられています。DCISは将来、がんに発展する可能性があることから、現在ではDCISの標準治療には切除手術が一様に行われています。ですが近年、DCISは多様な性質をもつがん細胞の集団であるとの報告もなされています。このDCIS細胞集団中には、真に浸潤がんに発展するDCIS(真のDCIS 群)だけでなく、浸潤がんには進展しない症例が含まれる事が予測されています。もしこれが事実だった場合、後者に対して手術を行うことは結果的に過剰治療になっている可能性があり、DCISの患者さん個々への最適な医療を考えると、これらの2群を区別することは非常に重要です。
今回、従来の臨床病理学的因子に加えてDCISの進展に関係する遺伝子因子として、GATA3という遺伝子の機能異常を同定しました。DCISは、GATA3の正常な機能が損なわれることで浸潤がんへと進展していくと考えられます。そこで、最新の解析技術である「空間トランスクリプトーム解析」を用いて、GATA3遺伝子異常をもつがん細胞の特徴を調べ、GATA3遺伝子異常ががんの浸潤能獲得に及ぼす影響を直接的に明らかにしました。
本研究成果により、従来の臨床病理学的因子に加えて、本研究で同定したゲノム科学的リスク因子を用いることで、新たな非浸潤性乳管がん層別化(DCISをリスク別に分類して最適な医療に結びつけること)基準の精度向上につながる可能性があり、DCIS個別化医療に貢献することが期待されます。
本研究成果は、2021年4月1日付けで国際科学雑誌「Communications Biology」のオンライン版で掲載されました。
4.発表内容
1.研究の背景・先行研究における問題点
乳房の非浸潤性乳がん(DCIS : Ductal Carcinoma in situ)は、浸潤性乳がん(IDC : Invasive Ductal Carcinoma)の前駆病変と臨床的には位置づけられます。現在ではDCISが見つかった場合、一様に切除手術が行われています。ですが近年、DCISは治療学的にも生物学的にも不均一な集団であるとの報告がなされています。この集団中には、浸潤がんの真の前駆細胞を有するDCIS(本来DCISと呼ぶにふさわしいDCIS;真のDCIS 群)以外に、浸潤がんに進展しないDCIS細胞を有し、結果過剰治療になっている群(低リスクDCIS群)、すでに浸潤能を獲得したDCIS細胞を有する群(高リスクDCIS群)が包含されていると予測されます。
各群で治療選択は大きく異なるため、DCISの最適医療実現化にはこれらの群を層別化する必要があります。特に低リスク群について、これらを層別化し非切除またはホルモン療法のみを行う臨床試験が各国で進行中です。しかし、層別化のためのリスク因子は、従来報告のある臨床病理学的情報に基づいた因子にとどまっており、また各国においてもコンセンサスがありません。これは、DCISに存在する不均一な細胞集団を、再発リスクという視点で分子生物学的に解析した情報がなく、非浸潤性のがん細胞から浸潤がんに至る因子の同定に至っていないことが原因であると考えられます。
2.研究内容(具体的な手法など詳細)
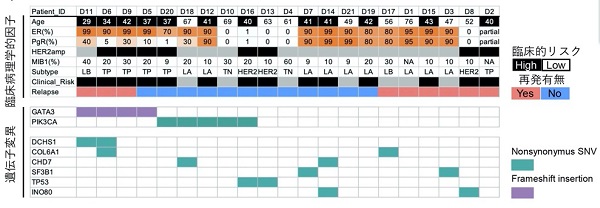
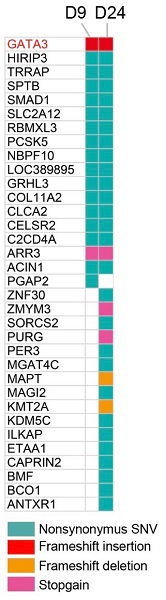
本研究では、まず、431例のDCIS患者の臨床病理学的因子から、年齢(45歳未満)とHER2遺伝子増幅(注3)が浸潤がん再発と関連のあるリスク因子であることを示しました。次に、遺伝子情報に基づくゲノム科学的再発リスク因子候補の探索のため、21症例のDCIS原発病変と再発前後のペア検体を用いた全エクソンシークエンスを行いました。その結果、GATA3遺伝子変異が浸潤がんへの進展に関与する遺伝子候補であることを見出しました(図1)。
この結果を、全エクソンシークエンスの結果より作成した180遺伝子ターゲットパネルを用いて、72例のターゲットシークエンスを行い確認しました(OR = 7.8; 95% CI = 1.17–88.4)。次に、GATA3遺伝子異常が浸潤に及ぼす影響を直接的に明らかにするため、GATA3遺伝子異常をもつDCIS症例の空間トランスクリプトーム解析を行いました。GATA3遺伝子異常をもつDCIS細胞では、異常を持たない細胞に比べて上皮間葉転換(EMT)や血管新生などのがん悪性化関連遺伝子の活性化を認め、浸潤能を獲得していることが明らかになりました(図2)。
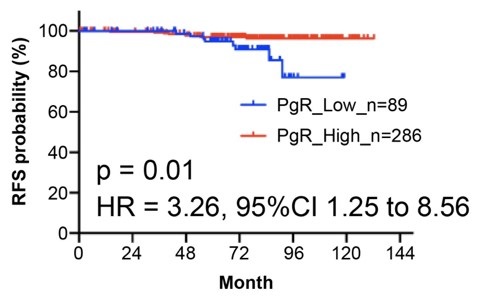
これまでに、GATA3変異をもつがん細胞では、GATA3の遺伝子結合領域が変化するため、PgR(プロゲステロンレセプター)の発現が低下することが示されていることから、GATA3変異をもつDCIS細胞におけるPgRの発現量を確認したところ、有意にその発現が低下していることがわかりました(図3)。さらにER陽性のDCIS375例において、PgRの発現レベルで2群にわけて再発予後を検討したところ、ER陽性かつPgR陰性のDCISでは有意に予後が悪いことが明らかになりました(HR = 3.26, 95% CI = 1.25–8.56, p=0.01)。すなわち、ER陽性DCISにおけるGATA3変異は、PgR発現がそのサロゲートマーカーになる可能性が示唆されました。
本研究は、文部科学省科学研究費助成事業 新学術領域研究 先進ゲノム支援(16H06279)、独立行政法人日本学術振興会 藤田記念医学研究振興基金研究助成事業(学振第31号)の支援を受けて行われました。
3.社会的意義・今後の予定 など
従来の臨床病理学的リスク因子に加えて、本研究で同定したゲノム科学的リスク因子を用いることで、新たなDCISの層別化基準の策定につながる可能性があり、より精密な個別化医療に貢献することが期待されます。
5.発表雑誌
雑誌名:「Communications Biology」(オンライン版:2021年4月1日)
論文タイトル:Genomic profiling reveals heterogeneous populations of ductal carcinoma in situ of the breast
著者:Satoi Nagasawa*, Yuta Kuze*, Ichiro Maeda, Yasuyuki Kojima, Ai Motoyoshi, Tatsuya Onishi, Tsuguo Iwatani, Takamichi Yokoe, Junki Koike, Motohiro Chosokabe, Manabu Kubota, Hibiki Seino, Ayako Suzuki, Masahide Seki, Katsuya Tsuchihara, Eisuke Inoue, Koichiro Tsugawa, Tomohiko Ohta, Yutaka Suzuki*
DOI番号:10.1038/s42003-021-01959-9
6.問い合わせ先
研究に関すること
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻
教授 鈴木 穣(すずき ゆたか)
東京大学大学院新領域創成科学研究科 メディカル情報生命専攻
特任研究員 永澤 慧(ながさわ さとい)
報道に関すること
東京大学大学院新領域創成科学研究科 広報室
聖マリアンナ医科大学 総務課
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室(柏キャンパス)
7. 用語解説
(注1)非浸潤性乳がん
非浸潤性乳がんは、乳管(乳がんが発生する場所)の中にがん細胞がとどまっている段階のがんです。頻度は、検診マンモグラフィの普及による早期発見により増加傾向で、乳がんの10-20%程度です。進行すると、乳管の外にがん細胞が浸潤していく浸潤がんになると考えられているため、現在は全例で手術による摘出が必要ですが、その必要がない非浸潤性乳がん(低リスク群)や、浸潤がんになるリスク非浸潤性乳管がん(高リスク群)の存在が、近年示唆されています。
(注2)空間トランスクリプトーム解析
細胞のDNAを鋳型にしてRNAが合成されることを転写と呼び、転写によって合成されたRNAのことを転写産物(トランスクリプト)と呼びます。細胞中にはさまざまなRNAが存在しており、このようなRNA分子の総体を「トランスクリプトーム」と呼びます。近年の技術進歩により、1細胞レベルのトランスクリプトームを網羅的に測定できるようになりました。ですが、測定に使った細胞が組織のどこにあったかという位置情報が失われる、という欠点もありました。空間トランスクリプトーム解析は、さまざまな種類の組織・細胞から遺伝子発現情報を空間的な位置情報を保ちつつ、取得し視覚化する技術です。本研究で用いた、Spatial transcriptomics (Visium)の他、さまざまな技術が報告されています。
(注3)HER2遺伝子増幅
HER2とは、Human Epidermal Growth Factor Receptor type 2(ヒト表皮成長因子受容体2型)の略です。HER2タンパクは、細胞の表面に存在して細胞の増殖調節などに関係しますが、たくさんあると細胞増殖の制御が効かなくなります。乳がんの15~25%では、がん細胞の表面に正常細胞の1,000~10,000倍ものHER2タンパクが存在しています。このような乳がんを「HER2タンパクの過剰発現がある乳がん」と呼びます。このような乳がんでは、HER2タンパクをつくるように司令を出す遺伝子の数も増えており、この状態を「HER2遺伝子の増幅がある」といいます。
8.添付資料
1a)
1b)
図1. ゲノム科学的再発リスク因子の探索
1a) DCIS原発病変を用いた先行21症例の全エクソンシークエンス結果。GATA3変異を有する症例では、高率に再発を認める。
1b)再発前後のペア検体(D9 ; 再発前、D24 ; 浸潤がん再発時)を用いた全エクソンシークエンス結果。GATA3変異は再発前(原発病変)から一貫して存在し、再発リスク因子候補であることが示唆される。
2a)
2b)
GATA3変異
2c)
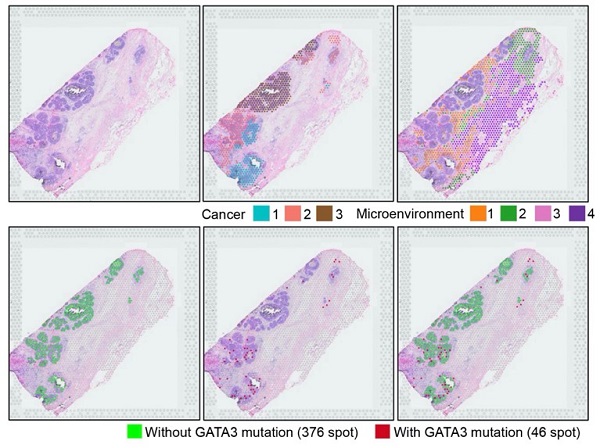
図2. GATA3異常を有するDCIS症例の空間トランスクリプトーム解析結果
2a) GATA3変異を有する症例の空間トランスクリプトーム解析結果。遺伝子発現パターンにより、DCIS細胞は3群(Cancer1,2,3)に、がん微小環境細胞は4群(Microenviroment1,2,3,4)に分類され、DCISの腫瘍不均一性がうかがえる(上段)。赤丸はGATA3変異を有するスポット(細胞)を、緑丸はGATA3変異を有さないスポット(細胞)示している(下段)。
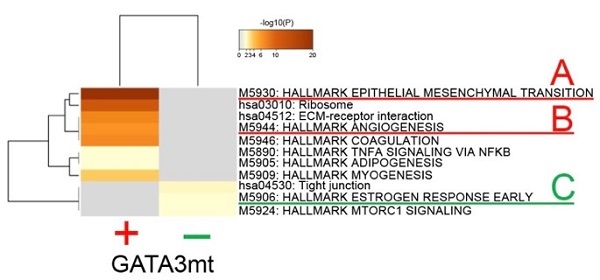
2b) GATA3変異を有するDCIS細胞スポット(図2a下段赤丸)と、GATA3変異を有さないDCIS細胞スポット(図2a下段緑丸)のパスウェイ解析結果。GATA3変異を有するスポットでは、EMT(図内gene group A)や血管新生パスウェイ(図内gene group B)が活性化しており、浸潤能力を有する。一方でGATA3変異を有さないスポットでは、エストロゲン応答(図内gene group C)など、細胞増殖パスウェイが活性化している。
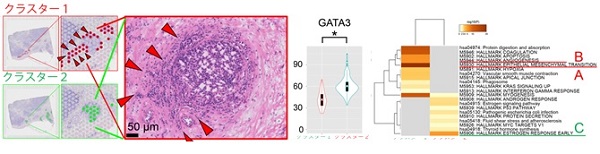
2c) 浸潤部分を捉えた空間トランスクリプトーム解析結果。浸潤部のがん細胞(クラスター1)では、乳管内のがん細胞(クラスター2)に比べ、GATA3遺伝子発現が低下し、図2bと同様のがん悪性化関連遺伝子の活性化を認めた。
3a)
3b)
3c)
図3. GATA3変異を有するDCIS症例のPgR発現と発現別予後解析
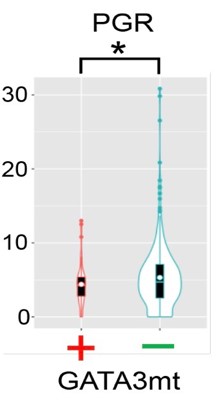
3a) 図2に示した空間トランスクリプトーム解析に供した症例における、GATA3変異を有するDCIS細胞スポット(図2a下段赤丸)と、GATA3変異を有さない細胞スポット(図2a下段緑丸)のPgR発現の比較。
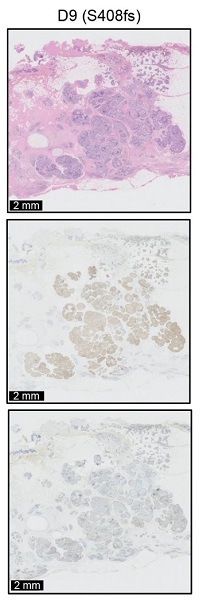
3b) GATA3変異(S408fs)を有するDCIS症例のHE染色(上)とER(中)PgR(下)の免疫染色像。
3b) ER陽性DCIS375症例のコホートにおいて、PgRの発現レベルで2群にわけて再発予後を検討した。PgR低発現群(青線)は、高発現群(赤線)に比べて予後不良である。