2021-05-06 熊本大学,日本医療研究開発機構
ポイント
- 心筋細胞に豊富に発現する新規長鎖ノンコーディングRNA(lncRNA)注1)「Caren」を同定し、心不全の原因となる加齢や高血圧などの圧負荷によるストレスによって心筋細胞におけるCarenのRNA量が減少することを解明しました。
- Carenは、ミトコンドリア数増加により心筋細胞のエネルギー代謝増強作用、およびDNA損傷応答注2)活性化の抑制作用を示し、心不全病態の進行に拮抗することを解明しました。
- 心筋細胞におけるCarenのRNA量を補充し増加させることで心不全病態の進行を抑制できたことから、心筋細胞へのCaren作用経路の活性化が、心不全に対する新規治療法の開発に向けた戦略の一つとして期待されます。
概要説明
心不全は未だ予後不良の病気であり、超高齢社会の到来により心不全患者数は今後もさらなる増加が予測されます。心不全をはじめとする加齢関連疾患は、健康寿命延伸の大きな阻害要因になることから、効果的な新規治療法の開発が望まれています。
今回、熊本大学大学院生命科学研究部の尾池雄一教授らの研究グループは、心筋細胞に豊富に発現する新規lncRNAである「Caren」を同定し、Carenが心筋細胞におけるミトコンドリア数増加によりエネルギー産生を増強すること、また、DNA損傷応答経路の活性化の鍵となるATMタンパク質の活性化を抑制し、心不全病態の増悪を抑制する作用を有することを明らかにしました。
心筋細胞におけるCarenのRNA量は、心不全の発症につながる加齢や高血圧などの圧負荷によるストレスによって低下することに加え、ヒト心不全患者の心臓組織においても顕著に減少していることを発見しました。一方、マウス心不全モデルにおいて、心筋細胞のCaren RNA量を増加させることで、心不全病態の進行を抑制することに成功したことから、今後、心筋細胞におけるCaren 作用活性化が、心不全に対する新規治療法の開発につながることが期待されます。
本研究成果は、国立研究開発法人日本医療研究開発機構(AMED)『老化メカニズムの解明・制御プロジェクト』(研究開発分担者:尾池 雄一)ならびに革新的先端研究開発支援事業(AMED-CREST)「生体恒常性維持・変容・破綻機構のネットワーク的理解に基づく最適医療実現のための技術創出」研究開発領域における研究開発課題「組織修復に基づく恒常性維持機構の変容による生活習慣病の病態解明と制御」(研究開発代表者:尾池 雄一)、文部科学省科学研究費補助金(18H02809、18K19519(研究代表者:尾池 雄一)、19K17607(研究代表者:佐藤 迪夫)、25461114、19K08560(研究代表者:宮田 敬士)、23310135(研究代表者:荒木 喜美))の支援を受けたもので、令和3年5月5日午前10時(日本時間午後7時)に、Nature Communicationsオンライン版に掲載されました。
説明
背景
心不全は、加齢、高血圧症や虚血性心疾患、心筋症などの様々な原因によって心臓のポンプ機能(心筋の収縮力や拡張力)が低下し、体に充分な血液を送り出せなくなった状態です。医学・医療技術の目覚ましい進歩にもかかわらず、心不全は未だ予後不良の病気です。心不全患者数は今後も世界規模で増加することが予想されており、超高齢社会を迎えた本邦においては特に高齢者の心不全患者数の増加が問題となっています。それ故、効果的な新規治療戦略の開発が望まれています。
心臓では、心不全の発症につながる加齢や高血圧などの圧負荷によるストレスへの暴露によって心筋細胞におけるミトコンドリアが機能不全に陥り、その結果、心ポンプ機能の維持に必須のミトコンドリアにおけるエネルギー産生が減少し、DNAの損傷を引き起こす活性酸素種注3)の産生が増加することが明らかとなっています。さらに、活性酸素種によるDNAの損傷によって活性化されるDNA損傷応答は、心不全病態の増悪を促進することから、ミトコンドリアの機能低下およびDNA損傷応答の活性化が、心不全の発症・増悪の原因(メカニズム)として注目されています。
研究の成果
本研究グループは、今回、マウスの心筋細胞に豊富に発現する新規lncRNAを同定し、Caren(cardiomyocyte-enriched noncoding transcript)と命名しました。また、心筋細胞におけるCarenのRNA量は、心不全の発症や増悪につながる加齢や高血圧などの圧負荷によるストレスによって低下していることをマウスの心臓で明らかにしました。
さらに、マウスを用いて心臓におけるCarenの機能を解析したところ、Carenが心臓のポンプ機能の低下を抑制することが明らかとなりました。また、加齢や圧負荷によるストレスによって心筋細胞におけるCaren RNA量が減少し、Carenによる作用が減弱することで、ミトコンドリアの機能低下およびDNA損傷応答の活性化が促進され、心不全の発症・増悪につながることが示唆されました(図1)。
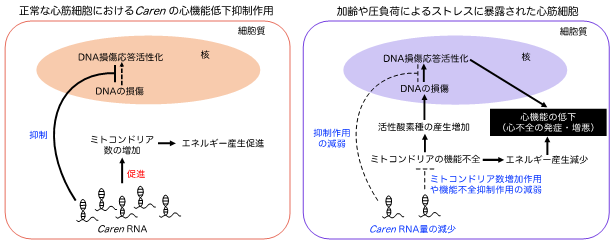
図1. 心筋細胞のCaren RNA量減少による心不全の発症・増悪のメカニズム正常な心筋細胞にはCaren RNAが豊富に存在しており、ミトコンドリア数増加によりエネルギー産生を増強すること、およびDNA損傷応答経路の活性化を抑制することで、心機能の低下を抑制しています。しかし、加齢や圧負荷によるストレスに暴露された心筋細胞では、Caren RNA量が減少します。その結果、Carenによる作用が減弱し、ミトコンドリアの機能低下およびDNA損傷応答の活性化が促進され、心不全の発症・増悪につながります。
さらに、病原性を持たず心筋細胞に選択的に感染し、Carenを発現することができるウイルス(アデノ随伴ウイルス)注4)を遺伝子操作により作製し、このウイルスを人為的な操作により心不全の発症を誘導したマウスに感染させました。その結果、心筋細胞にCaren RNAを補充していない対照群のマウスに比べ、心筋細胞にCaren RNAを補充したマウスでは、心筋細胞におけるCaren RNA量が増加し、ミトコンドリア数の増加促進およびDNA損傷応答活性化の抑制が認められ、心機能低下が抑制されるなど心不全病態の進行を抑制することに成功しました(図2)。また、マウスと同様に、ヒト心筋細胞においてもCaren RNAが存在し、ヒト心不全患者の心臓組織では、Caren RNA量と心不全マーカー遺伝子の発現量が逆相関する(Caren RNA量が低い心臓組織では心不全マーカー遺伝子の発現量が高い)ことを明らかにしました。さらに、ヒトiPS細胞注5)から作製した心筋細胞においてヒトCaren RNA量を減少させると、ミトコンドリアのエネルギー産生能が低下することを示しました。
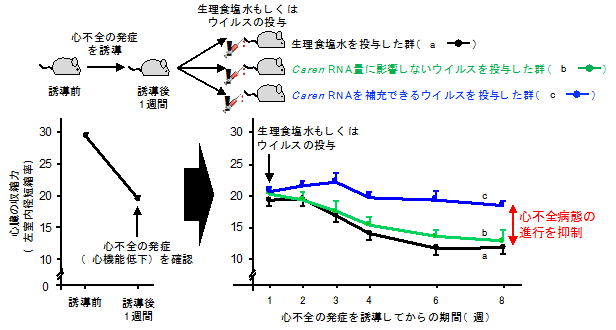
図2. 心不全病態の進行に対する心筋細胞へのCaren RNA補充療法の効果人為的な操作により心不全の発症を誘導したマウスでは、誘導後1週間で心臓の収縮力が著しく低下し、心不全の発症が確認できます。この時点で、心不全を発症したマウスに生理食塩水(a;黒色)、Caren RNA量に影響しないウイルス(b;緑色)またはCaren RNAを補充できるウイルス(c;青色)をそれぞれ投与し、心臓の収縮力の変化を解析しました。その結果、生理食塩水(a;黒色)およびCaren RNA量に影響しないウイルス(b;緑色)を投与した群では、投与後も心臓の収縮力が低下し、心不全病態が進行していました。一方、Caren RNAを補充できるウイルス(c;青色)を投与した群では、心臓の収縮力低下が抑制されたことから、心筋細胞へのCaren RNA補充療法が、心不全病態の進行抑制に有効であることが示唆されました。
展開
今回の研究成果により、心筋細胞内のCaren RNA量を増加させることが、心不全の発症・増悪の抑制につながることから、心不全に対する新規治療法開発の戦略として期待されます(図3)。マウスを用いた実験では、アデノ随伴ウイルスを用いたCaren RNAの補充療法が心不全病態の増悪抑制に有効であったことから、今後、ヒトCarenについても同様の効果が認められるかどうかを検証することが、心不全の新規治療法開発に向けて重要であると考えられます。
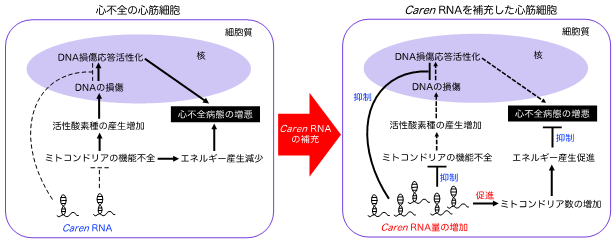
図3. 心不全に対する新規治療法開発の戦略心不全を発症した心臓の心筋細胞においては、Caren RNA量は低下し、Carenの作用減弱が心不全病態の進行につながります。心筋細胞にCaren RNAを補充する戦略は、心筋細胞のミトコンドリア数を増加し、機能改善によるエネルギー産生を促進します。また、DNA損傷応答の活性化や心不全病態の増悪を抑制できることから、新たな治療法開発の戦略として期待されます。
用語解説
- 注1)長鎖ノンコーディングRNA(lncRNA)
- ノンコーディングRNAは、タンパク質をコードしていないRNAであり、その長さが200塩基以上のノンコーディングRNAを長鎖ノンコーディングRNAと呼びます。近年の研究により、長鎖ノンコーディングRNAは、細胞内で様々な役割を果たしていることが知られてきており、がんや心不全などの疾患における機能も報告され、大変注目されています。
- 注2)DNA損傷応答
- 細胞内では、DNAに損傷が生じると、細胞分裂を停止させ、損傷したDNAの修復を行う機構が作動します。また、DNAの損傷が修復不能な場合には、細胞死を誘導するような機構も存在しており、このようなDNA損傷に対する細胞の応答をDNA損傷応答と呼びます。細胞分裂を行わない心筋細胞では、DNA損傷応答の活性化によってミトコンドリアの機能が損なわれたり、細胞死が誘導されたりすると考えられています。また、逆にミトコンドリアの機能低下によって生じる活性酸素種がDNA損傷を増加させることも明らかになっています。
- 注3)活性酸素種
- 活性酸素種は、酸素分子に由来する反応性に富む分子群の総称です。ミトコンドリアでは、エネルギー産生の副産物として活性酸素種が産生されます。ミトコンドリアの機能不全によって活性酸素種の産生が増加すると、タンパク質やDNAなど様々な分子が活性酸素種によって障害され、細胞の機能不全が引き起こされます。
- 注4)アデノ随伴ウイルス
- アデノ随伴ウイルスは、ヒトやマウスなどの動物に感染する小型のウイルスで、現在のところ病原性は確認されていません。アデノ随伴ウイルスには様々なタイプがあり、それぞれのタイプによって感染できる細胞の種類が異なっています。宿主となる細胞の種類に合ったタイプのウイルスに目的の遺伝子を組み込み、宿主細胞に感染させることで、宿主細胞内に目的の遺伝子を送り込むことができます。このような特徴から、アデノ随伴ウイルスを用いた遺伝子治療の臨床試験などもすでに行われています。
- 注5)iPS細胞
- 皮膚などの体細胞に数種類の遺伝子を導入することで作製され、心筋や神経など様々な細胞に分化誘導することが可能な多能性をもつ細胞です。近年、再生医療や創薬への応用が大変注目されています。
論文情報
- 論文名
- The lncRNA Caren antagonizes heart failure by inactivating DNA damage response and activating mitochondrial biogenesis
- 著者
- Michio Sato†, Tsuyoshi Kadomatsu†, Keishi Miyata†, Junco S. Warren, Zhe Tian, Shunshun Zhu, Haruki Horiguchi, Aman Makaju, Anna Bakhtina, Jun Morinaga, Taichi Sugizaki, Kaname Hirashima, Kumiko Yoshinobu, Mai Imasaka, Masatake Araki, Yoshihiro Komohara, Tomohiko Wakayama, Shinichi Nakagawa, Sarah Franklin, Koichi Node, Kimi Araki, & Yuichi Oike* (†co-first authors, *corresponding author)
- 掲載誌
- Nature Communications
- doi
- 10.1038/s41467-021-22735-7
- URL
- https://www.nature.com/articles/s41467-021-22735-7
お問い合わせ先
研究に関すること
熊本大学大学院生命科学研究部
分子遺伝学講座
担当:教授 尾池 雄一
AMEDに関すること
日本医療研究開発機構(AMED)
疾患基礎研究事業部 疾患基礎研究課
TEL:03-6870-2286 FAX:03-6870-2243
老化メカニズムの解明・制御プロジェクト