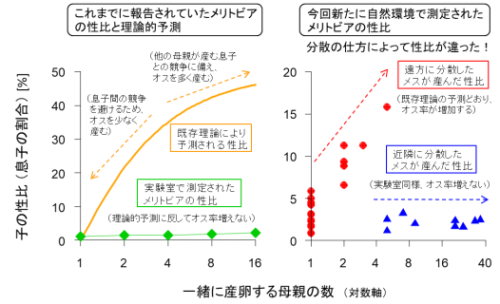
毛包周囲の基底膜が多様な組織間インターフェースを形成する
2021-05-10 理化学研究所
理化学研究所(理研)生命機能科学研究センター細胞外環境研究チームの筒井仰技師、藤原裕展チームリーダーらの国際共同研究グループは、皮膚の毛包[1]周囲の基底膜[2]の組成を網羅的に解析し、基底膜が異なる組織をつなぐ多様な組織間インターフェース[3]を形成していることを明らかにしました。
本研究成果は、生体内や試験管内での異種組織の接続や相互作用の制御技術の発展に貢献すると期待できます。
今回、国際共同研究グループは、毛包を構成する上皮[4]幹細胞と間充織[5]細胞の細胞外マトリックス[6]環境を詳しく解析し、領域ごとに異なる細胞外マトリックスの産生細胞とタンパク質の分布を網羅した毛包の「細胞外マトリックスアトラス」を作成しました。その結果、毛包のさまざまなタイプの上皮幹細胞と、そこに接続する線維芽細胞[7]、筋肉、神経とのインターフェースには、それぞれ固有の組成と構造の基底膜が存在することを見いだしました。上皮は1枚の基底膜シートで覆われていますが、その分子組成はパッチワークのように領域ごとに大きく異なっていたのです。特に毛包の再生を制御する線維芽細胞(毛乳頭)とのインターフェースでは、突起状の基底膜「フック基底膜」が、毛乳頭の活性化と空間配置の維持、そして毛包の再生を制御していることが分かりました。
本研究は、オンライン科学雑誌『Nature Communications』(5月10日付:日本時間5月10日)に掲載されます。
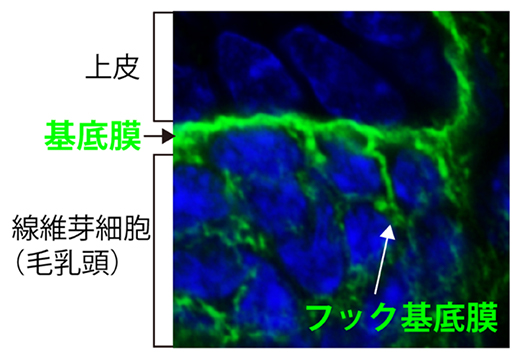
上皮と線維芽細胞の異種組織間インターフェースを形成する基底膜
背景
体内の多くの臓器では、異なる組織が組み合わさることで、臓器固有の機能が生み出されます。例えば皮膚では、さまざまなタイプの上皮細胞がその下の真皮に存在する線維芽細胞、筋肉、神経、血管などと相互作用することで、バリア、感覚受容、組織再生などの機能を発揮します。その際、多くの組織が空間的に正しく配置されることで、隣接する組織の間でシグナルが交換されます。同種の細胞であれば、混ぜるだけで容易に凝集して塊を作ります。しかし、異なる組織同士がどのように相互作用し、一体化した臓器を作るのかについては不明な点が多く残されています。
通常、それぞれの組織は「基底膜」という薄いシート状の細胞外マトリックスで覆われており、他の組織とは物理的に隔てられています。つまり、異なる組織同士の機能的な接続は、基底膜という薄い仕切りをインターフェースとして成り立っているのです。
近年、基底膜をはじめとする細胞の足場構造は、均一な成分でできているのではなく、場所によって組成が違うことが分かってきました。これまで、300種類程度ある細胞外マトリックスタンパク質について個別の研究は行われてきましたが、これらタンパク質全体を総体として捉えながら、細胞外マトリックス全体の遺伝子発現やその転写産物であるタンパク質の組織分布、そしてそれらの機能との関連を体系的に解析した研究はほとんど行われてきませんでした。
なぜなら、細胞外マトリックス分子はサイズが巨大であり、さらにそれらが集まって超分子複合体を形成するといった性質が、網羅的解析を阻んできたからです。そのため、組織間インターフェースを形成する基底膜の分子実体や機能の統合的な理解は進んでいませんでした。
研究手法と成果
国際共同研究グループは、さまざまなタイプの組織間相互作用を持つ毛包をモデルに、組織間相互作用に特化した基底膜インターフェースの分子組成を網羅的に調べることにしました。毛包には異なる性質の複数の上皮幹細胞が存在し、毛、毛包、皮膚表面の再生を担っています。これら上皮幹細胞は、皮膚表面から陥入した上皮組織に区画を作って並んでおり、基底膜を介して、間充織の感覚神経、立毛筋、線維芽細胞(毛乳頭)と相互作用しています(図1)。
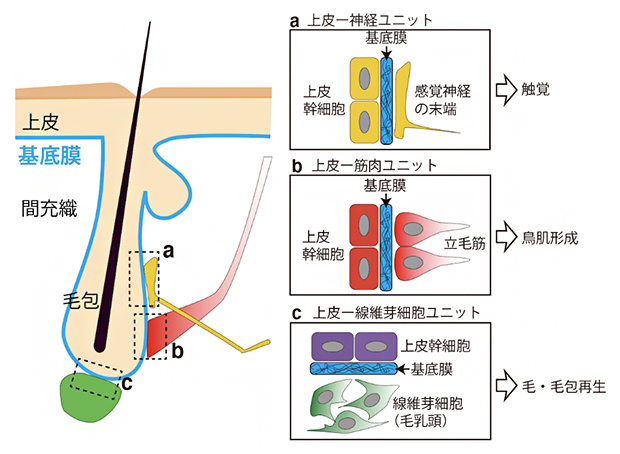
図1 基底膜が異なる組織の間のインターフェースを形成
マウス皮膚の模式図。基底膜(青)が上皮とさまざまな間充織組織との間のインターフェースを形成する。ここでは、異種組織が組み合わさって形成される毛包の機能ユニット「上皮―神経ユニット(a)」、「上皮―筋肉ユニット(b)」、「上皮―線維芽細胞ユニット(c)」を示した。
これまで独自に確立した皮膚の細胞分取法を応用することで、さまざまな上皮幹細胞とその周囲の間充織細胞を分離し、遺伝子発現を解析しました。さらに、大規模な免疫組織染色法を組み合わせることで、基底膜分子のメッセンジャーRNA(mRNA)とタンパク質局在の組織空間情報を定量的かつ統計的な手法で調べました。
遺伝子発現解析の結果、各区画の上皮幹細胞は、それぞれ異なる基底膜の遺伝子を発現していることが分かりました。さらに、皮膚で発現している78種類の細胞外マトリックス遺伝子のタンパク質産物に対する抗体を用いた免疫組織染色法[8]の条件を検討し、それらの組織内局在の同定にも成功しました。そして、細胞外マトリックスのmRNA発現とタンパク質局在とを網羅した毛包の「細胞外マトリックスアトラス」を作成しました(図2)。このアトラスにより、組織間相互作用ごとの基底膜組成を同定できました。例えば、毛包再生に働く毛包先端部の毛芽領域における上皮幹細胞と毛乳頭細胞の基底膜インターフェースでは、シグナル伝達に関わる細胞外マトリックスタンパク質が濃縮しており、シグナル交換に適した基底膜が構築されていることが分かりました。
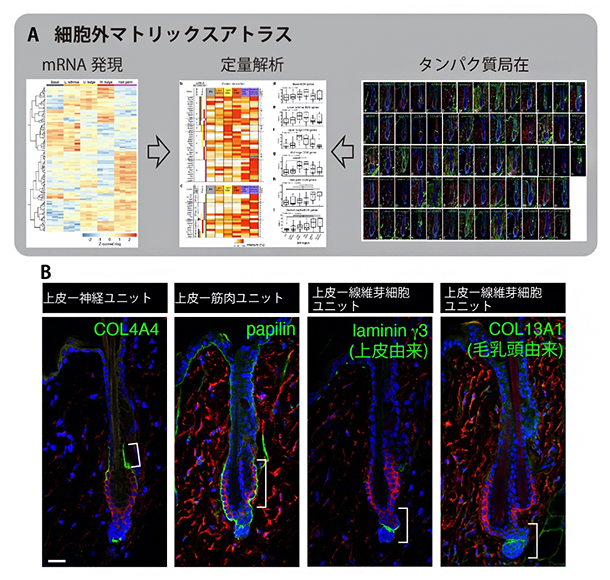
図2 毛包の細胞外マトリックスアトラス
(A)毛包の細胞外マトリックスのmRNA発現とタンパク質局在を網羅した細胞外マトリックスアトラス。細胞内mRNAと細胞外に分泌されたタンパク質の空間情報の定量解析から、細胞外マトリックスの細胞由来と組織分布の相関関係を明らかにした。
(B)アトラスデータから、各機能ユニットに特徴的な基底膜の分子組成と組織分布の全貌が明らかになった。データの一部を示す。幹細胞を赤、それぞれの細胞外マトリックス分子を緑、細胞核を青で蛍光染色した。スケールバーは20マイクロメートル(μm、1μmは1,000分の1mm)。
次に、このアトラスを用いて、細胞内mRNAと細胞外に分泌されたタンパク質の空間情報の定量比較を行ったところ、基底膜の分子組成はおおむね、近接する上皮細胞と間充織細胞の両方の遺伝子発現パターンを反映することが分かりました。これは、異種組織間の基底膜インターフェースが、近接する上皮系および間充織系細胞によって協調的に形成されることを示しています。これまで、細胞外マトリックスの遺伝子を発現する細胞と、細胞外マトリックスを構成するタンパク質の局在を体系的に比較した試みはなく、これらの関係はよく分かっていませんでした。本研究により、近接細胞の遺伝子発現情報を組み合わせることで、細胞外マトリックス環境を推定できることが分かりました。
さらに、毛包の再生をつかさどる毛芽(上皮細胞)―毛乳頭(線維芽細胞)相互作用における基底膜の機能を調べました。アトラスデータから、この境界面の基底膜が毛乳頭側に突起を伸ばしていることを見いだし、この構造を鉤型に見立て「フック基底膜」と名付けました(図3)。
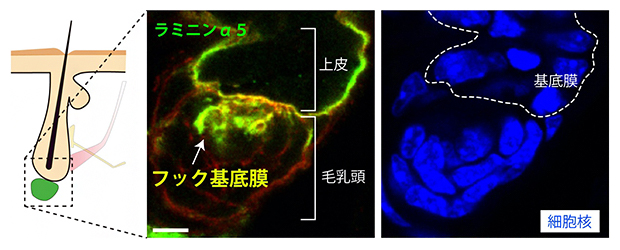
図3 上皮と毛乳頭をつなぐフック基底膜の発見
毛包の再生をつかさどる毛芽(上皮)と毛乳頭(線維芽細胞)の境界の基底膜(緑=ラミニンα5)が、毛乳頭側に突起を伸ばしていることを見いだし、この構造を「フック基底膜」と名付けた。スケールバーは5μm。
フック基底膜の成分の一つは、上皮細胞で作られる細胞外マトリックスタンパク質であるラミニン[6]α5でした。ラミニンは、細胞膜上の受容体分子インテグリン[6]に結合し、細胞の接着を誘導するとともに、細胞にシグナルを伝える働きがあります。毛乳頭細胞を調べたところ、実際にラミニン認識型のインテグリンを大量に発現していることが確認できました。そこで、フック基底膜の成分であるラミニンα5が毛乳頭細胞のインテグリンと相互作用している可能性を検証するため、上皮細胞でラミニンα5が作られなくなる変異マウスを作製しました。すると、このマウスの毛乳頭では、相互作用の相手であるインテグリンが消失しており、また、毛包の発生・再生に関わる転写因子[9]LEF1[10]の発現も消失し、毛包再生周期の休止期が短くなりました(図4左)。
毛包が休止期から成長期に移行する際には、毛乳頭で産生される分泌タンパク質TGF-β[11]が幹細胞を活性化しますが、変異マウスでは正常より早くTGF-βシグナルが活性化されていました。すなわち、上皮側から産生されるフック基底膜成分(ラミニンα5)が、毛芽―毛乳頭間のシグナル伝達を制御していたのです。さらに毛包再生周期を複数回経ると、毛乳頭が毛芽から離れる毛包が観察されました(図4右)。
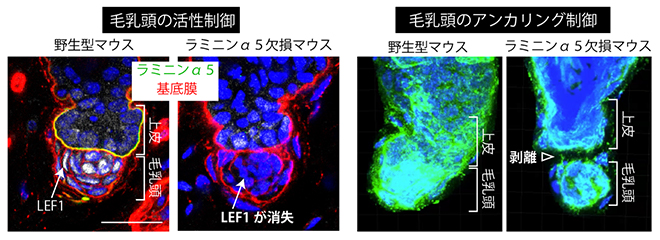
図4 フック基底膜による毛乳頭の活性制御(左)と上皮へのアンカリング(係留)制御
左)フック基底膜の構成成分であるラミニンα5を上皮細胞で欠失させると、毛包の発生・再生に関わる転写因子LEF1(白)の毛乳頭での発現が消失した。
右)ラミニンα5欠損マウスでは、出生後の毛包再生周期を複数回経ると、毛乳頭が上皮から離れる毛包が観察された(緑=基底膜)。スケールバーは20μm。
フック基底膜には、文字通り、毛乳頭を毛芽につなぎとめておく役割もあったのです。今回の研究で、異種組織間の相互作用を仲介する基底膜は、相互作用ごとに組成も構造も特殊化され、生化学的にも物理的にも、個別の相互作用に適したインターフェースを提供していることが明らかになりました(図5)。
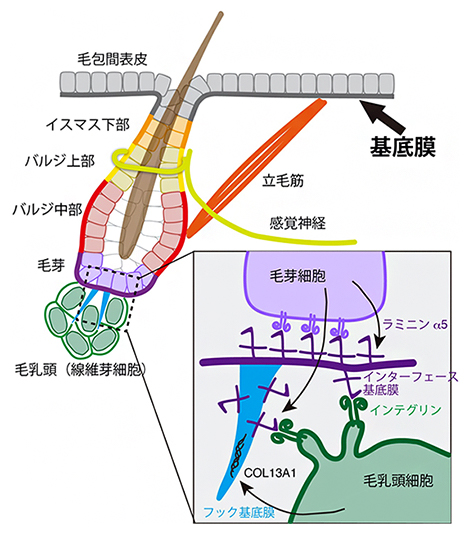
図5 基底膜による多様な組織間インターフェースの形成
毛包のさまざまなタイプの上皮幹細胞と、そこに接続する神経、筋肉、毛乳頭とのインターフェースを色分けで示した。これらのインターフェースには、それぞれ固有の組成と構造の基底膜が存在する。上皮は1枚の基底膜シートで覆われているが、基底膜の分子組成がパッチワークのように領域ごとに大きく異なることで、組織間相互作用ごとに最適化されたインターフェースを提供する。
今後の期待
多細胞生物の基盤である異種組織間の相互作用が、その境界に存在する基底膜によってどのように制御されているかはほとんど不明でした。本研究では、組織間相互作用の種類に応じて基底膜が最適化され、それがシグナル伝達などに重要な役割を果たしていることを明らかにしました。これは、多組織間相互作用の理解と制御には、基底膜インターフェースのさらなる理解が不可欠であることを意味しています。
オルガノイドなど、試験管内での器官形成研究では、多組織を包括した構造の形成が重要な課題となっています。従って、組織間の境界条件の理解と制御に関する研究は、今後の器官形成技術の開発に大きく貢献すると期待できます。
補足説明
1.毛包
毛をつくる小器官であり、触覚を感知する感覚器でもある。接続する立毛筋の収縮により、体温調整なども行う。周期的に毛と毛包を再生するため、幹細胞、器官再生、細胞分化研究のモデルとしてよく用いられる。
2.基底膜
細胞外マトリックスと呼ばれる細胞外に存在する非細胞性の構造体の一つ。100ナノメートル(nm、1nmは100億分の1m)程度の薄いシート状で、上皮細胞、内皮細胞、筋肉細胞、神経細胞、脂肪細胞などの足場となる。さまざまな細胞外マトリックス成分で構築される。
3.インターフェース(interface)
複数のものごとの接点や境界面を意味する語であり、特にコンピュータシステムでは、異なる機械やシステムを接続する機器や仕組みを指す。情報のやり取りや処理に重要な役割を果たす。
4.上皮
さまざまな器官の表面を覆う実質組織。体表を覆う皮膚や消化管などで発達している。外界から体内の構造を保護するバリア機能のほか、栄養分の吸収や生理活性物質の分泌など、外界との物質の交換に働く。細胞は、基底膜上にほぼ隙間なく並ぶ。
5.間充織
間葉とも呼び、一般には疎性結合組織のことを指す。大量の線維性細胞外マトリックスと、その中にまばらに存在する間葉系細胞からなる。
6.細胞外マトリックス、ラミニン、インテグリン
「細胞外マトリックス」は細胞外に存在する構造体で、シート状の基底膜と線維状の間質性マトリックスに大別される。さまざまなタンパク質が重合した巨大複合体で、それらをコードする遺伝子は約300種類といわれている。糖鎖修飾を受けた細胞接着性のタンパク質が多く、さらにさまざまなシグナル伝達分子も結合する。「ラミニン」は、基底膜の主な成分の一つで、細胞表面にある接着分子「インテグリン」を介して細胞の接着を誘導したり、細胞にシグナルを伝達できる。
7.線維芽細胞
間充織を構成する主要な細胞で、さまざまな細胞外マトリックスや増殖因子を大量に分泌するなどの機能がある。近年、機能や性質の異なる多様な線維芽細胞が存在することが明らかになってきている。器官発生、再生、がんの進展など、あらゆる生命現象に関与している。
8.免疫組織染色法
成体組織内のある特定のタンパク質など(抗原)の局在を、それを特異的に認識する抗体を用いて検出する方法。蛍光物質などが結合した抗体を用いることで、抗原の局在を顕微鏡で可視化できる。
9.転写因子
DNAに結合するタンパク質の総称で、遺伝子の発現を制御する。細胞外からの刺激に応じて、対象とする遺伝子(群)の転写を開始あるいは停止させる。
10.LEF1
Tcf/Lefファミリーの転写因子の一種。Wntと呼ばれる分泌タンパク質によって活性化される細胞内シグナル伝達の下流で働くことが知られている。
11.TGF-β
分泌タンパク質の一種。細胞の増殖・分化・アポトーシスなどさまざまな機能に関わる。
国際共同研究グループ
理化学研究所 生命機能科学研究センター 細胞外環境研究チーム
技師(研究当時) 筒井 仰(つつい こう)
(現 フィンランド オウル大学 シニアリサーチャー)
大学院生リサーチ・アソシエイト 待田 大輝(まちだ ひろき)
技術員 中川 麻子(なかがわ あさこ)
研究員(研究当時) キュンミン・アン(Kyungmin Ahn)
研究員 森田 梨津子 (もりた りつこ)
チームリーダー 藤原 裕展(ふじわら ひろのぶ)
大阪大学 蛋白質研究所
教授 関口 清俊(せきぐち きよとし)
ワシントン大学 医学部
教授 ジェフリー・マイナー(Jeffrey H. Miner)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究、分野横断連携研究「疾患エピゲノム」)で実施し、日本学術振興会(JSPS)科学研究費補助金基盤研究B「位置情報システムによる皮膚の領域特異性の創出・維持・破綻メカニズムの解明(研究代表者:藤原裕展)」、同挑戦的萌芽研究「毛包バルジ幹細胞の特性決定における腱様機能獲得の意義(研究代表者:藤原裕展)」、同新学術領域研究(研究領域提案型)「血管―神経ワイヤリングにおける相互依存性の成立機構(領域代表者:高橋淑子)」領域の研究課題「領域特殊化された基底膜が仲介する知覚神経―毛包幹細胞相互作用(研究代表者:藤原裕展)」、科学技術振興機構(JST)戦略的創造研究推進事業CREST「多細胞間での時空間的相互作用の理解を目指した定量的解析基盤の創出(研究統括:松田道行)」領域の研究課題「体表多様性を創発する上皮―間充織相互作用の動的制御機構の解明(研究代表者:藤原裕展)」などによる支援を受けて行われました。
原論文情報
Ko Tsutsui, Hiroki Machida, Asako Nakagawa, Kyungmin Ahn, Ritsuko Morita, Kiyotoshi Sekiguchi, Jeffrey H. Miner, Hironobu Fujiwara, “Mapping the molecular and structural specialization of the skin basement membrane for inter-tissue interactions”, Nature Communications, 10.1038/s41467-021-22881-y
発表者
理化学研究所
生命機能科学研究センター 細胞外環境研究チーム
チームリーダー 藤原 裕展(ふじわら ひろのぶ)
技師(研究当時) 筒井 仰(つつい こう)
報道担当
理化学研究所 広報室 報道担当