2021-06-28 理化学研究所,東京工業大学
理化学研究所(理研)創発物性科学研究センター創発生体工学材料研究チームの多田誠一研究員、伊藤嘉浩チームリーダー(開拓研究本部伊藤ナノ医工学研究室主任研究員)と東京工業大学生命理工学院生命理工学系の小畠英理教授らの共同研究グループは、貝が分泌する水中接着タンパク質に含まれる翻訳後修飾アミノ酸[1]を含む人工合成ポリペプチド[2](接着性成長因子)を開発し、これをさまざまな材料に接着させ、細胞機能を制御できるようにしました。
本研究成果は、今後、再生医療のマトリックスや生体内環境により適した人工臓器など、医療材料開発に貢献するものと期待できます。
伊藤嘉浩チームリーダーらは、貝類が水中でも岩場に接着する原理を利用して、遺伝子組換え技術と酵素法により、無機材料に接着できるタンパク質を開発してきました。
今回、共同研究グループは、これまでの技術をさらに発展させ、完全に人工的な固相合成法[3]で、各種材料に接着性で細胞機能を制御できるポリペプチド2種類を作り出すことに成功しました。これらの新しいポリペプチドは、弱アルカリ性の水溶液に溶かしてから、通常の固体表面へ処理すると、有機、無機材料問わず、表面に強く結合しました。そして、処理した材料はどれも細胞増殖の活性化や、分化誘導を促進する効果を持ち、それらの効果は成長因子だけが溶液状態で存在した場合よりも高いことが分かりました。
本研究成果は、科学雑誌『Advanced Science』オンライン版(6月28日付)に掲載されます。
背景
現代医療では、さまざまな材料が体内で人工臓器あるいは医療機器の一部として、体内や生体成分と接触して用いられています。例えば人工骨、人工関節、歯科インプラントは、金属やセラミックスなど固い無機材料が、眼内レンズ、人工血管、透析モジュールはプラスチックなどの有機材料が使用されるなど、幅広い種類の材料が活用されています。これら医療用の材料として選ばれる素材は生体適合性を考慮して選抜されていますが、必ずしも生体との接着性や移植後の生着性が十分ではなく、材料表面の処理によってこれらの性質を高める手法が模索されてきました。
生体材料の生体親和性を向上させるため、生理活性を持つタンパク質を材料表面に固定する手法がよく用いられます。伊藤嘉浩チームリーダーらはこれまでに、ムラサキイガイ[4]などの貝類が岩場に接着する際に分泌する接着性タンパク質の含有成分で、接着活性を持つ3, 4-ジヒドロキシフェニルアラニン(DOPA)[5]を、成長因子タンパク質の一種であるインスリン様成長因子1(IGF-1)[6]に遺伝子組換え技術と酵素法を用いて導入し、チタン表面に強固に結合させることに成功しています注1)。
今回は従来の技術を発展させ、完全に人工的にDOPAを導入した細胞成長因子のアミノ酸配列を持つ全長ポリペプチドの合成に挑戦しました。
注1)2016年7月11日プレスリリース「細胞を活性化できるチタン」
研究手法と成果
無機または有機材料の表面に成長因子と呼ばれるタンパク質を固定化すると、材料に細胞成長促進活性を付与できることから、これまでにもさまざまな固定化法を用いてさまざまな成長因子タンパク質が開発されました。ただし、材料の種類に合った固定化法を都度検討する必要がありました。
そこで共同研究グループは、材料によらず、かつ簡単な処理で固定化できる成長因子となるポリペプチドを開発しました。アミノ酸を化学反応のみで順番に連結してペプチドを合成する、ペプチド固相合成法の技術を利用して、成長因子タンパク質配列とC末端側にDOPAを持つ接着性ペプチドとを連結したポリペプチド(接着性成長因子)の全長を化学合成によって作製しました(図1)。
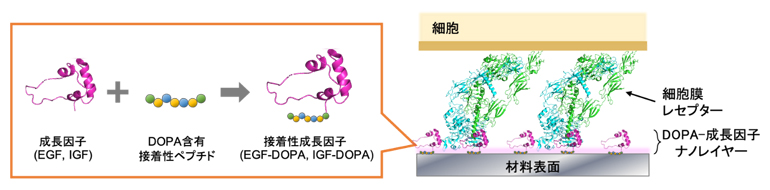
図1 DOPA含有接着性ペプチドを連結した接着性成長因子による材料表面への生理活性付与
成長因子の末端にDOPA含有接着性ペプチドを連結した接着性成長因子を作製し、材料表面にその溶液を添加すると、DOPAの作用により表面に成長因子を提示したナノレイヤーが形成された。そのレイヤー上で細胞を培養すると、表面に固定化された成長因子と細胞膜上の受容体(レセプター)とが相互作用し、細胞の増殖や分化を促進する効果が確認された。
具体的には、上皮細胞成長因子(EGF)[7]とIGF-1(以下IGF)のそれぞれのC末端に、DOPA含有接着性ペプチド配列X-K-X-K-X-G(X:DOPA、K:リジン、G:グリシン)を連結したポリペプチドEGF-DOPAとIGF-DOPAを合成しました。弱アルカリ性の水溶液に溶かした両ポリペプチドの結合性を金属材料であるチタン、セラミックス材料であるヒドロキシアパタイト、有機材料であるポリスチレンの各材料表面で評価したところ、いずれの材料表面上でもDOPA含有接着性ペプチドの連結によって成長因子タンパク質の結合量が増加しました(図2)。
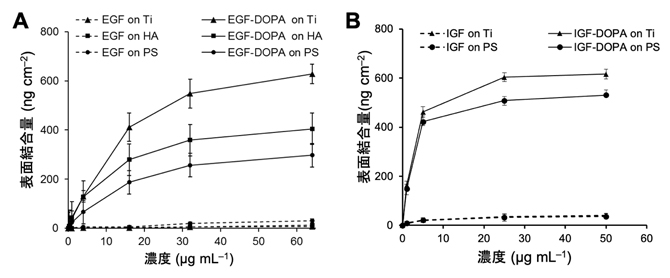
図2 接着性成長因子の材料表面への結合量
A:上皮細胞成長因子(EGF)およびポリペプチドEGF-DOPAの材料表面への結合量。Tiは、金属材料のチタン、HAはセラミック材料のヒドロキシアパタイト、PSは有機材料のポリスチレンを示す。EGFだけでは材料表面への結合は弱いが(破線)、DOPAを含有させたポリペプチドでは強い結合が見られた(実線)。
B:インスリン様成長因子(IGF)およびポリペプチドIGF-DOPAの材料表面への結合量。IGFだけでは材料表面への結合は弱いが(破線)、DOPAを含有させたポリペプチドでは、チタンとヒドロキシアパタイトでは強い結合が見られた(実線)。
次に、EGF-DOPAとIGF-DOPAの表面固定時の生理活性を評価しました。3種の材料表面にEGF-DOPAを固定化した表面上でNRK49F細胞(ラット腎由来)を培養したところ、接着性ペプチドのない通常のEGFが培養液中に存在している場合と比較して、各材料表面で最大約1.5倍の細胞増殖誘導効果の増大が確認されました(図3A-C)。IGF-DOPAを固定化したチタン表面では、MC3T3-E1細胞(マウス頭蓋冠由来)の骨芽細胞分化に伴う石灰化を評価したところ、通常のIGFと比較して最大2.2倍の分化誘導効果の増加が確認されました(図3D)。
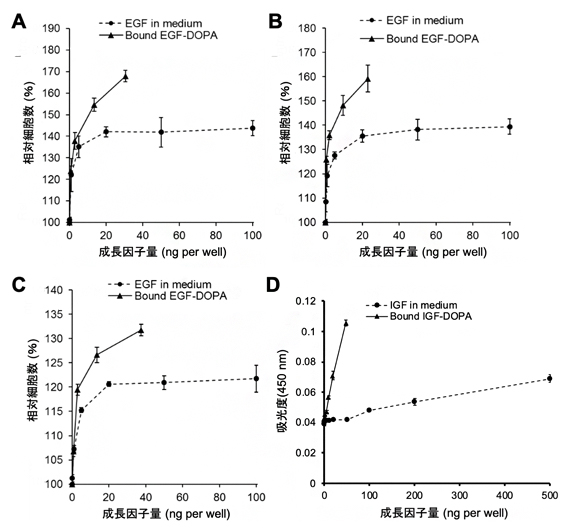
図3 接着性成長因子の生理活性評価
A,B,C:EGF-DOPA固定化表面上でのNRK49F細胞(ラット腎由来)の増殖誘導効果。相対細胞数はEGFを添加しない条件での細胞数を100%としたときの比率を示す。Aはチタン上、Bはヒドロキシアパタイト上、Cはポリスチレン上の効果を示す。通常のEGFと比較して各材料表面で細胞増加率が最大約1.5倍増加した。例えば、Bの例では(159-100)/(139-100)=1.51である。
D:IGF-DOPA固定化チタン表面上でのMC3T3-E1細胞(マウス頭蓋冠由来)の骨芽細胞誘導能評価。アリザリンレッドによる染色後、吸光度測定により定量化した。通常のIGFと比較して、細胞分化による吸光度増加率が最大2.2倍増加した。
また、チタン表面に固定化されたEGF-DOPAは細胞内に取り込まれることなく、持続的に細胞を刺激し、増殖誘導していることが分かりました。さらに、固定化されたEGF-DOPAは細胞の接着面から細胞(細胞膜に存在する受容体)を刺激していることが共焦点顕微鏡[8]による観察結果から明らかになりました(図4)。
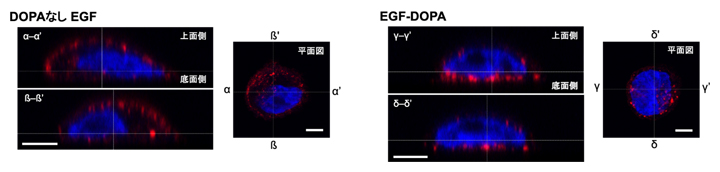
図4 EGF-DOPA固定化表面上での細胞刺激
α-α’、β-β’、γ-γ’、δ-δ’はそれぞれ、平面図に示された箇所の垂直断面図。赤色部はEGFによって刺激された細胞膜受容体(リン酸化EGF受容体)、青色部は核を示している。左側のDOPAのない通常のEGFでは細胞膜全体にEGF刺激箇所が分布しているが、右側のEGF-DOPA表面上ではEGF刺激箇所が底部に集中しており、EGF-DOPAが細胞の接着面から細胞を刺激していることが分かる。スケールバーは5マイクロメートル(μm、1μmは1,000分の1mm)。
今後の期待
本研究により、接着性を持ち、細胞増殖や分化誘導を促進する2種類のポリペプチドが活性を損なうことなく、チタン、ヒドロキシアパタイト、ポリスチレンの各材料表面に固定化される手法を確立しました。複数種の成長因子タンパク質を金属、セラミックス、プラスチックの各材料表面に固定化できたことは、本手法の汎用性の高さを示します。現在利用されている生体材料は多岐にわたり、今後生体親和性のさらなる向上が課題となります。そのため、本手法の活用によって利用部位に応じた分子を各材料表面に固定化することで、生体内環境により適した人工臓器の開発に貢献すると期待できます。
また近年、情報通信技術やデバイスの小型化が進んでおり、将来的には体内埋込型の生体内情報計測機器の開発が期待されています。本研究の手法は多様な材料表面の修飾が可能であるため、さまざまな生体機能性の埋込型計測機器の実現にも貢献できると考えられます。
補足説明
1.翻訳後修飾アミノ酸
タンパク質やペプチドは生体内での翻訳反応により、20種類のアミノ酸を連結して生合成されるが、その20種類とは構造が異なるものの、天然に存在することが確認されているアミノ酸。このようなアミノ酸は、翻訳反応によって生成されたタンパク質やペプチドが酵素反応によって官能基の修飾を受ける(翻訳後修飾)ことで合成されるため、「翻訳後修飾アミノ酸」と呼ばれる。
2.ポリペプチド
多数のアミノ酸がペプチド結合によって連なった化合物。
3.固相合成法
化学合成法の一つで、分子をビーズなど固相上に連結させ、反応試薬の溶液中に入れることで、合成反応を段階的に行う方法。液相中で行われる通常の合成法と比べると、生成物から未反応の反応試薬や副生成物を除去しやすく、核酸やペプチド合成に用いられる。
4.ムラサキイガイ
食用にされる場合にはムール貝とも呼ばれ、足糸(そくし)によって濡れた岩場などに強力に接着できるため、その機構はバイオ接着材としての研究対象にもなっている。
5.3, 4-ジヒドロキシフェニルアラニン(DOPA)
チロシンの芳香族基にヒドロキシ基が付加したアミノ酸で、翻訳後修飾によってタンパク質中に生成される。
6.インスリン様成長因子1(IGF-1)
インスリンに類似した分子構造をもつホルモンで、IGF-1は70個のアミノ酸からなり、分子量は7649。細胞表面に存在する固有の受容体に結合して、細胞の成長の調節に重要な役割をする。
7.上皮細胞成長因子(EGF)
53個のアミノ酸から成る分子量6045のタンパク質。細胞表面に存在する上皮成長因子受容体に結合して、細胞の成長の調節に重要な役割をする。
8.共焦点顕微鏡
試料の蛍光を観察する際に、検出される蛍光をピンホールによって絞り込むことで、焦点面以外からの蛍光を除去し、焦点面のみの蛍光像を精細に取得する顕微鏡観察技術。異なる高さの複数の平面像を連続的に取得してコンピューター上で再構築することで、試料の垂直断面像の表示が可能になる。
共同研究グループ
理化学研究所
創発物性科学研究センター 創発生体工学材料研究チーム
研究員 多田 誠一(ただ せいいち)
大学院リサーチ・アソシエート(研究当時) ユン・ヘオ(Yun Heo)
チームリーダー 伊藤 嘉浩(いとう よしひろ)
(開拓研究本部 伊藤ナノ医工学研究室 主任研究員)
開拓研究本部 伊藤ナノ医工学研究室
研修生 シュエリー・レン(Xueli Ren)
訪問研究員(研究当時) 毛 宏理(ホンリー・マオ)
訪問研究員(研究当時) シンへ・パク (Shin-Hye Park)
専任研究員 礒島 隆史(いそしま たかし)
訪問研究員(研究当時) リーピン・ツー(Liping Zhu)
国際リサーチ・アソシエート(研究当時) ショウユエ・ジュウ(Xiaoyue Zho)
脳神経科学研究センター 研究基盤開発部門 生体物質分析支援ユニット
専門技術員 伊藤 玲子(いとう れいこ)
テクニカルスタッフⅠ 藏田 紫乃(くらた しの)
テクニカルスタッフⅡ 大﨑 恵(おおさき めぐみ)
東京工業大学 生命理工学院 生命理工学系
教授 小畠 英理(こばたけ えいり)
原論文情報
Seiichi Tada, Xueli Ren, Hongli Mao, Yun Heo, Shin-Hye Park, Takashi Isoshima, Liping Zhu, Xiaoyue Zhou, Reiko Ito, Shino Kurata, Megumi Osaki, Eiry Kobatake and Yoshihiro Ito, “Versatile mitogenic and differentiation-inducible layer formation by underwater adhesive polypeptides”, Advanced Science, 10.1002/advs.202100961
発表者
理化学研究所
創発物性科学研究センター 創発生体工学材料研究チーム
研究員 多田 誠一(ただ せいいち)
チームリーダー 伊藤 嘉浩(いとう よしひろ)
(開拓研究本部伊藤ナノ医工学研究室主任研究員)
東京工業大学 生命理工学院・生命理工学系
教授 小畠 英理(こばたけ えいり)
報道担当
理化学研究所 広報室 報道担当
東京工業大学 総務部 広報課


