2021-07-02 東京大学
- 発表者
- 中里 一星(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 修士課程2年)
奥野 未来(東京工業大学 生命理工学院 博士研究員/ 久留米大学医学部 医学科 助教)
山本 宏(京都大学大学院理学研究科 生物科学専攻 博士研究員)
田村 美子(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 技術補佐員)
伊藤 武彦(東京工業大学 生命理工学院 教授)
鹿内 利治(京都大学大学院理学研究科 生物科学専攻 教授)
髙梨 秀樹(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 助教)
堤 伸浩(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 教授)
有村 慎一(東京大学大学院農学生命科学研究科 生産・環境生物学専攻 准教授)
発表のポイント
- モデル植物シロイヌナズナの葉緑体ゲノムの編集に初めて成功しました(図1)。
- 細胞あたり1,000個以上ある葉緑体ゲノムの全てにおいて標的の一塩基を変化させました。
- 葉緑体ゲノム改変を通じた光合成能力の強化や作物の品種改良などが期待されます。
発表概要
葉緑体ゲノム上にある光合成の重要遺伝子を改変することで、作物の光合成能力の向上と、それに伴う収量やバイオマスの改善が期待されますが、従来の葉緑体ゲノム改変技術は適用できる植物種が限られる上、外来遺伝子が葉緑体ゲノム内に残り、いわゆる遺伝子組換え生物となるため、作物の品種改良への応用に問題がありました。
東京学大学院農学生命科学研究科の中里一星大学院生と有村慎一准教授らのグループは、モデル植物(注1)シロイヌナズナの核ゲノムに新しいゲノム編集遺伝子(注2)を導入し、細胞内で作られたゲノム編集酵素を葉緑体へ輸送させることで、葉緑体ゲノムの特定の塩基(注3)のみが別の塩基に置き換わった植物体を作出することに成功しました。また、この植物の次世代では、「核内に導入したゲノム編集遺伝子を持たない植物」を得ることができました。このことは日本を含むいくつかの国で遺伝子組換え生物に該当しない、葉緑体ゲノム改良植物を作製可能であることを示しています。本成果は多様な植物種や作物で葉緑体ゲノムの改変を通じた品種改良の実用化に貢献する技術になると期待されます。
発表内容
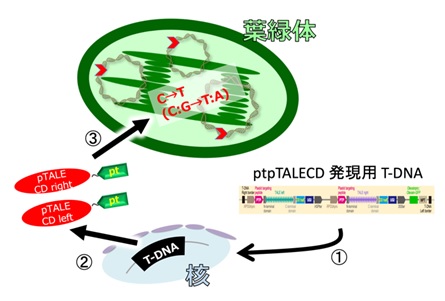
図1 本研究のイメージ図(掲載予定雑誌の表紙コンペに応募中の写真) ©️ウチダヒロコ
色素体(葉緑体や白色体などを含む細胞小器官の一種)(緑)の中のゲノムDNA(15万文字)中の特定の狙った1塩基(赤背景)だけをCからTに変化させた。
図2 実験概念図
人工標的塩基置換酵素ptpTALECDをコードしているDNAを、①植物の核ゲノムに導入し、②そこから二つの酵素が転写/翻訳され(左右一組で使用:赤)、③葉緑体以降シグナル(緑pt)の配列情報に従って、葉緑体の中に運ばれる。葉緑体の中には多数の環状ゲノムが存在するが、その全てで標的(赤矢尻)塩基を変化させることができた。
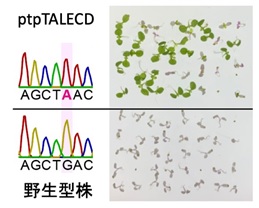
図3 実験結果
ptpTALECD導入株(上)では、葉緑体ゲノムの特定の塩基配列を調べたところ、野生型でGであった文字がAに(相補鎖のCがTに)完全に置換されていた。また、抗生物質スペクチノマイシンをいれた培養ゲル上では、野生型は枯れてしまう(下)が、ptpTALECD導入株では、葉緑体ゲノムのこの塩基置換によって健全に育つようになった。
植物の細胞内で光合成を担う葉緑体は、細胞核とは異なる独立したゲノムを持っており、そこには光合成に重要な遺伝子がコードされています。これらの遺伝子を改変し植物の光合成能力を高めることができれば、作物の収量やバイオマスの向上が期待されるため、最終的には人口増加に伴う食糧供給問題の解決や地球環境に優しいバイオ燃料の増産に貢献できる可能性があります。しかし、外来遺伝子を葉緑体ゲノムに挿入する従来の葉緑体ゲノム改変技術は適用できる植物種が限られる上に、作られた植物体が遺伝子組換え生物に該当するため、作物の品種改良に応用するにあたり問題があります。また、ゲノム編集を行なっても、細胞内に1,000コピー以上も存在するとされる葉緑体ゲノムにおいて、きちんと全ての遺伝子コピーを改変することができるのか(homoplasmyと呼びます)は疑問視されていました。本研究ではこれらの問題点を乗り越え、また、これまで適用が難しかったモデル植物シロイヌナズナを用いて葉緑体ゲノムを改変することに成功しました。
本研究ではまず、人工制限酵素platinum TALENのDNA結合ドメイン(注4)に葉緑体移行シグナル配列と、DNA塩基のシトシン(C)をチミン(T)という別の塩基に変換する酵素とを融合させたゲノム編集タンパク質plastid-targeted platinum TALE cytidine deaminase(ptpTALECD)の設計図となるDNAを、モデル植物シロイヌナズナの核ゲノムに導入しました。植物の細胞内で作られたptpTALECDタンパク質は、これに付加した葉緑体移行シグナルにしたがって葉緑体の中へ運ばれ、二つのTALEドメインが葉緑体ゲノム上の標的DNA配列に結合します。すると、二つのTALEドメイン結合配列の間の14~16 bpの部分(target window)にある特定のCがTに変換され、最終的に一細胞あたり1,000コピー以上あると言われる葉緑体ゲノムの特定のCが全てTに変換された植物体を得ることに成功しました(図2・3)。
一般にゲノム編集技術を用いる際には、標的部位以外にも変異が入るオフターゲット効果が問題になることがあります。そこで、本技術においてもこれが大きな問題になるかを検証するため、今回の実験で得られた植物体の葉緑体ゲノム全体を次世代シークエンサー(注5)によって解読しました。その結果、オフターゲット効果は総じて少なく、変異の程度も低かったことから、本技術を用いることで標的塩基のみを高精度に置換できることが明らかになりました。
次に、導入した変異が後代に遺伝しているかどうかを調べるために、target window内の特定の塩基が完全に置換された7系統の自殖後代(注6)のDNA配列を解読したところ、7系統全てで親が持つ変異が後代に安定して遺伝していたことが分かりました。この中には、親の核ゲノムに導入したptpTALECDの設計図となるDNAが分離・消失し、核ゲノム中に外来DNAを持たない個体も存在しました。このような個体は日本を含むいくつかの国では遺伝子組換え生物としての取り扱いの適用外であり、作物の品種改良へ応用するにあたり大きな利点があります。
本研究により、ptpTALECDという新しいゲノム編集タンパク質の設計図となるDNAをシロイヌナズナの核ゲノムに導入することで、最終的に葉緑体ゲノム上の特定の塩基が置換された非遺伝子組換え型植物を作出可能であることが明らかになりました。核ゲノムへのDNAの導入は、従来の葉緑体ゲノム改変技術である葉緑体ゲノムへのDNAの導入と比べて多くの植物種に適用でき、従ってこれまでよりも幅広い植物種で葉緑体ゲノムの改変ができるようになると考えられることから、本成果は植物科学の基礎研究と作物生産の応用展開の両面への貢献が期待されます。
発表雑誌
- 雑誌名
- Nature Plants
- 論文タイトル
- Targeted base editing in the plastid genome of Arabidopsis thaliana
- 著者
- Issei Nakazato, Miki Okuno, Hiroshi Yamamoto, Yoshiko Tamura, Takehiko Itoh, Toshiharu Shikanai, Hideki Takanashi, Nobuhiro Tsutsumi, Shin-ichi Arimura*(*責任著者)
- DOI番号
- 10.1038/s41477-021-00954-6
- 論文URL
- https://www.nature.com/articles/s41477-021-00954-6
問い合わせ先
東京大学大学院農学生命科学研究科 生産・環境生物学専攻
准教授 有村 慎一(ありむら しんいち)
用語解説
注1 モデル植物
研究によく使われる代表的植物のこと。生活環(世代交代)の時間が短い、生育に必要なスペースが狭くてもよい、育てやすい、ゲノムが解読されている、ゲノムが比較的単純で遺伝子操作しやすい等の理由により、統一的な研究解析の対象として使われる。シロイヌナズナは双子葉植物のモデル生物として広く用いられている。
注2 ゲノム編集
生物が持つゲノムDNAの塩基配列の中で特定の塩基配列を高精度に認識し、人為改変すること。
注3 塩基
DNAの構成要素で、シトシン(C)、チミン(T)、アデニン(A)、グアニン(G)の4種類からなる。この並び順が、生体反応を担う多様なタンパク質の設計図としてそれらの配列を決定する。
注4 人工制限酵素platinum TALENのDNA結合ドメイン
TALENは任意のDNAに結合しその近傍を切断することができる人工制限酵素。platinum TALENは、広島大学佐久間氏、山本氏らによって開発された改良型TALEN。
注5 次世代シークエンサー
DNAの塩基配列を高速大量に解読できる第二世代型の装置。
注6 自殖後代
ある個体がもつ自身の雄しべと雌しべ間で受粉させてできた次世代のこと。