ウイルスに対する宿主応答メカニズムの解明に新たな視点
2018-06-26 東京大学,日本医療研究開発機構
発表者
河岡 義裕(東京大学医科学研究所 感染・免疫部門 ウイルス感染分野 教授)
発表のポイント
- インフルエンザウイルスに感染したマウスの肺を、生きたままの状態で観察した。
- インフルエンザウイルスの病原性について、免疫細胞の動きや血液の流れなどの変化を生きたまま観測し、定量化することに成功した。
- インフルエンザウイルスに対する免疫応答メカニズムの解明に役立つことが期待される。
発表概要
この度、東京大学医科学研究所感染・免疫部門ウイルス感染分野の河岡義裕教授らの研究グループは、インフルエンザウイルスに感染したマウスの肺を、生体イメージング法(注1)を用いて生きたまま観察することに成功しました。
インフルエンザは、時として致死性の肺組織障害を引き起こすため、医学・獣医学・公衆衛生上の対策が必須な呼吸器感染症です。インフルエンザウイルスに感染した肺では、免疫系の活性化をはじめ様々な宿主応答が誘導されると考えられていますが、従来の固定標本などを用いた解析では、細胞の動きや血液の流れなどの時間軸を持った情報を得ることはできませんでした。
本研究では、2光子励起顕微鏡(注2)を用いた生体イメージングシステムを構築することで、インフルエンザウイルスに感染したマウスの肺における免疫細胞の動きや血液の流れをタイムラプス像(注3)として撮影することに成功し、血流速度、血管透過性の変化、免疫細胞の移動速度などの観測、および、新たな病態生理学的なパラメーターとしての定量化解析を行うことができました。さらに、このイメージングシステムをバイオセーフティーレベル3 (BSL3) の施設に設置することで、季節性ヒトインフルエンザウイルス(H1N1)のみならず高病原性鳥インフルエンザウイルス(H5N1)(注4)に感染した動物の観察が可能となり、病原性の異なるウイルス株を比較解析することができました。
本研究で確立したインフルエンザウイルス感染肺の生体イメージングシステムは、他の肺疾患の解析にも応用が可能であり、様々な呼吸器疾患の病態解明にも役立つことが期待されます。
本研究成果は、2018年6月25日(米国東部夏時間 午後3時)、米国科学雑誌「Proceedings of the National Academy of Sciences of the United States of America」のオンライン速報版で公開されます。なお本研究は、東京大学と米国ウィスコンシン大学が共同で行ったものです。本研究成果は、国立研究開発法人科学技術振興機構(JST)戦略的創造研究推進事業、日本医療研究開発機構(AMED)(平成27年度以降)革新的先端研究開発支援事業 (LEAP)、感染症研究国際展開戦略プログラム(J-GRID)などの一環として得られました。
発表内容
①研究の背景・先行研究における問題点
時として致死性の呼吸器疾患を引き起こすインフルエンザウイルスは、ヒトでは国内だけでも毎年1千万人に感染し、産業動物であるブタやニワトリにおいても甚大な経済的被害を発生させており、医学・獣医学・公衆衛生上、最も対策が必要な病原体の一つです。インフルエンザウイルスの中には、稀にヒトに感染するH5N1高病原性鳥インフルエンザウイルスが存在し、その致死率は約50%となることが知られています。インフルエンザウイルスの病原性が異なる理由として、免疫系の活性化により肺に強い炎症が惹起されることが考えられていますが、その重症化メカニズムはいまだ十分に明らかになっていません。
インフルエンザウイルスに感染した細胞や感染した細胞に反応する免疫細胞を生理的な環境で観察することは、宿主応答メカニズムやウイルスの病原性を詳細に解析するための最も基本となる情報です。2光子励起顕微鏡を用いた生体イメージング法は、生きた細胞へのダメージが少なく、組織深部を高解像度で観察可能なため、生きた動物の体内における細胞の動きを観察する方法として有用です。しかしながら、呼吸のために拡張と収縮運動を繰り返す肺は、視野の固定が難しく生体での観察は困難と考えられています。また、ウイルスが感染した動物を生きたまま実験に用いる際には、病原性ウイルスが外部へと拡散しないように封じ込める専門の設備や施設も必要です。さらに、細胞の動きを追跡する生体イメージング法では、観察対象である感染細胞や免疫細胞を生きた動物の体内で蛍光標識する必要があります。世界中で精力的な研究や開発が進められていますが、前述の課題のために、インフルエンザウイルスに感染した動物の体内、特に肺を2光子励起顕微鏡で観察することは困難とされてきました。
これまでに河岡教授らは、蛍光たんぱく質を安定的に発現する可視化インフルエンザウイルス(Color-flu)の作製に成功し、感染細胞を蛍光標識することを可能としてきました。(注5)本研究により、Color-fluに感染した肺の生体イメージング法を確立したことで、感染組織の詳細な観察が可能となり、インフルエンザウイルスの病原性メカニズムについて新たな知見を得ることができました。
②研究内容(具体的な手法など詳細)
本研究では、肺を吸引保持することで呼吸変動を抑える観察装置(肺吸引保定装置)を開発し、2光子励起顕微鏡や動物の生命維持に必要な周辺機器を導入することで、インフルエンザウイルスに感染した動物の生体イメージングシステムを構築しました(図1)。このイメージングシステムは、高病原性鳥インフルエンザウイルスを含む病原性の高い感染動物を取り扱うことのできるBSL3施設内に設置しました。
野生型マウスに、感染細胞において蛍光タンパク質Venusを発現するColor-fluを感染させることで感染細胞を可視化しました。本研究では、病原性の異なる2株のColor-flu[季節性インフルエンザウイルス(PR8株)と高病原性鳥インフルエンザウイルス(H5N1株)]を用いることで、ウイルスに感染した肺における病態生理学的な変化とウイルスの病原性との関連を比較しました。肺の血流を可視化するための蛍光デキストランと免疫細胞の一種である好中球を可視化するための抗Ly-6G抗体を経静脈的に投与して蛍光標識しました。ウイルスに感染したマウスは麻酔下で管理し人工呼吸器で補助しながら開胸し、露出させた肺を肺吸引保定装置で保持しました。保定された感染肺を2光子励起顕微鏡で撮影することで、インフルエンザウイルスに感染したマウスの肺内を流れる血液や遊走する好中球の姿を捉えることに成功しました(図2)。タイムラプス像で撮影した肺の病態生理学的な変化は、画像解析ソフトで定量化して解析を行いました。
撮影中に蛍光デキストランを投与すると血管透過性を評価することができます。非感染マウスやPR8株に感染したマウスでは、蛍光デキストランが投与された途端に肺胞の血流が蛍光標識され血管構造がはっきりと検出できました。一方、H5N1株に感染したマウスの肺では、蛍光デキストランが血管から肺胞内へと漏出する様子が顕著に認められました(図3)。また、マウスの血管内に小さな蛍光ビーズ(直径1μm)を流し、2光子励起顕微鏡を用いて軌跡を追うことで血流速度を算出することができます。インフルエンザウイルスに感染した肺を観察すると、肺の血流速度が低下していることが明らかとなりました。
続いてウイルスに感染した肺に遊走してくる好中球を計数すると、PR8株とH5N1株への感染のどちらでも、感染初期に一過性に好中球の数が増加することが明らかとなりました。さらに、マウスの肺における好中球の動きを詳細に解析すると、低速(≦50 μm/秒)と高速(>50 μm/秒)の2つの運動性を繰り返しながら移動することが分かりました。インフルエンザウイルスに感染したマウスでは、低速で好中球が移動する頻度が非感染マウスと比べて増加することで、好中球の移動速度が低下していることが明らかとなりました(図4)。好中球の運動性が変化することは、感染局所での好中球の応答の変化を反映しているものと考えられます。
本研究では、異なる病原性ウイルス株間での病原性との関連について比較解析するために、生体イメージング法を用いて得られたデータを独自に開発した解析アルゴリズムを用いて定量化することに成功しました。H5N1株に感染した肺では、PR8株に比べ、好中球の呼び寄せられるタイミングが早くその数も統計学的に有意に多く、また血流速度の低下も早期に起こることから、H5N1株へ感染した早期に強い宿主応答が誘導されていることが分かりました。さらに、H5N1株への感染では血管透過性の亢進が顕著に認められ、組織障害が激しく起こっていることが明らかとなりました。生体イメージング法を駆使することで得られた、インフルエンザウイルスに感染した肺における病態生理学的な変化についての知見は、インフルエンザにおける宿主応答メカニズムの解明に役立つものと考えられます。
③社会的意義・今後の予定 など
本研究において、2光子励起顕微鏡を用いて生体イメージングを行う手法を確立し、インフルエンザウイルスに対する免疫応答を細胞レベルで解析することが可能となりました。インフルエンザの病原性発現メカニズムの解明に役立ち、ワクチンや新規抗ウイルス薬の動物実験における評価にも応用できることから、ウイルス学や免疫学などの基礎的な研究からワクチンや薬剤開発に至るまで、幅広く利用されることが期待されます。さらに、本生体肺イメージングシステムは、様々な肺疾患の解析にも応用が可能であり、様々な呼吸器疾患の病態解明にも役立つことが期待されます。
発表雑誌
- 雑誌名:「Proceedings of the National Academy of Sciences of the United States of America」
(6月25日オンライン版) - 論文タイトル:In vivo imaging of the pathophysiological changes and neutrophil dynamics in influenza virus-infected mouse lungs
- 著者:Hiroshi Ueki, I-Hsuan Wang, Satoshi Fukuyama, Hiroaki Katsura, Tiago Jose da Silva Lopes, Gabriele Neumann, Yoshihiro Kawaoka*
用語解説
- (注1)生体イメージング法
- 生きたまま動物の体内を観察し、細胞や血液などの動きを画像として捉えて解析する方法。
- (注2)2光子励起顕微鏡
- 近赤外レーザーパルス光を用いた蛍光顕微鏡。長波長の光を使用することから、共焦点レーザー顕微鏡と比べて組織の深部を低浸襲的に観察することができる。
- (注3)タイムラプス像
- 一定間隔で撮影し、画像をつなぎ合わせて動画のようにして、細胞などの動きを観察する方法によって得られた像。
- (注4)H5N1高病原性鳥インフルエンザウイルス
- 鳥インフルエンザウイルスの一種であり、高率にニワトリを死亡させるウイルス。高病原性鳥インフルエンザウイルスH5亜型やH7亜型はヒトに対しても病原性が高いことが知られている。
- (注5)可視化インフルエンザウイルス(Color-flu)
- 感染した細胞が蛍光を発するレポーターインフルエンザウイルス。河岡義裕教授らが開発した。感染した体内で蛍光タンパク質を安定的に発現し、病原性も高いことから生体イメージングに適している。
2015年3月23日プレスリリース
添付資料
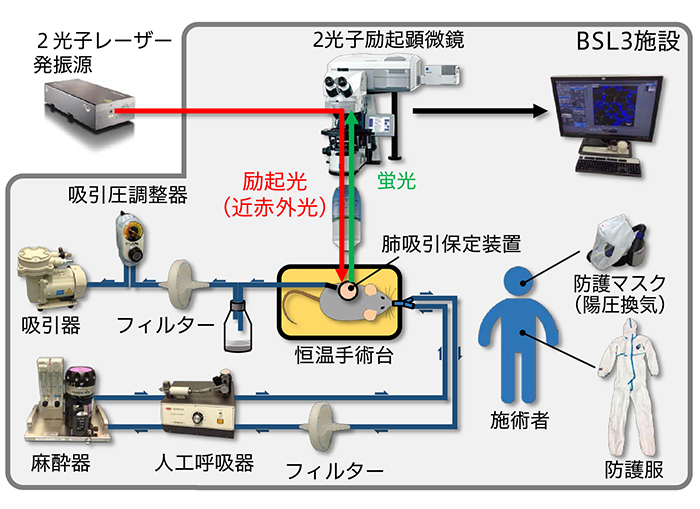
図1 生体イメージングシステムの模式図
BSL3施設内に設置した生体イメージングシステムです。呼吸変動を抑える肺吸引保定装置を開発し、2光子励起顕微鏡や動物の生命維持に必要な周辺機器を揃えることで、インフルエンザウイルスに感染したマウスの肺を観察することができます。
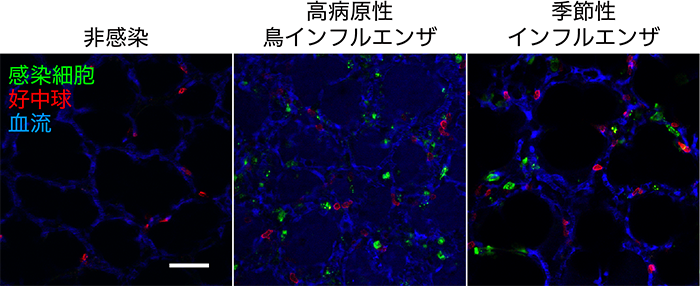
図2 インフルエンザウイルスに感染した肺の生体イメージング
インフルエンザウイルスに感染したマウスの肺を2光子励起顕微鏡で観察した様子です。感染細胞(緑)と好中球(赤)の動きや血液の流れ(青)を観察することができます。
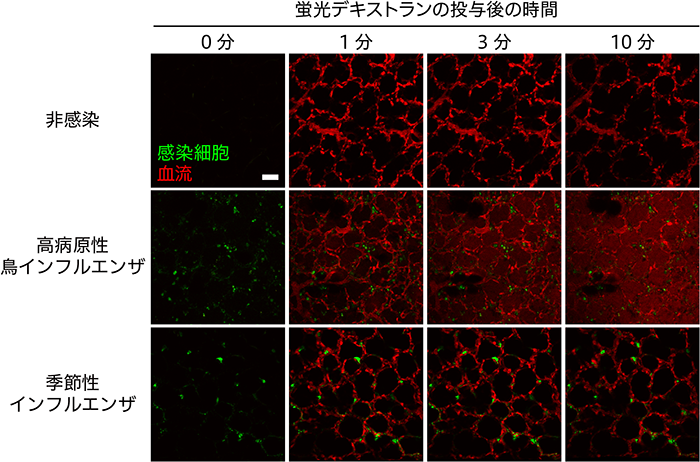
図3 インフルエンザウイルスに感染した肺における血管透過性の評価
蛍光デキストランを撮影中に投与し血管透過性を評価しました。高病原性鳥インフルエンザウイルスに感染したマウスの肺では、蛍光デキストラン(赤)が時間の経過とともに血管から肺胞内へと漏出する様子が認められました。
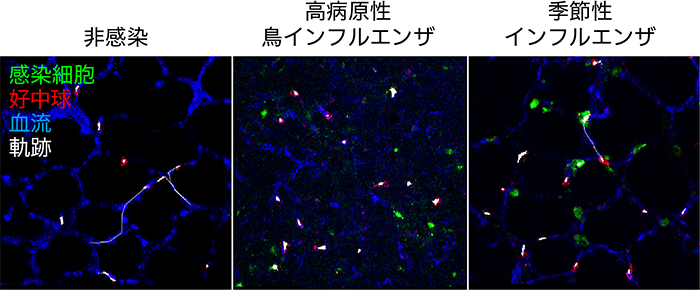
図4 インフルエンザウイルスに感染した肺における好中球の動き
インフルエンザウイルスに感染したマウスでは、非感染マウスと比べて好中球(赤)の軌跡(白線)が短いことからから、好中球の運動性が低下していることが明らかとなりました。
問い合わせ先
研究に関するお問い合わせ
東京大学医科学研究所 感染・免疫部門 ウイルス感染分野
教授 河岡 義裕(カワオカ ヨシヒロ)
報道に関するお問い合わせ
東京大学医科学研究所 総務チーム
国立研究開発法人日本医療研究開発機構(AMED)
経営企画部 企画・広報グループ
AMEDの事業に関するお問い合わせ
国立研究開発法人日本医療研究開発機構(AMED)
創薬戦略部 医薬品研究課
国立研究開発法人日本医療研究開発機構(AMED)
戦略推進部 感染症研究課