2021-07-15 理化学研究所,東京理科大学
理化学研究所(理研)生命医科学研究センターサイトカイン制御研究チームの久保允人チームリーダー(東京理科大学生命医科学研究所教授)らの共同研究グループは、インフルエンザウイルスに対する免疫反応がワクチン接種とウイルス感染では異なることを発見し、経鼻感染の方がワクチン接種よりも質の高い中和抗体である「広域中和抗体[1]」が産生されることを明らかにしました。
弱毒生ワクチン[2]の有効性を明らかにした本研究成果は、今後流行が予想されるインフルエンザウイルスだけでなく、感染拡大が懸念される変異型新型コロナウイルスに対しても有効なワクチンの開発に貢献すると期待できます。
今回、共同研究グループはマウスを用いて、インフルエンザウイルスの「不活化ワクチン[2]」接種と「弱毒生ワクチン」を模倣した経鼻感染において、生体内で産生される抗体の質的・量的比較を行いました。すると、不活化ワクチンではワクチン株に対抗できる抗体だけが産生されましたが、経鼻感染ではワクチン株だけでなく、構造の異なるウイルス株にも対抗できる広域中和抗体が産生されることが明らかになりました。この広域中和抗体は、免疫反応が起こるリンパ節内でT細胞[3]と抗体産生B細胞[3]が効率的に出会う胚中心[4]で産生されること、またB細胞の分化増殖因子であるインターロイキン4(IL-4)[5]を欠くマウスでは、この胚中心が十分に発達しないために広域中和抗体の量が激減することが分かりました。これにより、IL-4は胚中心内B細胞の増殖を促進することで、中和抗体の多様性を広げる重要な働きをすることが明らかになりました。
本研究は、オンライン科学雑誌『Nature Communications』(6月18日付)に掲載されました。
背景
現在、インフルエンザの予防のために広く使用されている「不活化ワクチン」は、ワクチンに使用したインフルエンザウイルス株に対しての有効性は高いものの、新しく現れた構造の異なるインフルエンザウイルス(新型インフルエンザウイルス)株に対しては有効性が低いといわれています。一方、ヒトでの調査研究から、「弱毒生ワクチン(変異によって弱毒化させたウイルスを使用)」の経鼻投与は、新型インフルエンザウイルスに対しても有効性があることが示されています。これは、弱毒生ワクチンでは、ウイルス株を超えて感染を防御できる質の高い中和抗体である「広域中和抗体」が産生される可能性があるからだと考えられていましたが、そのメカニズムは分かっていませんでした。
今後も出現が危惧される新型インフルエンザウイルスだけでなく、新型コロナウイルスによるパンデミック感染をも見据えたユニバーサルワクチン[6]の開発は重要な課題です。そのためには、広域中和抗体の産生メカニズムの解明が必須だと考えられます。そこで、共同研究グループは、不活化ワクチン接種と弱毒生ワクチンを模倣した経鼻ウイルス感染で産生される抗体の質的・量的違いおよび免疫応答の違いを調べることにしました。
研究手法と成果
共同研究グループはまず、不活化ワクチン接種では産生されず、経鼻ウイルス感染によってのみ産生される広域中和抗体を解析できるマウスモデルを作製しました。このモデルでは、2009年パンデミックインフルエンザウイルス株[7](パンデミック株)から作製した不活化ワクチンを接種したマウス、あるいは生きたパンデミック株を感染させたマウスから抗体をそれぞれ分離し、その抗体を別のマウスに移入したのち、季節性インフルエンザウイルス株[7](季節性ウイルス株)に感染させます。
実験の結果、不活化パンデミック株ワクチンを接種したマウスの抗体を移入したマウスは、季節性ウイルス株の感染によって死亡しましたが(図1上段)、パンデミック株を感染させたマウスの抗体を移入したマウスでは季節性ウイルス株の感染が防御されました(図1下段)。これは、不活化パンデミック株ワクチンを接種したマウスでは、ワクチンに使用したウイルス株に対抗できる抗体だけが産生されたのに対し、パンデミック株を感染させたマウスでは、構造の異なるインフルエンザウイルスに対しても対抗できる広域中和抗体が産生されたことを示しています。
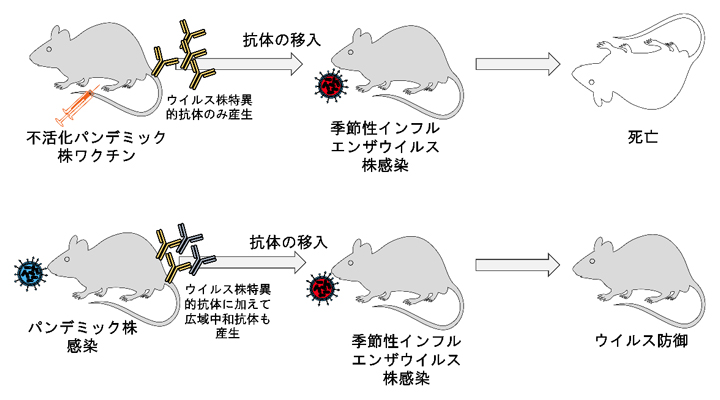
図1 不活化ワクチン接種マウスとウイルス感染のマウスにおける感染の違い
不活化パンデミック株ワクチンを接種したマウスの抗体を移入したマウスは、季節性インフルエンザウイルス株の感染によって死亡したが(上段)、生きたパンデミック株を感染させたマウスの抗体を移入したマウスは、季節性インフルエンザウイルス株の感染から防御された(下段)。
次に、生きたウイルスの感染が広域中和抗体を産生する原因として、ウイルスの侵入経路とウイルスの複製の二つを想定し、侵入経路を経鼻に統一し、ウイルスを複製しないマウス(Tmprss2欠損マウス[8])について調べました。その結果、Tmprss2欠損マウスでは、生きたパンデミック株ウイルスを感染させても広域中和抗体は産生されず、その抗体を移入したマウスは季節性ウイルス株に対する抵抗性を示しませんでした。一方、前述のパンデミック株に感染した野生型マウスの抗体産生B細胞を解析したところ、パンデミック株と季節性ウイルス株に共通するエピトープ[9](抗原決定基)を認識する抗体が産生されていることが分かりました。このことから、経鼻から生きたウイルスが体内に侵入するとB細胞の増殖に伴って共通エピトープが形成される過程が、広域中和抗体が産生されるメカニズムであることが示されました。
さらに、ウイルス複製がどのように広域中和抗体の産生につながるのかを明らかにするために、免疫器官のリンパ節、特にB細胞の選別に重要な働きをする「胚中心」と、B細胞の抗体産生を助ける働きをする「濾胞性ヘルパーT細胞(TFH細胞)[10]」に着目しました。胚中心とTFH細胞持たない遺伝子改変マウスを作製し、生きたパンデミック株を感染させたところ、広域中和抗体は産生されませんでした。
TFH細胞は、インターロイキン-4(IL-4)やIL-21などのサイトカイン[11]を産生することでB細胞の機能を助けることが知られています。ウイルスが感染した野生型マウスのリンパ節ではTFH細胞の著しい活性化が見られた一方、B細胞の分化増殖因子であるIL-4を欠損したマウスでは、胚中心の形成不全に伴い広域中和抗体の産生が著しく低下しました。これらの結果から、TFH細胞から産生されるIL-4は、胚中心内のB細胞の増殖をコントロールすることで、ウイルス感染時に産生される抗体の多様性を広げる重要な働きをすることが明らかになりました。
以上の結果から、生きたウイルスの経鼻感染は、TFH細胞を活性化することでB細胞の増殖に必要なIL-4を誘導し、リンパ節内の胚中心においてB細胞の中からウイルス株に共通したエピトープを認識するB細胞の選別が進められ、それが広域中和抗体の産生へとつながることが分かりました(図2)。
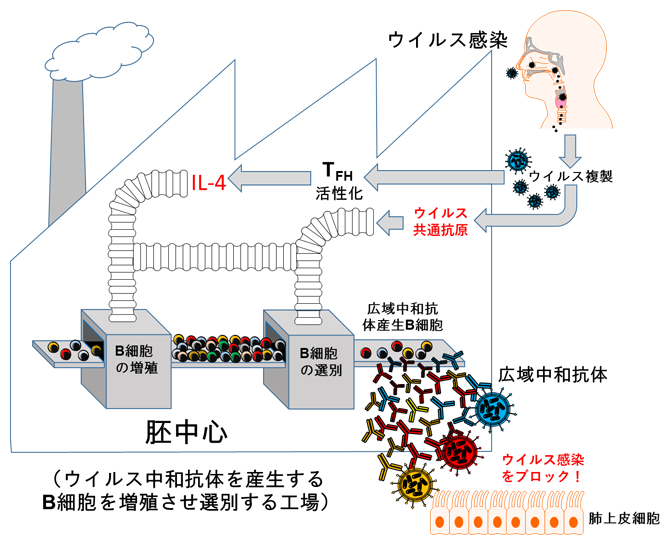
図2 広域中和抗体の産生メカニズム
ウイルス感染では、ウイルス複製に伴って活性化されたTFH細胞からのIL-4の働きで、胚中心においてB細胞の増殖が促進される。増殖したB細胞の中から、ウイルス株に共通したエピトープを認識するB細胞の選別が進められ、これが広域中和抗体の産生へとつながる。
本研究により、不活化ワクチンに比較して生ワクチンでは広域中和抗体を効率よく産生できることが明らかとなり、インフルエンザウイルス以外のウイルスに対しても弱毒生ワクチンの有用性を検討する必要があると考えられます。
今後の期待
本研究により、インフルエンザウイルス感染時における広域中和抗体の産生メカニズムの一端を解明できたことで、新型インフルエンザに対抗するためのユニバーサルワクチンの開発に有用な基礎データを提供できました。安全性の高い不活化ワクチンを使用しながら、TFH細胞を活性化することで広域中和抗体を誘導するワクチン投与法の検討を進める方針が確認できたことは、今後の抗ウイルスワクチン研究において大きな意義を持つと考えられます。
補足説明
1.広域中和抗体
ワクチンに使用したウイルス株以外のさまざまなウイルス株による感染を防御できる抗体のこと。
2.不活化ワクチン、生ワクチン
不活化ワクチンとはホルマリン処理などによって感染性を消失させたウイルス粒子を使用するワクチンであり、生ワクチンとは変異によって弱毒化させたウイルスを使用するワクチンである。
3.B細胞、T細胞
B細胞とは抗原に特異的な抗体分子を産生する細胞である。T細胞はヘルパーT細胞とキラーT細胞に分類され、ヘルパーT細胞の機能の一つとして、B細胞を補助してB細胞からの抗体産生を誘導することが挙げられる。
4.胚中心
2次リンパ節内に形成される抗体産生B細胞の選択と増殖に重要な細胞組織。胚中心内において、ヘルパーT細胞はB細胞を補助してB細胞からの抗体産生を誘導する。
5.IL-4(インターロイキン4)
サイトカインの一種であり、抗体産生やアレルギー反応に関与する。
6.ユニバーサルワクチン
ワクチン株以外のウイルス株に対しても広く中和抗体を誘導できるワクチンのこと。
7.2009年パンデミックインフルエンザウイルス、季節性インフルエンザウイルス
2009年パンデミックインフルエンザウイルスは2009年にパンデミックを引き起こしたブタ由来H1N1亜型インフルエンザウイルス。季節性インフルエンザウイルスはそれ以前から存在して毎年のインフルエンザウイルス感染の原因となってきたウイルスのこと。
8.Tmprss2欠損マウス
Tmprss2とは、インフルエンザウイルスのヘマグルチニン(ウイルス表面に存在する糖タンパク質)を活性化する宿主細胞側に存在する酵素である。Tmprss2を欠損したマウスではヘマグルチニンが活性化されないため、ウイルスの複製が起こらない。
9.エピトープ
T細胞やB細胞が認識する抗原部位のこと(抗原決定基)。
10.濾胞性ヘルパーT細胞(TFH細胞)
2次リンパ節の胚中心と呼ばれる領域に存在し、抗原に対して親和性の高い抗体を産生するB細胞の選択に重要な働きをするヘルパーT細胞の一種。
11.サイトカイン
細胞から分泌され近位の他の細胞によって認識されることで、細胞間の情報のやりとりに利用されるタンパク質。
共同研究グループ
理化学研究所 生命医科学研究センター
サイトカイン制御研究チーム
チームリーダー 久保 允人(くぼ まさと)
副チームリーダー 宮内 浩典(みやうち こうすけ)
分化制御研究チーム
副チームリーダー 福山 英啓(ふくやま ひでひろ)
統合細胞システム研究チーム
チームリーダー 柚木 克之(ゆぎ かつゆき)
研究員 出野 泉花(での せんか)
免疫細胞治療研究チーム
チームリーダー 藤井 眞一郎(ふじい しんいちろう)
東京理科大学 生命医科学研究所
分子病態学部門
教授 久保 允人(くぼ まさと)
技術員 原田 康代(はらだ やすよ)
学生 矢島 泰生(やじま たいき)
実験動物学研究部門
教授 岩倉 洋一郎(いわくら よういちろう)
国立感染症研究所
治療薬・ワクチン開発研究センター
センター長 高橋 宜聖(たかはし よしまさ)
主任研究官 安達 悠(あだち ゆう)
研究員 登内 奎介(とのうち けいすけ)
インフルエンザウイルス研究センター
センター長 長谷川 秀樹(はせがわ ひでき)
慶應義塾大学 医学部 微生物学免疫学教室
教授 吉村 昭彦(よしむら あきひこ)
かずさDNA研究所 ゲノム事業推進部
部長 小原 収(おはら おさむ)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金基盤研究(B)「広域中和活性を誘導する次世代ウイルスワクチン戦略(研究代表者:久保允人、19H03491)」、同基盤研究(C)「抗ウイルス広域中和抗体の誘導メカニズム(研究代表者:宮内浩典、18K06647)」、同基盤研究(C)「インフルエンザ交差反応性抗体の選択と防御メカニズムの解明(研究代表者:高橋宜聖、20K07545)」による支援を受けて行われました。
原論文情報
Kosuke Miyauchi, Yu Adachi, Keisuke Tonouchi, Taiki Yajima, Yasuyo Harada, Hidehiro Fukuyama, Senka Deno, Yoichiro Iwakura, Akihiko Yoshimura, Hideki Hasegawa, Katsuyuki Yugi, Shin-ichiro Fujii, Osamu Ohara, Yoshimasa Takahashi, and Masato Kubo, “Influenza virus infection expands the breadth of antibody responses through IL-4 signalling in B cells”, Nature Communications, 10.1038/s41467-021-24090-z
発表者
理化学研究所
生命医科学研究センター サイトカイン制御研究チーム
チームリーダー 久保 允人(くぼ まさと)
報道担当
理化学研究所 広報室 報道担当
東京理科大学 広報部広報課