2021-07-22 理化学研究所
理化学研究所(理研)生命機能科学研究センター生体モデル開発チームの清成寛チームリーダー、金子麻里テクニカルスタッフらの研究チームは、有袋類[1]の遺伝子改変に世界で初めて成功しました。
本研究成果は、長く謎である有袋類の発生メカニズムをはじめ、ヒトを含む有胎盤類[1]には見られない有袋類特有の性質を遺伝子機能レベルで解明することを可能とし、有袋類の生物学的基礎研究だけでなく、哺乳類の進化や多様性の理解に大きく貢献すると期待できます。
今回、研究チームは、有袋類の中では比較的飼育の容易なハイイロジネズミオポッサム(以下、オポッサム)を対象に、遺伝子改変動物の作製に必須な一連の基盤技術を開発し、CRISPR/Cas9システム[2]によるゲノム編集技術を用いることで、遺伝子改変有袋類の作製に成功しました。さらに、改変された遺伝子が次世代にも受け継がれることを確認しました。
本研究は、科学雑誌『Current Biology』の掲載に先立ち、オンライン版(7月21日付:日本時間7月22日)に掲載されます。

母親にしがみつく、ゲノム編集により色素合成遺伝子が改変された3匹のオポッサム
背景
現生の哺乳類は、カモノハシなどの単孔類[1]、コアラなどの有袋類、ヒトを含む有胎盤類の三つに分類されます。アメリカ大陸に生息するオポッサムは、系統的には有袋類の祖先的なグループであると考えられています。有袋類の中で最初に全ゲノムが解読されたハイイロジネズミオポッサム(以下、オポッサム)は、体長が約15cmであり、マウスやラットに似た飼育形態での繁殖、系統維持が可能であることから、有袋類では数少ない確立されたモデル動物の一つです。オポッサムは他の有袋類同様、短い妊娠期間(14日間)を経て未熟な新生仔を産みますが、カンガルーのような育児嚢(袋)を持たないため、仔は母親の乳房にしがみついて離乳期まで過ごします(図1)。
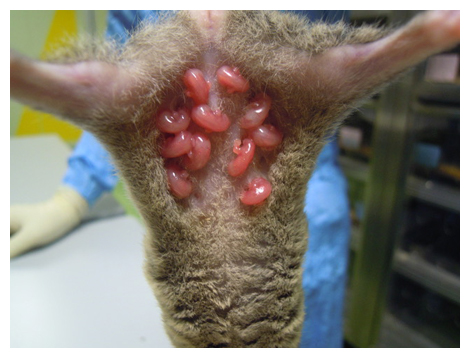
図1 出生直後のオポッサム
14日間の妊娠期間を経て、仔は未熟なまま産まれる。出生直後のオッポサムは、マウス(妊娠期間20日)では交尾後13~15日の胎仔、ヒトでは妊娠約40日の胎児に相当するとされる。カンガルーのような育児嚢(袋)を持たないため、仔は母親の乳房にしがみついて離乳期まで過ごす。
オポッサムは、機能的な胎盤を持たずに発生し、出生後の未熟仔の発達も容易に観察できること、ヒト以外の哺乳類では紫外線を照射するだけでメラノーマ[3]を形成する唯一のモデル動物であること、脊髄を損傷した新生仔が自然治癒力を持つこと、X染色体不活化[4]メカニズムが有胎盤類と異なることなど、他の哺乳類にはない、さまざまなユニークな特徴を持っているために、有袋類の基礎研究に多く利用されています。しかし、オポッサムを含む有袋類は、これまで遺伝子改変動物を作製するために必要な技術が確立されていなかったため、個体レベルで遺伝子機能を解析することが困難でした。
近年、CRISPR/Cas9システムによるゲノム編集技術の登場により、さまざまな生物種における遺伝子改変動物を作製できるようになっています。今回研究チームは、ゲノム編集を用いた遺伝子改変オポッサムの作製に必要な一連の生殖・発生工学[5]技術の開発に着手しました。
研究手法と成果
哺乳動物へのゲノム編集技術による遺伝子改変は、ゲノム編集に必要な溶液(Cas9タンパク質[2]やガイドRNA[2])を受精卵に注入して行うため、計画的に受精卵を採取する必要があります。オポッサムは発情周期が長く、縄張り意識も強いとされ、オスとメスを同居させても交尾までに1週間程度を要し、計画的に実験を進めることが困難でした。そこで研究チームは、マウスや他の実験動物で用いられる性腺刺激ホルモン[6]をメスに投与することで発情を促し、交尾までに要する期間を大幅に短縮することに成功しました(図2)。
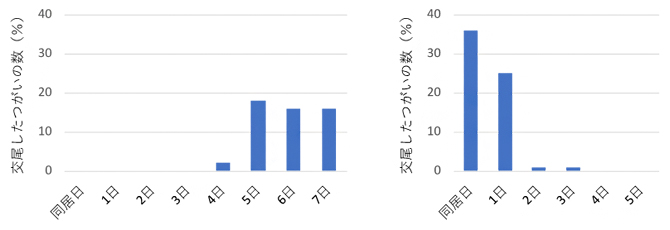
図2 ホルモン処理による交尾誘導
オスとメスを同居させてから、交尾が観察されるまでの日数。未処理のつがいは4~7日目に交尾をしたのに対し(左)、性線刺激ホルモンをメスに投与すると大半が0~1日目までに交尾を終えた(右)。
さらに、ゲノム編集を行った受精卵を発生させるためには、代理母体内に移植する技術(胚移植)が必要です。一般的にマウスやラットでは、受精卵を偽妊娠[7]状態にあるメスの卵管や子宮内に胚移植します。オポッサムについても同様の方法で偽妊娠状態にあるメスを準備し、その子宮内に採取した受精卵を移植したところ、無事に産仔を得られました。これまで、ワラビーやフクロネコの仲間など、有袋類のさまざまな種において胚移植が実施されましたが、いずれも出産にまで至ったケースはなく、今回初めて有袋類の胚移植技術が確立されました。
また、ゲノム編集に必要な溶液の注入は、前核期の受精卵へマイクロインジェクション法[8]を用いて行います。ところが、オポッサムの受精卵は、ムコイド層と呼ばれる糖タンパク質[9]の厚い層と、シェルコートと呼ばれる硬い殻のような構造に包まれているため(図3)、マウスやラットと同様のマイクロインジェクション法では、注入針が受精卵を貫通できませんでした(図4左)。研究チームは過去の研究から、マウス受精卵においてピエゾマイクロインジェクション法[8]を用いると、スムーズに注入針を挿入でき、受精卵へのダメージを軽減できることが分かっていました。そこで、オポッサムの受精卵にもピエゾマイクロインジェクション法を用いたところ、スムーズに注入針を刺すことができました(図4右)。

図3 オポッサムの前核期受精卵
交尾後34時間ほど経過した受精卵。卵管通過時に付加されるムコイド層と、卵管から子宮に移動する際に形成されるシェルコートに覆われている。これらの構造は発生が進むにつれて消失し、胚が子宮内膜上皮と接着する。スケールバーは100マイクロメートル(μm、1μmは1,000分の1mm)。
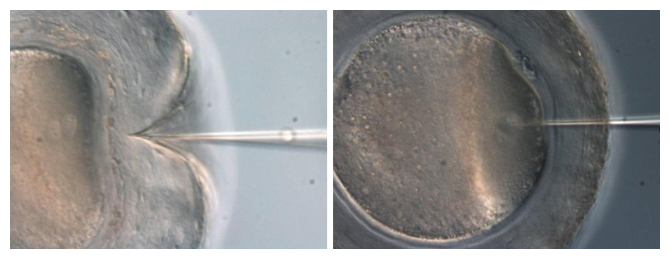
図4 前核期受精卵へのマイクロインジェクション
一般的なマイクロインジェクション法では注入針が刺さらず受精卵にまで届かないが(左)、ピエゾマイクロインジェクション法を用いるとスムーズに注入針を刺すことができた。
最後に、遺伝子改変オポッサム作製の実証研究として、ゲノム編集の標的遺伝子に色素合成酵素のチロシナーゼ(Try)遺伝子[10]を選択し、遺伝子破壊(遺伝子ノックアウト、KO)を試みました。Try遺伝子は4番染色体上に存在し、相同染色体の両方の遺伝子が破壊されると、細胞は色素をつくれなくなります。ピエゾマイクロインジェクション法により、オポッサム前核期受精卵の前核あるいは細胞質へCas9タンパク質とガイドRNAを注入し、偽妊娠オポッサムの子宮に移植しました。
すると、移植した13匹のメスのうち8匹から合計33匹の産仔が得られました。そのうち、5匹の毛色は、全ての細胞で二つある染色体上の両方のTry遺伝子がKOされたことを示すアルビノ(白色)であり、2匹の毛色は一部の細胞が色素をつくらないモザイク(混合色)でした(図5)。モザイク個体は、ゲノム編集の効果が受精卵の卵割後に一部の細胞に生じたため、KO細胞と正常細胞が混じり合った結果生まれたと考えられます。また、8匹については見かけの毛色は正常ですが、遺伝子解析により片方のTry遺伝子に何らかの変異を持つことが確認できました(図5)。さらには、作製した遺伝子改変オポッサムのKOされたTry遺伝子は、次世代に受け継がれることも確認できました。

図5 ゲノム編集オポッサムの実証
中央は色素合成遺伝子(Try遺伝子)が完全に破壊(KO)されたアルビノ(白色)オポッサム。上は一部の細胞が色素をつくらないモザイク(混合色)個体。下は毛色の変化はないが、二つある4番染色体の片方のTry遺伝子に変異を持つオポッサム。
今後の期待
本研究では、一連の基盤技術の開発により、世界で初めてとなる遺伝子改変有袋類(オポッサム)の作製に成功しました。これにより、有袋類のユニークな特徴をコントロールしている遺伝子の探索や、それらが実際の個体内でどのように機能し、表現型に影響を与えているのかを明らかにする遺伝子機能解析への道を拓くことができました。
本成果は、これまでにマウスなどの有胎盤類で得られた知見と、今後有袋類で新たに得られる知見を比較することで、哺乳類の進化や多様性メカニズムの解明にも大きく貢献すると期待できます。
生命機能科学研究センター生体モデル開発チームは、理研外の研究機関に対する遺伝子改変マウス・ラットの作製支援や、オポッサムの分与を行ってきました。将来的には、遺伝子改変オポッサムの作製支援、技術支援などにも取り組む予定です。
補足説明
1.有袋類、有胎盤類、単孔類
現生哺乳類を三つに大別する分類群。多くの哺乳類が含まれる有胎盤類は、胎盤を介して母体から胚に栄養分を供給する。一方、有袋類は発達した胎盤を持たず、未熟な状態で生まれた新生仔は、体外で母乳を飲んで成熟する。カモノハシとハリモグラの仲間のみで構成される単孔類は、卵を産み母乳で子を育てる。
2.CRISPR/Cas9システム、Cas9タンパク質、ガイドRNA
CRISPR/Cas9システムはゲノム編集技術の一つで、標的ゲノム領域を認識する配列とCas9と複合体を形成する配列からなるガイドRNA(gRNA)、およびヌクレアーゼ活性によりDNAを切断するCas9タンパク質からなる。これらを細胞や受精卵に導入すると、複合体を形成して標的ゲノムを切断する。細胞がこれを修復する際の複製エラーにより、ゲノムに欠失や挿入が起きる。また、相同組換えなどにより、切断部位に外来遺伝子をノックインできる。
3.メラノーマ
皮膚がんの一種。色素であるメラニンをつくる細胞が悪性腫瘍になったもの。遺伝的要因と、紫外線などの環境要因が発症に関わると考えられている。
4.X染色体不活化
XX型の性染色体を持つ哺乳類は、メスがオスの2倍のX染色体上の遺伝子を細胞内に持つことになる。この遺伝子量の不均衡は、X染色体の片方を不活性化することで補正され、この現象をX染色体不活化と呼ぶ。
5.生殖・発生工学
発生工学は、生殖細胞や初期胚、ES細胞などの多分化能を持つ細胞に人為的に遺伝子を操作し、新たな生物系統をつくることを主な目的とする分野。生殖工学は人工繁殖技術や生殖補助医療に加え、生殖細胞や胚を生体外で操作する技術であり、発生工学に含まれる。
6.性腺刺激ホルモン
脳下垂体から放出され、卵巣や精巣を刺激するホルモンの総称。卵巣に対して排卵を促進する作用を持つ。
7.偽妊娠
実際は妊娠していないが、妊娠したような状態になったこと。偽妊娠状態のメスの卵管や子宮に、体外培養した胚を移植すると産仔を得ることができる。マウスやラットでは、精管結紮したオスとの交配によって、また、家畜などはメスへのホルモン投与によって偽妊娠させる。
8.マイクロインジェクション法、ピエゾマイクロインジェクション法
顕微鏡下で極細のガラス管(注入針)を用いて、ゲノム編集に必要な溶液を受精卵に注入する方法。尖らせた注入針をそのまま突き刺す方法が一般的であるが、圧電素子(ピエゾ)と組み合わせてピエゾパルスにより、受精卵に穴を開ける方法をピエゾマイクロインジェクション法と呼ぶ。
9.糖タンパク質
糖鎖修飾を受けたタンパク質の総称。細胞外基質の主成分であり、ムコイド層、シェルコートはともに糖タンパク質で構成されている。
10.チロシナーゼ(Try)遺伝子
チロシナーゼは、アミノ酸のチロシンからメラニン色素を生成する際の律速反応を触媒する酵素。チロシナーゼ遺伝子が欠損すると皮膚や毛の色が変化する明確な表現型を示すため、さまざまな生物でゲノム編集による遺伝子破壊の効果を確認する際の標的遺伝子としてよく用いられている。
研究チーム
理化学研究所 生命機能科学研究センター 生体モデル開発チーム
チームリーダー 清成 寛(きよなり ひろし)
テクニカルスタッフ 金子 麻里(かねこ まり)
技師 阿部 高也(あべ たかや)
テクニカルスタッフ 白石 亜紀(しらいし あき)
テクニカルスタッフ 吉見 理子(よしみ りこ)
専門技術員 井上 健一(いのうえ けんいち)
客員研究員 古田 泰秀(ふるた やすひで)
研究支援
本研究は、理化学研究所運営費交付金(生命機能科学研究)で実施し、一部は、日本学術振興会(JSPS)科学研究費補助金若手研究「有袋類における胚操作基盤技術開発(研究代表者:清成寛)」、同基盤研究(C)「有袋類における次世代型遺伝学的手法の確立(研究代表者:清成寛)」による支援を受けて行われました。
原論文情報
Hiroshi Kiyonari, Mari Kaneko, Takaya Abe, Aki Shiraishi, Riko Yoshimi, Ken-ichi Inoue, Yasuhide Furuta, “Targeted Gene Disruption in a Marsupial, Monodelphis domestica, by CRISPR/Cas9 Genome Editing”, Current Biology, 10.1016/j.cub.2021.06.056
発表者
理化学研究所
生命機能科学研究センター 生体モデル開発チーム
チームリーダー 清成 寛(きよなり ひろし)
テクニカルスタッフ 金子 麻里(かねこ まり)
報道担当
理化学研究所 広報室 報道担当