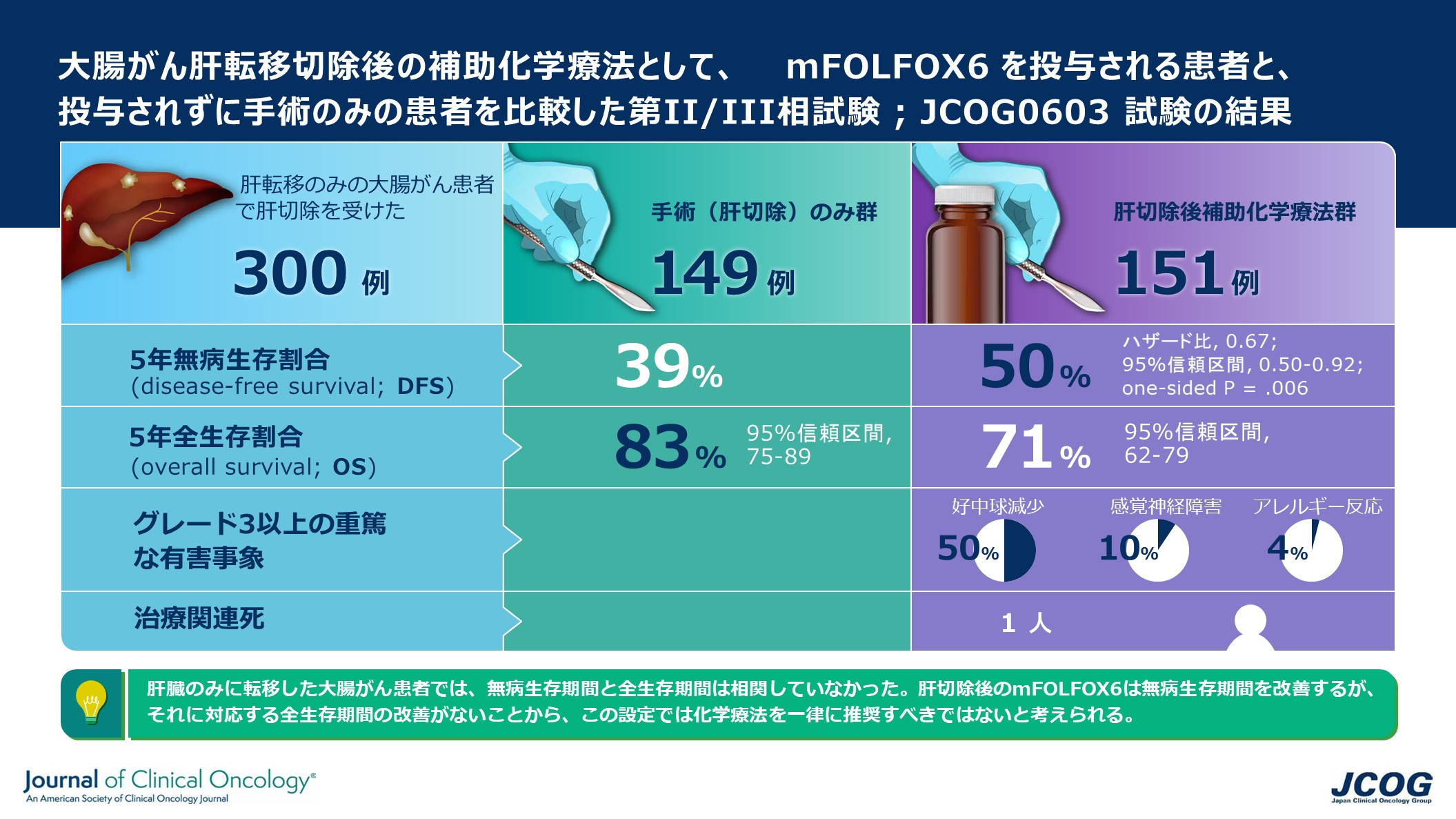
タンパク質を効率良く高精度に構造解析するためのガイドライン
2021-09-27 理化学研究所,高輝度光科学研究センター
理化学研究所(理研)放射光科学研究センター利用システム開発研究部門生物系ビームライン基盤グループ生命系放射光利用システム開発チームの平田邦生専任技師、山本雅貴チームリーダー、高輝度光科学研究センタータンパク質結晶解析推進室の馬場清喜主幹研究員らの共同研究チームは、X線結晶構造解析[1]が難しい微小なタンパク質結晶を対象とした高精度データ収集に最適な測定条件を確立し、広く一般に利用できるガイドラインを示しました。
本研究成果は、X線を利用したタンパク質の立体構造解析を促進し、生命現象の基礎的な理解を深めることに貢献するものと期待できます。
タンパク質の微小結晶を利用したX線結晶構造解析のための回折データの収集では、とりわけ結晶のX線による放射線損傷[2]が測定上の大きな問題となります。
今回、共同研究チームは、結晶に照射するX線の線量(吸収線量[3])をどの程度まで制限すれば高精度な解析ができるか、実験的な検証を試みました。大型放射光施設「SPring-8」[4]で開発した「全自動データ収集システムZOO[5]」を用いて、SWSX法[6]という測定法により、タンパク質微小結晶をさまざまな条件で測定しました。その結果、通常、吸収線量を5メガグレイ(MGy、1MGyは100万グレイ)程度に制限すれば、効率良くかつ高精度なデータ収集が可能であることを示しました。
本研究は、科学雑誌『Journal of Synchrotron Radiation』(9月1日号)の掲載に先立ち、オンライン版(8月26日付)に掲載されました。
背景
タンパク質の働きを詳しく理解するには、その立体構造を細かく知ることが重要です。そのための有効な手段の一つがX線結晶構造解析です。しかし、X線結晶構造解析では試料を結晶化する必要があり、試料が膜タンパク質[7]やタンパク質複合体の場合は結晶化自体が難しいことが多く、たとえ結晶が得られたとしても非常に小さいために回折データの収集が困難になる場合があります。
大型放射光施設「SPring-8」は、強く微小なX線を利用できる世界有数の施設です。ビームラインBL32XU(理研ターゲットタンパクビームライン)や共用ビームラインBL45XU(構造生物学Ⅲビームライン)では、各辺が5~10マイクロメートル(μm、1μmは1,000分の1mm)に集光されたX線ビームを利用できることから、サイズが10μm以下の微小結晶からでも良質なデータを収集可能です。
この微小X線ビームの性能を最大限に活用するため、平田邦生専任技師らは2019年に、タンパク質結晶から自動的にX線結晶構造解析に必要な高品質のデータを収集する「全自動データ収集システムZOO」を開発しました注1)。以来、数多くの膜タンパク質などの構造を迅速かつ高分解能で決定できるようになりました。コロナ禍においても、世界中の利用者は直接施設を訪れなくても、試料を送ることでSPring-8を利用した測定を行えています。
微小結晶を対象としたデータ収集では、とりわけ結晶のX線による放射線損傷が大きな問題となります。このため、ZOOシステムでは吸収線量を指定することで、測定の際の放射線損傷の度合いを制御することが可能です。しかし、その度合いがどの程度であれば「最も効率良く、より高精度な」データを収集できるか、という課題は残されたままでした。そこで、共同研究チームはこの課題を解決すべく、共用ビームラインBL45XUとZOOシステムを利用して微小タンパク質結晶をさまざまな条件で測定し解析しました。
注1)2019年2月7日プレスリリース「タンパク質結晶から自動でデータ収集する「ZOOシステム」を開発」
研究手法と成果
ZOOシステムで利用可能な測定法は数種類あり、結晶のサイズや品質によって使い分けています。吸収線量の限界量を系統的に調査するために、共同研究チームは結晶が微小な場合に利用するSWSX法という測定法を選びました。通常、タンパク質結晶からデータを収集する場合は、結晶を回転させながらX線を照射し、回折像をX線検出器で取得します。このとき、一つの結晶を180~360°回転させることが一般的です。一方、SWSX法では複数の微小結晶を対象とし、一つの結晶あたり5~10°回転させてデータを取得します。
SWSX法には、放射線損傷が著しい微小結晶において、一つの結晶から得られるデータ量は少ないものの、高強度のX線を入射でき、高分解能データを収集できるという長所があります。さらに、微小結晶が大量に得られる場合には、データ収集に利用できる結晶体積を結晶の数で補うことができます。これは、これまでZOOシステムがさまざまな膜タンパク質の構造を高分解能で決定できた要因ともいえます。
まず、タンパク質リゾチームの20μmサイズの微小結晶を大量に準備し、ZOOシステムを用いて、SWSX法の測定条件を変えながら自動測定しました。測定条件として、X線のエネルギー(波長)は1.0オングストローム(Å、1Åは100億分の1メートル)、1.4Å、1.7Åの3種類、限界吸収線量は1メガグレイ(MGy、1MGyは100万グレイ)、2MGy、5MGy、10MGy、20MGy、40MGyの6種類を設定し、それぞれの測定条件で400以上のデータを収集しました。
次に、収集したデータに対してS-SAD法[8]を用いて、タンパク質中の硫黄原子の位置から正しい電子密度図を計算できるかどうかを調べました。S-SAD法では、測定した各X線波長において、どれくらいの吸収線量であれば高精度なデータを取得可能か評価できます。さらに、400データセットのうち、利用するデータ数を変化させるとデータの精度にどのような影響が出るのかも同時に調べました。
その結果、全体的にマージに利用したデータ数が多いほど、位相決定[9]が容易になることが示されました(図1)。また、吸収線量が5MGyのときが最もデータの精度が良く、それ以外では精度が悪くなり、結果としてデータセット数が多く必要になること、40MGyでは位相決定できないことが分かりました(図1)。
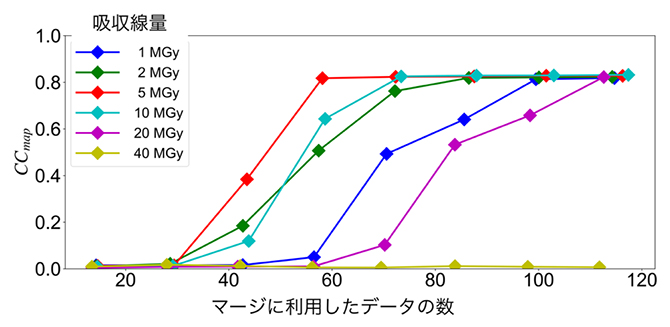
図1 マージに利用したデータ数とCCmap(構造の正しさを反映)の関係
波長1.4ÅのX線を照射した場合の吸収線量ごとの結果を示す。マージに利用したデータ数が多いほど、位相決定が簡単になる傾向が見られた。また、吸収線量が10MGy(水色)より大きい場合や5MGy(赤)よりも小さいときには、CCmapが悪くなり、結果としてデータセット数が多く必要となった。さらに40MGy(黄)では位相決定はできなかった。
図2は、X線波長1.4Åにおいて各吸収線量の測定データを利用した場合、硫黄原子の位置がどの程度正確に決定できるかをプロットしたものです。S-SAD法では、最初の段階でタンパク質中に含まれる硫黄原子の位置を特定するという工程があり、この成功の是非が位相決定に重要です。このグラフからも、吸収線量5MGyの測定で硫黄原子の位置が最も正確に決定できることが示され、結果として5MGyがS-SAD法の成功率にも関係していることが分かりました。他のX線波長でも同様のことが示され、SWSX法における最適な吸収線量は5MGy程度であることが明らかになりました。
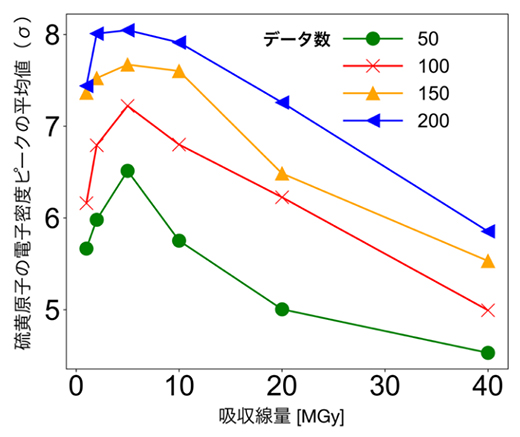
図2 吸収線量と硫黄原子の電子密度ピークの関係
波長1.4ÅのX線を照射した場合の吸収線量ごとの結果を示す。データ数50~200のどれにおいても、吸収線量が5MGyのときに硫黄原子の電子密度のピークが最も高いことが分かる。
今後の期待
本研究では、自動データ収集システムZOOに実装されているSWSX法を利用した測定において、最も高精度なデータ収集を効率的に行うための指標を得ることができました。この指標により、構造未知のタンパク質の位相決定が容易になることから、タンパク質立体構造の高分解能での解明を促すと期待できます。また、タンパク質分子に含まれる小分子の有無、結晶内で起きるタンパク質分子そのものの微小な構造変化などをより正確に捉えることも可能になります。今後、タンパク質の正確な構造に基づいた生命現象の化学的な理解が深まり、分野横断的な応用につながるものと期待できます。
補足説明
1.X線結晶構造解析
対象とする分子などの結晶を作製し、その結晶にX線を照射して得られる回折データを解析することにより、分子内部の原子の立体的な配置を調べる方法。この方法によって、タンパク質などの複雑な分子の立体構造を詳細に知ることができる。
2.放射線損傷
X線の持つエネルギーによって、X線と相互作用した分子が壊れること。X線との相互作用で分子が壊れる場合だけでなく、分子が壊れる過程で生じる電子や、壊れた分子から生成する反応性の高い分子が観察対象の分子と化学反応する場合もある。一般的にタンパク質結晶の放射線損傷は、X線と水の相互作用をきっかけに、X線照射後ピコ秒(1ピコ秒は1兆分の1秒)の時間スケールで、水から生成する反応性の高い分子がタンパク質と化学反応することで起きる。結晶が吸収するエネルギー量は単位重量当たりの吸収量;吸収線量(単位:Gy(グレイ))として表現し、タンパク質結晶の放射線損傷量の定規として用いることが世界的な一般常識である。
3.吸収線量
ここでは、単位重量あたりの結晶がX線照射によって吸収するエネルギー量(単位:Gy(グレイ))を指す。タンパク質結晶の放射線損傷量を定量化するための物理量。
4.大型放射光施設「SPring-8」
理研が所有する、兵庫県の播磨科学公園都市にある世界最高性能の放射光を生み出す施設。SPring-8の名前はSuper Photon ring-8 GeVに由来。放射光(シンクロトロン放射)とは、電子を光とほぼ等しい速度まで加速し、電磁石によって進行方向を曲げたときに発生する細くて強力な電磁波のこと。SPring-8では、遠赤外から可視光線、軟X線を経て硬X線に至る幅広い波長域で放射光を得ることができるため、原子核の研究からナノテクノロジー、バイオテクノロジー、産業利用や科学捜査まで幅広い研究が行われている。
5.全自動データ収集システムZOO
SPring-8で開発した自動データ収集システム。実験結果を判断材料としてビームラインの装置群を制御し、実験者が事前準備した測定条件表に従ってタンパク質結晶や低分子結晶から全自動で無人自動測定を遂行できる。
6.SWSX法
とりわけ多数の小さなタンパク質結晶が得られた場合に利用する回折データ収集法の一つ。一つの結晶から完全なデータを得るのではなく、複数の結晶から部分的にデータを収集してそれらをマージ(結合)して、構造解析に利用するデータを得る方法のこと。それぞれの結晶がランダムにさまざまな方向で撮像されることを前提にしている。通常は一つの結晶から5~15ºのデータを得て利用する。SWSXはSmall Wedge Synchrotron crys(X)tallographyの略。
7.膜タンパク質
細胞膜を構成しているタンパク質で、全ゲノムがコードするタンパク質の3分の1を占める。細胞膜の表面にあるタンパク質と内部に埋もれたタンパク質がある。細胞外のシグナルを捕える受容体、細胞膜を介して物質の出入を担うチャネルやポンプ、細胞同士の結合に関わる接着分子など、生命活動に重要な役割を果たす。疾病に関連しているものも多く創薬の重要なターゲットとされるが、結晶化が難しく、構造解析が最も進んでいない。
8.S-SAD法
タンパク質に含まれる硫黄原子を利用して初期構造決定を行う方法。従来はタンパク質結晶を金属イオン溶液などに浸漬し、その重原子の位置を基にタンパク質の初期構造決定をする方法がとられていた。タンパク質にもともと含まれている硫黄原子を重原子として利用し位相決定が実現できるという手法。S-SADはSulfur single anomalous dispersionの略。
9.位相決定
タンパク質結晶構造解析において、正しい電子密度図を計算するための位相情報を得ることを指す。これにより初期構造解析が実現できる。回折強度データは通常、電子密度図を計算するために必要な構造因子(振幅と位相からなる)のうち位相情報が失われている。この位相情報を特別な実験データ(S-SAD法など)から計算によって決定すること。
共同研究チーム
理化学研究所 放射光科学研究センター 利用システム開発研究部門
生物系ビームライン基盤グループ 生命系放射光利用システム開発チーム
専任技師 平田 邦生(ひらた くにお)
専任技師 河野 能顕(かわの よしあき)
チームリーダー 山本 雅貴(やまもと まさき)
生物系ビームライン基盤グループ
特別研究員 松浦 滉明(まつうら ひろあき)
研究員 坂井 直樹(さかい なおき)
高輝度光科学研究センター タンパク質結晶解析推進室
主幹研究員 馬場 清喜(ばば せいき)
研究員 水野 伸宏(みずの のぶひろ)
研究員 河村 高志(かわむら たかし)
主幹技術員 仲村 勇樹(なかむら ゆうき)
室長 熊坂 崇(くまさか たかし)
(理化学研究所 放射光科学研究センター 利用システム開発研究部門 生物系ビームライン基盤グループ 生命系放射光利用システム開発チーム 客員研究員)
研究支援
本研究は、AMED/BINDS「創薬等ライフサイエンス研究のための相関構造解析プラットフォームによる支援と高度化(SPring-8/SACLAにおけるタンパク質立体構造解析の支援および高度化(領域代表:山本雅貴)」による助成を受けて行われました。
原論文情報
Guidelines for de novo phasing using multiple small-wedge data collection, “Seiki Baba, Hiroaki Matsuura, Takashi Kawamura, Naoki Sakai, Yuki Nakamura, Yoshiaki Kawano, Nobuhiro Mizuno, Takashi Kumasaka, Masaki Yamamoto and Kunio Hirata”, Journal of Synchrotron Radiation, 10.1107/S1600577521008067
発表者
理化学研究所
放射光科学研究センター 利用システム開発研究部門 生物系ビームライン基盤グループ 生命系放射光利用システム開発チーム
専任技師 平田 邦生(ひらた くにお)
チームリーダー 山本 雅貴(やまもと まさき)
報道担当
理化学研究所 広報室 報道担当
高輝度光科学研究センター 利用推進部 普及情報課