2021-11-10 理化学研究所
理化学研究所(理研)開拓研究本部佐甲細胞情報研究室の阿部充宏専任研究員、佐甲靖志主任研究員、小林脂質生物学研究室の小林俊秀主任研究員(研究当時)らの研究チームは、神経疾患に関わる「PMP2タンパク質[1]」が細胞膜を構成する脂質の一種である「スフィンゴミエリン[2]」を細胞膜の脂質二重層[3]の外層から内層に移動させることを明らかにしました。
本研究成果は、指定難病の末梢神経疾患であるシャルコー・マリー・トゥース病[4]の病態の解明や、スフィンゴミエリンが関与するさまざまな病態の理解に貢献するものと期待できます。
細胞膜で脂質は、外層と内層からなる二重層の構造をとっており、スフィンゴミエリンは主に細胞膜外層に局在しています。細胞膜の外層と内層はそれぞれ隔離された環境なのか、あるいは内層と外層で綿密なコミュニケーションをとっているのかは分かっていません。
今回、研究チームは、細胞質内にあるPMP2タンパク質には、細胞膜脂質二重層の外層にあるスフィンゴミエリンを内層に移動させる活性があることを見いだしました。そして、細胞膜をチューブ状に一部変形させ、このとき増加する内層側の表面積を補うために、外層側からスフィンゴミエリンが移動するという分子メカニズムを明らかにしました。
本研究は、科学雑誌『Cell Reports』オンライン版(11月9日付:日本時間11月10日)に掲載されます。
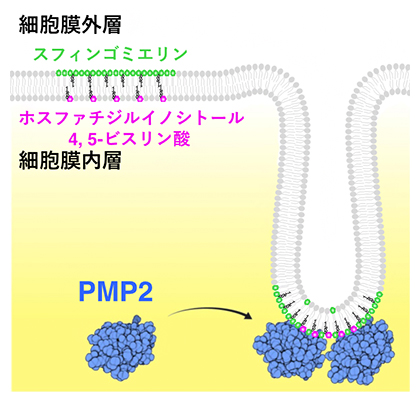
PMP2タンパク質はスフィンゴミエリンを細胞膜外層から内層へと移動させる
背景
細胞膜は細胞を取り囲む最も外側の膜で、タンパク質と脂質から構成されています。細胞膜の主要な脂質は、グリセロ脂質[5]、スフィンゴ脂質[5]、コレステロール[5]です。このうち、”スフィンクス(謎)”に由来するスフィンゴ脂質の機能は、その名の通り長い間謎に包まれていました。しかし、最近の研究により、スフィンゴ脂質の代謝産物の生理機能やスフィンゴ脂質とコレステロールが形成する「脂質ラフト[2]」の構造から病態における役割まで、重要な知見が蓄積されてきました。
細胞膜で脂質は、外層と内層からなる二重層の構造をとっていますが、外層と内層では構成成分が大きく異なる非対称な分布をしています。スフィンゴミエリンは、主に細胞膜外層に局在していますが、少量ながら内層にも存在します。細胞膜の外層と内層はそれぞれ隔離された環境なのか、あるいは内層と外層で綿密なコミュニケーションをとっているのかは分かっていません。
研究手法と成果
培養細胞の細胞質中にスフィンゴミエリン分解酵素[6]を発現させた場合、細胞質に接している細胞膜内層のスフィンゴミエリンだけが分解されると予想されます。ところが、研究チームが調べたところ、細胞膜内層だけでなく外層のスフィンゴミエリンも減少することが分かりました(図1左)。この理由として、細胞膜外層のスフィンゴミエリンが未知の因子によって内層へ持続的に移動させられ、内層で細胞質中のスフィンゴミエリン分解酵素によって分解されるため、次第に外層のスフィンゴミエリンも減少することが考えられました。
そこでこの因子を同定するために、ノックダウン[7]RNAのライブラリーを用いて、スフィンゴミエリン分解酵素を細胞質中で発現させても、細胞膜外層のスフィンゴミエリンが減少しない表現型を示す変異型を探索しました。スクリーニングの結果、約10個の変異型が得られ、それらの原因遺伝子を特定しました。このうち、最も強い表現型を示したPMP2タンパク質(Peripheral myelin protein 2)について解析を進めました(図1右)。
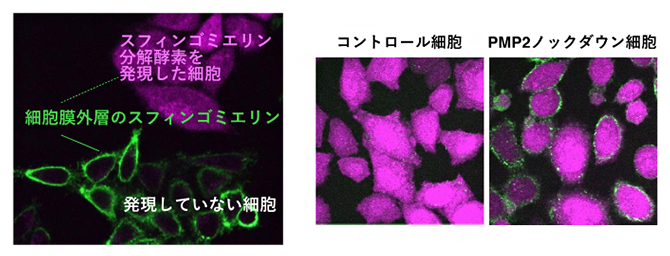
図1 細胞膜外層のスフィンゴミエリン
左:細胞内にスフィンゴミエリン分解酵素(マゼンタ)を発現させると、細胞膜外層のスフィンゴミエリン(緑)が減少した。
右:PMP2の遺伝子をノックダウンすると、スフィンゴミエリン分解酵素を発現させても細胞膜外層にスフィンゴミエリンが観察された。
PMP2は末梢神経系の神経細胞のミエリン鞘[8]に多く含まれるタンパク質ですが、FABP8(Fatty acid-binding protein 8)とも呼ばれ、脂肪酸結合タンパク質のファミリーに属しています。このPMP2がスフィンゴミエリンを細胞膜外層から内層へ移動させるのかを確かめるための実験を行いました。まず、細胞内でPMP2遺伝子を欠損させたPMP2ノックアウト細胞では、蛍光ラベルされたスフィンゴミエリンは細胞膜外層から内層へ移動しにくくなっていることが分かりました。さらに、全反射顕微鏡[9]や超解像顕微鏡[10]による観察から、PMP2を過剰に発現させた細胞では、スフィンゴミエリンは細胞膜外層で減少し、内層で増加していることが分かりました(図2)。

図2 細胞膜外層のスフィンゴミエリンと内層のスフィンゴミエリン
PMP2を過剰に発現した細胞では、コントロール細胞に比べて、スフィンゴミエリンは細胞膜外層で減少し(左)、内層で増加している(右)。
また、リポソーム(脂質二重層を形成した微小な人工膜のカプセル)と変異型PMP2を試験管内で反応させたところ、PMP2はスフィンゴミエリンをリポソームの片方の層からもう一方の層へ移動させていることが分かりました。これらの結果から、PMP2はスフィンゴミエリンを細胞膜外層から内層へ移動させる活性を持つことが分かりました。
次に、どのようにしてPMP2がスフィンゴミエリンを移動させているか調べました。PMP2は細胞質中に存在することから、細胞質中のPMP2が接している細胞膜内層の脂質と直接結合して、スフィンゴミエリンの移動を制御している可能性が考えられます。細胞膜内層に存在するいくつかの脂質とPMP2の結合能を調べたところ、PMP2がホスファチジルイノシトール4,5-ビスリン酸[11]という脂質と特異的に結合することが分かりました。
PMP2存在下で、ホスファチジルイノシトール4,5-ビスリン酸を含んだリポソームの形状を調べた結果、PMP2は球状のリポソームの一部からチューブ状の膜構造を形成させることが分かりました。また、阿部充宏専任研究員らは過去の研究で、細胞では細胞膜外層に存在するスフィンゴミエリンのちょうど裏側の内層にホスファチジルイノシトール4,5-ビスリン酸が存在することを示しています注1)。このことを考え合わせると、PMP2は細胞膜内層のホスファチジルイノシトール4,5-ビスリン酸に結合し、細胞膜をチューブ状に変形させますが、このとき増加する内層側の表面積を補うために外層側からスフィンゴミエリンが移動すると考えられます(図3)。
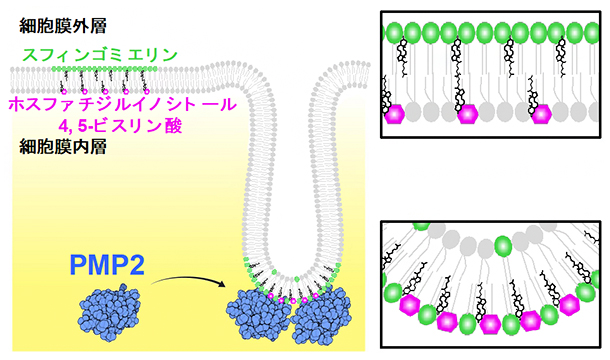
図3 PMP2により細胞膜外層から内層へと移動するスフィンゴミエリン
細胞では、細胞膜外層にあるスフィンゴミエリン(緑)のちょうど裏側の内層にホスファチジルイノシトール4,5-ビスリン酸(マゼンタ)がある(右上)。PMP2(青)は細胞膜内層のホスファチジルイノシトール4,5-ビスリン酸に結合し、細胞膜をチューブ状に一部変形させ、その際に内層側の表面積を補うため外層側からスフィンゴミエリンが移動する(右下)。
注1)Abe et al., (2012) Mol. Cell. Biol. 32, 1396-1407.
PMP2タンパク質の遺伝子は、末梢神経疾患であるシャルコー・マリー・トゥース病の原因遺伝子の一つです。しかし、疾患を引き起こす詳細な分子メカニズムについてはよく分かっていません。最後に、シャルコー・マリー・トゥース病を引き起こす変異型PMP2を作製し、さらに検証を進めた結果、通常のPMP2に比べて、ホスファチジルイノシトール4, 5-ビスリン酸への結合能(図4)、リポソームの変形活性、スフィンゴミエリンの移動活性が増加していることが分かりました。

図4 ホスファチジルイノシトール4, 5-ビスリン酸への結合能
シャルコー・マリー・トゥース病を引き起こす変異型PMP2(I43N)は、通常のPMP2に比べて、ホスファチジルイノシトール4, 5-ビスリン酸への結合能が増加している。
今後の期待
本研究成果は、シャルコー・マリー・トゥース病の分子メカニズムを理解する上で重要な手掛かりになると期待できます。
また、スフィンゴミエリンはさまざまなウイルスの細胞への感染に関わっています。ウイルスは変異しやすく、構成タンパク質の種類が多いことから、ウイルスそのものを標的とする創薬はなかなか困難です。本研究で明らかにした知見を基に研究を進めることで、今後、細胞側の因子を標的としたウイルス感染予防薬の開発に貢献すると期待できます。
補足説明
1.PMP2タンパク質
末梢神経系のミエリンで多く発現しているタンパク質であるが、一般的な細胞にも発現している。FABP8とも呼ばれ、脂肪酸結合タンパク質のファミリーに属している。シャルコー・マリー・トゥース病の原因遺伝子の一つでもある。PMP2はPeripheral myelin protein 2の略。
2.スフィンゴミエリン、脂質ラフト
スフィンゴミエリンは、哺乳動物細胞における細胞膜の主要な脂質の一つであり、コレステロールとともに脂質ドメインである脂質ラフトを形成する。脂質ラフトは、情報伝達や膜輸送、ウイルス感染において重要な役割を果たしていることが示唆されている。
3.脂質二重層
細胞膜や細胞小器官では、脂質分子は親水性の頭部を外側に、疎水性の尾部を内側に向けた二重層の構造をとる。
4.シャルコー・マリー・トゥース病
Charcot、Marie、Toothの3人によって報告された最も発症頻度の高い末梢神経疾患の総称。末梢神経障害による四肢遠位部優位の筋力低下や感覚低下が中核症状である。
5.グリセロ脂質、スフィンゴ脂質、コレステロール
それぞれグリセロール、スフィンゴイド、ステロイドを含む脂質。
6.スフィンゴミエリン分解酵素
今回の解析では、細菌由来のスフィンゴミエリナーゼCを用いた。スフィンゴミエリンを加水分解し、セラミドとホスフォコリンを産生する。
7.ノックダウン
特定の配列を持つRNAを細胞内で発現することで、相補的なmRNAの分解を促進させる方法。目的の遺伝子の機能を抑制できる。
8.ミエリン鞘
神経細胞の軸索を何重にも取り囲む絶縁性の膜構造。
9.全反射顕微鏡
励起光をカバーガラス近くのごく限定された領域に発生させるため、カバーガラス近くの蛍光現象だけを観察できる手法。バックグラウンドが少ないため、高感度な蛍光分子検出が可能。
10.超解像顕微鏡
従来の光学顕微鏡が持つ回折限界を超えた分解能を発揮する手法。超解像度の蛍光顕微鏡の開発に関しては、2014年にノーベル化学賞が贈られた。
11.ホスファチジルイノシトール4,5-ビスリン酸
細胞膜内層に存在する微量な脂質の一つ。アクチン調節タンパク質やエンドサイトーシス関連タンパク質の活性を制御する。
研究チーム
理化学研究所 開拓研究本部
佐甲細胞情報研究室
専任研究員 阿部 充宏(あべ みつひろ)
特別研究員(研究当時) 牧野 麻美(まきの あさみ)
研究員(研究当時) 村手 源英(むらて もとひで)
研究員 柳川 正隆(やながわ まさたか)
主任研究員 佐甲 靖志(さこう やすし)
小林脂質生物学研究室(研究当時)
研究員(研究当時) フランソワーズ・ユラン-マツダ(Françoise Hullin-Matsuda)
主任研究員(研究当時) 小林 俊秀(こばやし としひで)
(現 フランス国立科学研究センターリサーチディレクター、佐甲細胞情報研究室 客員主管研究員、理化学研究所 名誉研究員)
研究支援
本研究は、日本学術振興会(JSPS)学術研究助成基金助成金 基盤研究(C)「細胞膜内層のスフィンゴミエリンの解析-フリッパーゼの同定と生理的意義の解明-(研究代表者:阿部充宏)」、RIKEN Pioneering Project「Integrated Lipidology(小林俊秀、佐甲靖志)」、「Glyco-lipidologue Initiative(小林俊秀、佐甲靖志)」、フランス国立研究機構研究助成金(小林俊秀)による支援を受けて行われました。
原論文情報
Mitsuhiro Abe, Asami Makino, Motohide Murate, Françoise Hullin-Matsuda Masataka Yanagawa, Yasushi Sako, and Toshihide Kobayashi, “PMP2/FABP8 induces PI(4,5)P2-dependent transbilayer reorganization of sphingomyelin in the plasma membrane”, Cell Reports, 10.1016/j.celrep.2021.109935
発表者
理化学研究所
開拓研究本部 佐甲細胞情報研究室
専任研究員 阿部 充宏(あべ みつひろ)
主任研究員 佐甲 靖志(さこう やすし)
小林脂質生物学研究室(研究当時)
主任研究員(研究当時) 小林 俊秀(こばやし としひで)
報道担当
理化学研究所 広報室 報道担当