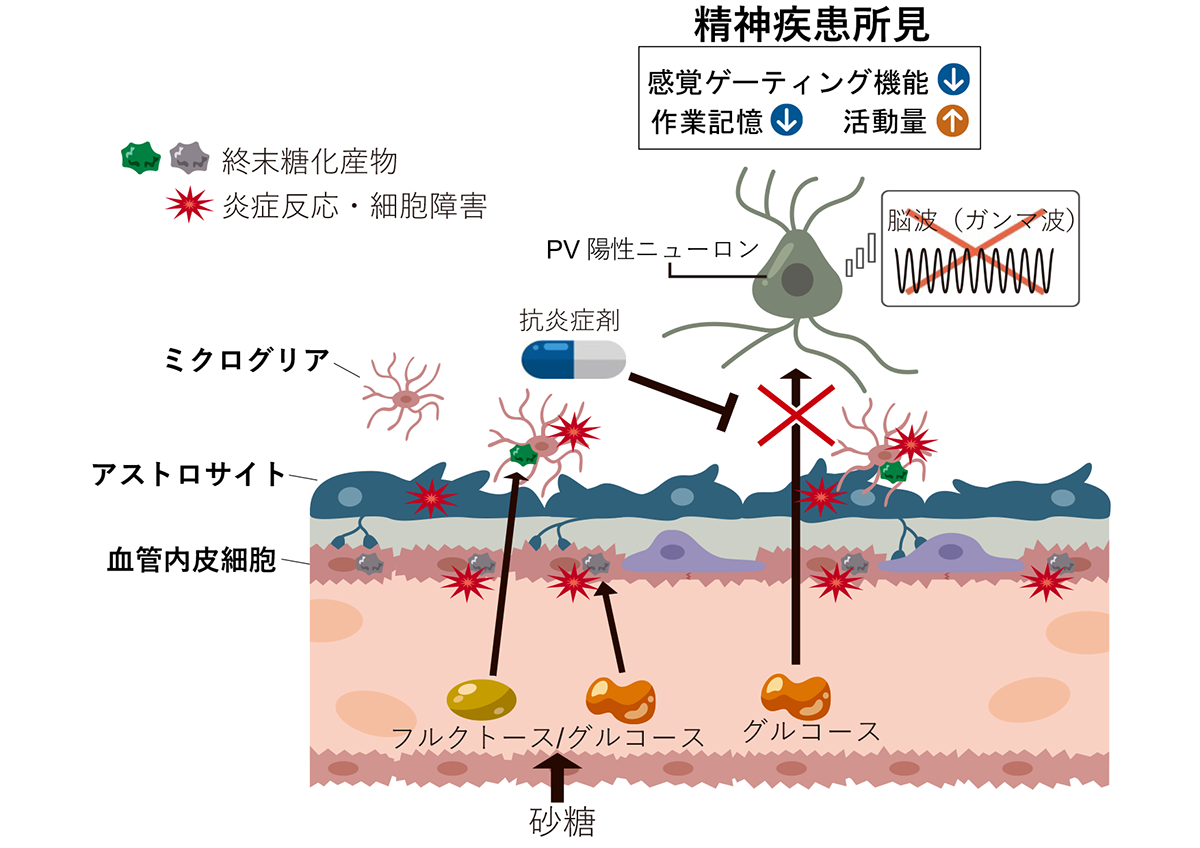
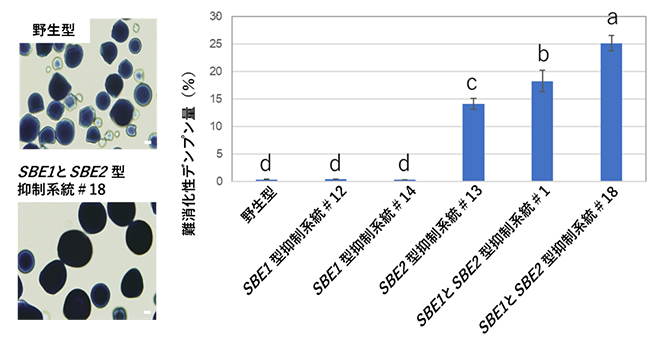
GI-SCREEN-Japan/GOZILA Studyの研究成果に基づいて世界初の有効な治療法誕生に繋がる可能性
2021-11-12 国立がん研究センター,日本医療研究開発機構
発表のポイント
- HER2陽性の治癒切除不能な進行・再発大腸がんに対して、ペルツズマブとトラスツズマブの抗HER2抗体併用療法の有効性・安全性を評価する医師主導治験(TRIUMPH試験)を実施しました。
- 抗HER2抗体併用療法を受けた患者さんのうち、全体の約30%でがんの縮小が得られ、あらかじめ設定した有効性の基準を上回る結果を確認しました。
- 大腸がんの希少なサブタイプであるHER2陽性大腸がんに対して、有効性を示した初めての研究成果を基に、HER2陽性大腸がん患者さんに対する新たな治療法の誕生に繋がることが期待されます。
- リキッドバイオプシーによる経時的な検査により、有効性が高い可能性を示す特徴が複数見いだされ、リキッドバイオプシーを繰り返し行うことで治療の有効性を予測できる可能性が示唆されました。
概要
国立研究開発法人国立がん研究センター(理事長:中釜斉、東京都中央区)東病院(病院長:大津敦、千葉県柏市)は、腫瘍組織遺伝子パネル検査またはリキッドバイオプシー(血液を用いてがんのゲノム異常を検出する検査)でHER2陽性大腸がんと診断された患者さんに対して、抗HER2抗体療法であるペルツズマブとトラスツズマブ*1の併用療法の有効性と安全性を評価する医師主導治験(TRIUMPH試験、EPOC1602)を実施しました。
その結果、全体の約30%でがんの明らかな縮小が得られ、あらかじめ設定した有効性の基準を上回り、併用療法の有効性を明らかにしました。また産学連携全国がんゲノムスクリーニングプロジェクト「SCRUM-Japan」*2レジストリに登録されたHER2陽性大腸がん患者さんで同様の基準を満たしている症例と比較し、従来使用されていた抗がん剤と比べて優れた有効性がある可能性が示唆されました。TRIUMPH試験はHER2陽性大腸がんをリキッドバイオプシーで同定し、前向きに有効性を示した世界初の治験となりました。
HER2陽性大腸がんは大腸がんの2~3%で見られる希少なサブタイプ*3であり、国内外で承認された薬剤がないため、新たな治療法の誕生に繋がることが期待されます。
なお、本研究は国立がん研究センター東病院 消化管内科長の吉野孝之、同院 消化管内科・トランスレーショナルリサーチ支援室医員の中村能章らがGI-SCREEN-Japan(現:MONSTAR-SCREEN)およびGOZILA Studyを通じて行ったもので、本研究成果は米国科学雑誌「Nature Medicine」オンラインに日本時間2021年11月12日付けで掲載されました。また本研究成果を基に、中外製薬株式会社よりHER2陽性大腸がんに対するペルツズマブとトラスツズマブの併用療法が2021年4月に承認申請されました。
背景
HER2陽性大腸がんは、大腸がんの2~3%でしか認められず、国内外で承認された薬剤がないアンメットメディカルニーズ*4の高い希少なサブタイプです。
国立がん研究センター東病院は、HER2陽性大腸がんのように消化器がんの希少なサブタイプを同定することを目的として、2015年にSCRUM-Japanを設立し、消化器がん患者さんの腫瘍組織遺伝子パネル検査を行うGI-SCREEN-Japanを開始しました。また2018年1月より、進行消化器がんの患者さんの血液をリキッドバイオプシーとして解析するスクリーニングプロジェクト「GOZILA Study(ゴジラ・スタディ)」を米国Guardant Health(ガーダントヘルス)社との共同研究として開始しました。さらにHER2陽性大腸がんに対する治療開発を行うため、2018年1月よりTRIUMPH試験を開始しました。
研究方法
TRIUMPH試験は、治療に抵抗性となった治癒切除不能な進行・再発のHER2陽性大腸がん患者さんを対象に、ペルツズマブとトラスツズマブの併用療法の有効性と安全性を評価する多施設共同第II相医師主導治験です。国立がん研究センター東病院を中心に、全国7施設*5で実施されました。
対象の患者さんには、腫瘍組織遺伝子パネル検査またはリキッドバイオプシーでスクリーニングを行いました(図1)。腫瘍組織遺伝子パネル検査には、GI-SCREEN-Japanの基盤を活用し、HER2のIHC法/FISH法*6を実施し、国立がん研究センター東病院が米国、韓国の研究グループと共同で策定した診断基準に基づき、HER2陽性大腸がんの判定を行いました。リキッドバイオプシーを用いたスクリーニングはGOZILA Studyで行われ、米国Guardant Health社のGuardant360®(ガーダントスリーシックスティ)*7が用いられました。腫瘍組織遺伝子パネル検査147例、リキッドバイオプシー1,107例をスクリーニングし、そのうちHER2陽性大腸がんと診断された30例(腫瘍組織遺伝子パネル検査:27例、リキッドバイオプシー:25例)がTRIUMPH試験に登録され、ペルツズマブとトラスツズマブの併用療法を受けました。
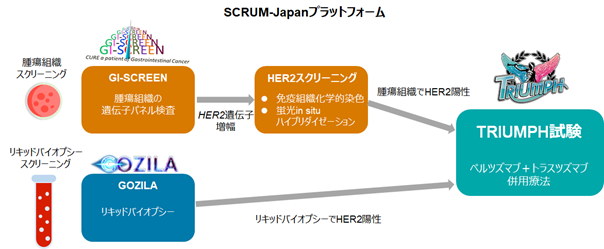
図1:TRIUMPH試験の概要
研究成果
ポイント1
あらかじめ設定した有効性評価基準を上回る結果が明らかになりました。また治療に抵抗性となったHER2陽性大腸がん患者さんにとって、従来使用していた抗がん剤と比べて優れた有効性がある可能性が示唆されました。
ペルツズマブとトラスツズマブ併用療法について、腫瘍組織遺伝子パネル検査でHER2陽性の患者さんで30%(27例中、部分奏効以上が8例)、リキッドバイオプシーでHER2陽性の患者さんで28%(25例中、部分奏効以上が7例)の奏効割合が得られました(図2)。これらの結果は、あらかじめ設定した有効性評価基準(25名中5名以上の部分奏効)を上回るものでした。
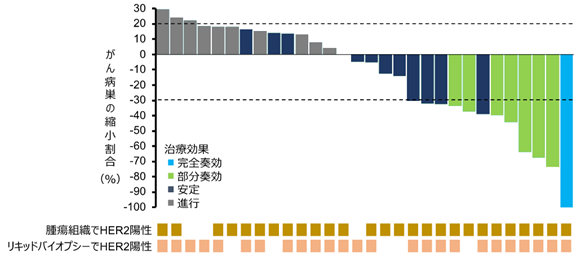
図2:ペルツズマブとトラスツズマブの併用療法によるがん病巣の縮小割合
またSCRUM-Japanレジストリに登録されたHER2陽性大腸がん患者さんのうち、本試験に参加された患者さんと同様の基準を満たした13例では、抗がん剤治療による腫瘍の縮小は全く見られませんでした(図3)。従って、ペルツズマブとトラスツズマブの併用療法は、治療に抵抗性となったHER2陽性大腸がん患者さんにとって、従来使用されていた抗がん剤と比べて優れた有効性がある可能性があります。
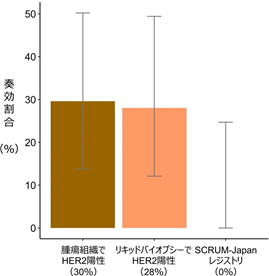
図3:ペルツズマブとトラスツズマブの併用療法(腫瘍組織でHER2陽性、リキッドバイオプシーでHER2陽性の患者さん)および抗がん剤治療(SCRUM-Japan レジストリ)により奏効を認めた患者さんの割合
ポイント2
リキッドバイオプシーによる経時的な検査により、有効性が高い可能性を示す特徴が複数見いだされました。これにより、リキッドバイオプシーを繰り返し行うことで、有効性を予測できる可能性が示唆されました。
本試験では、患者さん個々の遺伝子情報と有効性の関連を調べるため、腫瘍組織遺伝子パネル検査やリキッドバイオプシーによる経時的な検査も行いました。その結果、治療前の腫瘍組織遺伝子パネル検査、リキッドバイオプシーそれぞれで、(1)HER2の遺伝子コピー数が多い、かつ(2)他のがんゲノム異常が併存していない患者さんは、それ以外の患者さんと比べて有効性が高いことが見いだされました(図4)。
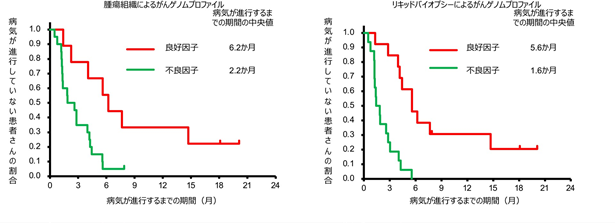
図4:ペルツズマブとトラスツズマブの併用療法により病気が進行していない患者さんの割合
(腫瘍組織、リキッドバイオプシーによるがんゲノムプロファイル毎)
また治療開始3週間後のリキッドバイオプシーにより、血中循環腫瘍DNA(ctDNA)*8が治療開始前より減少している患者さんでは、有効性が高いことが分かりました(図5、図6)。これにより、リキッドバイオプシーを繰り返し行うことで、有効性を予測できる可能性が示唆されました。

図5:TRIUMPH試験で行われた経時的なリキッドバイオプシー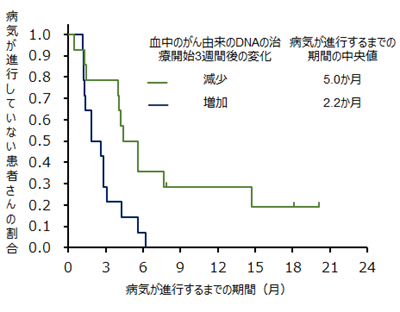
図6:ペルツズマブとトラスツズマブの併用療法により病気が進行していない患者さんの割合
さらに治療が効かなくなった後のリキッドバイオプシーによる結果で、様々ながんゲノム異常が新しく出現していることが判明しました(図7)。そのため今後はこれら新しく出現したがんゲノム異常も考慮することで、HER2陽性大腸がんの治療をより改善できる可能性があります。

図7:ペルツズマブとトラスツズマブの併用療法後に新たに出現したゲノム異常
展望
本研究成果により、世界初となるHER2陽性大腸がん患者さんに対する有効な治療法の誕生に繋がることが期待されます。またリキッドバイオプシーが大腸がん患者さんに対する治療薬の選択や有効性の予測、耐性因子の発見に活用されていく可能性があります。
国立がん研究センター東病院は、製薬企業が積極的に取り組みにくい希少なサブタイプに対して有効な治療を開発するため、SCRUM-Japanの基盤を活用してスクリーニングプラットフォームの構築や医師主導治験の実施に積極的に取り組んできました。今後も一人でも多くの患者さんが最善の治療を受けられるよう、がん個別化治療の実現を目指してまいります。
発表論文
- 雑誌名
- Nature Medicine
- タイトル
- Circulating tumor DNA-guided treatment with pertuzumab plus trastuzumab for metastatic colorectal cancer with HER2(ERBB2)amplification: the TRIUMPH phase 2 Trial(EPOC1602)
- 著者
- Yoshiaki Nakamura, Wataru Okamoto, Takeshi Kato, Taito Esaki, Ken Kato, Yoshito Komatsu,
Satoshi Yuki, Toshiki Masuishi, Tomohiro Nishina, Hiromichi Ebi, Kentaro Sawada, Hiroya Taniguchi, Nozomu Fuse, Shogo Nomura, Makoto Fukui, Seiko Matsuda, Yasutoshi Sakamoto, Hiroshi Uchigata, Kana Kitajima, Naomi Kuramoto, Takashi Asakawa, Steve Olsen, Justin I. Odegaard, Akihiro Sato, Satoshi Fujii, Atsushi Ohtsu, Takayuki Yoshino - DOI
- 10.1038/s41591-021-01553-w
- 掲載日
- 2021年11月12日(日本時間)
研究費
- 国立研究開発法人日本医療研究開発機構(AMED)
-
- 臨床研究・治験推進研究事業
- 「産学連携全国がんゲノムスクリーニング(SCRUM-Japan)患者レジストリを活用したHER2陽性の切除不能・再発大腸がんを対象にした医師主導治験」(研究代表者:吉野孝之)(JP20lk0201054)
- 革新的がん医療実用化研究事業
- 「血液循環腫瘍DNA解析を活用した切除不能・進行再発大腸がんにおけるがんゲノム異常のClonal Evolutionに関する網羅的カタログの作成」(研究代表者:中村能章)(JP20ck0106445)
- 臨床研究・治験推進研究事業
- 「産学連携全国がんゲノムスクリーニング(SCRUM-Japan)を利用したがん新薬開発に資する疾患登録システムの構築」(研究代表者:大津敦)(JP18lk0201056)
用語解説
- *1 ペルツズマブ、トラスツズマブ
- 乳がんや胃がん(胃がんはトラスツズマブのみ)で既に承認されているHER2を標的とした抗体薬。
- *2 SCRUM-Japan(Cancer Genome Screening Project for Individualized Medicine in Japan)
- 2013年に開始した肺がん患者さんを対象としたLC-SCRUM-Japan(現:LC-SCRUM-Asia)と、2014年に開始した消化器がん患者さんを対象としたGI-SCREEN-Japan(現:MONSTAR-SCREEN)が統合した、産学連携がんゲノムスクリーニングプロジェクト。固形がん患者さんを対象に、がんの遺伝子異常を調べるプロジェクトであり、2015年2月の設立以降、約1万例を超える進行固形がん患者さんが研究に参加。本プロジェクトの成果として、既に11品目の医薬品と7種類の体外診断薬の薬事承認を取得している。全国から200を超える医療機関と17社の製薬企業や検査会社が参画し、アカデミアと臨床現場、産業界が一体となって、日本のがん患者さんの遺伝子異常に合った治療薬や診断薬の開発を行っている。
参考: - *3 希少なサブタイプ
- 比較的頻度が高いがんの中で、まれな遺伝子変異が認められる病型。「希少がん」は罹患率によって定義されるため、特定の遺伝子異常等を有するがんを論ずる場合には「希少なサブタイプ」という用語を用いる。
参考:令和3年3月31日薬生薬審発0331第1号「抗悪性腫瘍薬の臨床評価方法に関するガイドライン」 PDF - *4 アンメットメディカルニーズ
- いまだに治療法が見つかっていない疾患に対する医療ニーズのこと。
- *5 TRIUMPH試験 実施施設(全国7施設)
- 北海道大学病院、愛知県がんセンター、四国がんセンター、九州がんセンター、大阪医療センター、
国立がん研究センター中央病院、国立がん研究センター東病院 - *6 IHC法/FISH法
- IHCはimmunohistochemistryの略語であり、免疫組織化学的染色である。抗体を用いて、組織標本中の抗原(タンパク)を検出する方法。FISHは、fluorescence in situ hybridizationの略語であり、蛍光物質や酵素などで標識したオリゴヌクレオチドプローブを用い、目的の遺伝子と交雑させて蛍光顕微鏡で遺伝子異常を検出する方法。
参考:
国立がん研究センタープレスリリース「次世代シーケンサー(NGS)による遺伝子パネル検査を組み合わせた HER2陽性大腸がんに関する国際協調診断基準を世界で初めて確立」 - *7 Guardant360®
- 血液中の循環腫瘍DNAを解析することで、がんゲノム異常を検出するリキッドバイオプシー(液体生検)検査。がんに関連した74遺伝子を調べることが可能。
- *8 血中循環腫瘍DNA(ctDNA)
- 血液中にごく微量に存在するがん由来のDNA(ctDNAはcirculating tumor DNAの略称)。
お問い合わせ先
取材・報道関係からのお問い合わせ
国立研究開発法人国立がん研究センター 企画戦略局 広報企画室(柏キャンパス)
AMED事業に関すること
国立研究開発法人日本医療研究開発機構
創薬事業部 規制科学推進課 臨床研究・治験推進研究事業
疾患基礎研究事業部 疾患基礎研究課 革新的がん医療実用化研究事業