2021-12-09 神戸大学,兵庫県立こども病院,日本医療研究開発機構
兵庫県立こども病院の飯島一誠院長(神戸大学大学院医学研究科内科系講座小児先端医療学分野(連携大学院)客員教授)、国立成育医療研究センター臨床研究センターの佐古まゆみ研究推進部門長、神戸大学大学院医学研究科内科系講座小児科学分野の野津寛大教授を中心とする小児腎臓病研究グループ(Japanese Study Group of Kidney Disease in Children:JSKDC)は、小児期に発症する難治性頻回再発型/ステロイド依存性ネフローゼ症候群注1、注2を対象に、多施設共同二重盲検プラセボ対照ランダム化比較試験注3を先進医療B注4の枠組みの中で実施し、免疫抑制薬のひとつであるミコフェノール酸モフェチル(MMF)がリツキシマブ投与後の寛解維持療法として有効であり、安全性も許容範囲内であることを明らかにしました。
この研究成果は、2021年12月8日(現地時間)に、アメリカ腎臓学会雑誌オンライン版に掲載されました。
ポイント
- 小児期に発症するネフローゼ症候群は小児の慢性腎疾患で最も頻度の高い原因不明の難病で、わが国では年間約1,000人の子どもがこの病気を発症します。
- 患者の大半はステロイド療法によって尿タンパクが消失しますが、その半数はステロイドの減量・中止により頻回に再発するためステロイドを長期継続投与せざるを得ず、副作用を軽減するために様々な免疫抑制薬が用いられステロイドの減量・中止が試みられますが、全体の約20%の患者は、免疫抑制薬を用いてもステロイドを中止できない“難治性頻回再発型/ステロイド依存性ネフローゼ症候群”となります。
- 小児腎臓病研究グループ(JSKDC)は、Bリンパ球表面抗原CD20に対するモノクローナル抗体であるリツキシマブが難治性頻回再発型/ステロイド依存性ネフローゼ症候群に有効であることを明らかにしましたが、末梢血Bリンパ球の回復に伴って頻回に再発することも明らかになり、リツキシマブ投与後の寛解を維持する新たな治療法の開発が望まれていました。
- そこでJSKDCは、多施設共同二重盲検プラセボ対照ランダム化比較試験を実施し、免疫抑制薬のひとつであるミコフェノール酸モフェチル(MMF)がリツキシマブ投与後の寛解維持療法として有効であり、安全性も許容範囲内であることを世界で初めて明らかにしました。
- 今回の研究成果をもとに、公知申請注5の可否を含めて厚生労働省と薬事承認申請に向けた協議を行う予定です。
研究の背景
小児ネフローゼ症候群は小児の慢性腎疾患で最も頻度が高く、わが国では、小児人口10万人あたり年間6.49人(全国で約1,000人)の小児が、この病気を発症します。尿中に大量のタンパク質が漏れ出て血液中のタンパク質が極端に少なくなる原因不明の難病で、小児慢性特定疾病及び指定難病に指定されています。小児ネフローゼ症候群の80-90%はステロイドに反応し寛解となるステロイド感受性ネフローゼ症候群注6ですが、その半数はステロイドの減量・中止により頻回に再発するためステロイドを長期継続投与せざるを得ず、ステロイドの副作用を軽減するために様々な免疫抑制薬が用いられステロイドの減量・中止が試みられます。しかし、全体の約20%の患者は、免疫抑制薬を用いてもステロイドを中止できない“難治性頻回再発型/ステロイド依存性ネフローゼ症候群”となるために、新たな治療法の開発が望まれていました。
わが国では、2003年に小児腎臓病研究グループ(JSKDC)が設立され、これまで小児ネフローゼ症候群を中心として多くの臨床試験を実施してきました。JSKDC参加施設のなかの9施設注7において2008年より医師主導治験注8として実施された、難治性頻回再発型/ステロイド依存性ネフローゼ症候群に対するリツキシマブ(Bリンパ球表面抗原CD20に対するモノクローナル抗体)の多施設共同二重盲検プラセボ対照ランダム化比較試験により、その有効性・安全性が検討され(Iijima K et al. Lancet 2014)、その結果等をもとに2014年8月29日付で適応拡大が承認され保険診療が可能となりました。
しかし同時に、大半の症例でリツキシマブによって枯渇した末梢血Bリンパ球の回復に伴って、頻回再発/ステロイド依存性再発をきたすことも明らかになり、リツキシマブ投与後の寛解維持療法の開発が強く望まれていました。
わが国で実施されたパイロット研究(Ito S et al. Pediatr Nephrol 2011)で、リツキシマブ投与後に免疫抑制薬のひとつであるミコフェノール酸モフェチル(MMF)を投与することで寛解維持期間を延ばすことができることが示唆されたこともあり、JSKDCは、MMFがリツキシマブ投与後の寛解維持療法として有効かつ安全であるか否かを検討する多施設共同二重盲検プラセボ対照ランダム化比較試験を先進医療Bの枠組みの中で実施しました。
なお、本研究では、日本腎臓学会によって運営されている腎臓病総合レジストリ(J-KDR/J-RBR)を活用して被験者登録の促進を図りました。
研究の内容
本研究では、小児期発症難治性頻回再発型/ステロイド依存性ネフローゼ症候群患者に対して、リツキシマブ375mg/m2/回(最大投与量500mg/回)を1週間間隔で計4回静注投与した後に、寛解維持療法としてMMF(39例)もしくはプラセボ(39例)の1,000~1,200mg/m2/日(最大投与量2g/日)(1日2回)を17か月間(505日まで)経口投与し、その後、フォローアップ期間として再発を認めるまで可能な限り無治療で経過観察を行いました(下図、方法参照)。
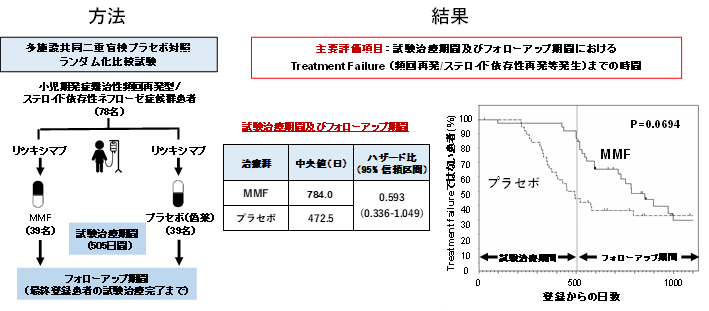
図.多施設共同二重盲検プラセボ対照ランダム化比較試験の方法と結果
主要評価項目である試験治療期間及びフォローアップ期間を通じてのtreatment failure(頻回再発、ステロイド依存性再発あるいはステロイド抵抗性再発)となるまでの期間は、統計学的には有意ではないもののMMF群では長い傾向にあり(中央値:784.0 vs. 472.5日,P=0.0694)、MMF群のプラセボ群に対するハザード比注9は0.593(95%信頼区間注10:0.336-1.049)と、treatment failureの発生を41%抑制しました。本試験では、副次評価項目である試験治療期間中の再発回数は、MMF群ではプラセボ群に比して少なく、試験治療期間中のステロイド投与量も減少させる傾向がみられました。安全性に関しては両群間に大きな違いは認めませんでした。
以上より、MMFはリツキシマブ投与後の寛解維持療法として有効であり、安全性も許容範囲内であると考えられました。
今後の展開
今後、今回の研究成果をもとに、公知申請の可否を含めて厚生労働省と薬事承認申請に向けた協議を行う予定です。
また、本試験では、リツキシマブ投与後17か月間(約500日目まで)のMMF投与がリツキシマブ投与後の寛解維持に有用であることが示唆されましたが、今後、より長期間のMMF投与の有効性・安全性を検討する必要があります。
本試験では、MMF投与終了後に頻回再発やステロイド依存性再発が多くの被験者(投与期間中:6/39例、投与終了後17/39例)でみられました。すなわち、MMF投与期間中のみに有効であることが明らかになりました。今後、ネフローゼ症候群に関する基礎的研究をさらに進展させ、その病因・病態に基づいた原因療法の開発が必要と考えられました。
用語解説
- 注1 ネフローゼ症候群
- ネフローゼ症候群とは、尿にタンパク質がたくさん出てしまうために、血液中のタンパク質が減り(低タンパク血症)、その結果、むくみ(浮腫)が起こる疾患である。明らかな原因がわからないものを、一次ネフローゼ症候群と呼ぶ。国の指定難病及び小児慢性特定疾病の一つ。
- 注2 難治性頻回再発型/ステロイド依存性ネフローゼ症候群
- 免疫抑制薬等の治療によっても頻回再発やステロイド依存性再発を生じ、ステロイドの長期投与をせざるを得ない病態のこと。
- 注3 多施設共同二重盲検プラセボ対照ランダム化比較試験
- 二重盲検比較試験とは、実施する側(医療従事者)と患者が、投与される薬がプラセボか実薬かを判別できない形で実施される比較試験のことで、プラセボ対照ランダム化比較試験は、被験者を無作為に、実薬を投与するグループとプラセボを投与するグループに分け、同じ投与方法とする試験デザインである。両者を組み合わせ、また、必要な患者数を確保するために多施設共同として実施される多施設共同二重盲検プラセボ対照ランダム化比較試験は、評価に主観やプラセボ効果が入ることを防ぎ、被験薬の効果や安全性を相対的に評価することが可能になり、被験薬の有効性・安全性を正確に評価できる最も標準的な手法である。
- 注4 先進医療B
- 未承認の医薬品や医療機器を用いても、一定の条件を満たせば保険診療との併用を可能としたもの。未承認の医薬品等の使用を伴わない先進医療Aと、未承認の医薬品等の使用を伴う先進医療Bに大きく分類されている。
- 注5 公知申請
- 海外では承認されているが日本では未承認のため使用できない医薬品等について、有効性や安全性など科学的根拠が十分と認められた場合には医学薬学上「公知」であるとされ、臨床試験の一部あるいは全部を行わなくとも承認申請が可能となる制度。
- 注6 ステロイド感受性ネフローゼ症候群
- ネフローゼ症候群のうち、ステロイド連日投与開始後4週間以内に完全寛解する(症状が治まる)もの。
- 注7 9施設
- 神戸大学医学部附属病院、兵庫県立こども病院、岡山大学病院、和歌山県立医科大学、国立成育医療研究センター、東京都立小児総合医療センター、駿河台日本大学病院、順天堂大学練馬病院、東京大学医学部附属病院。
- 注8 医師主導治験
- 2003年に現在の医薬品医療機器等法が改正され、それまで企業主導でしか行えなかった治験を医師が自ら企画・立案し実施することができるようになった。
- 注9 ハザード比
- 統計学上の用語で、臨床試験などで使用する相対的な危険度を客観的に比較する方法。例えばA薬と対照のB薬を比較するという臨床試験でハザード比が0.60という結果であれば、A薬はB薬よりリスクを40%減少させたという意味になる。
- 注10 95%信頼区間
- 母集団の統計量(真の値)が95%の確率で収まる値の範囲のこと。一般には、比の検定ではこの範囲が1を含んでいなければ統計学的な有意差があるとされる。
謝辞
この研究は厚生労働科学研究費補助金医療技術実用化総合研究事業及び国立研究開発法人日本医療研究開発機構(AMED)臨床研究・治験推進研究事業の一環として、JSKDCメンバーの先生方の協力を得て行いました。中外製薬株式会社から、試験薬であるMMF及び関連する安全性情報を提供していただきましたが、中外製薬は、試験デザイン、データ解析、データの解釈、総括報告書及び論文の作成等には関与しておりません。
この研究に参加されたすべての患者さん及びそのご家族に感謝いたします。
論文情報
- タイトル
- Mycophenolate mofetil after rituximab for childhood-onset complicated frequently-relapsing or steroid-dependent nephrotic syndrome
- DOI
- 10.1681/ASN.2021050643
- 著者
- Kazumoto Iijima*, #, Mayumi Sako* Mari Oba, Seiji Tanaka, Riku Hamada, Tomoyuki Sakai, Yoko Ohwada, Takeshi Ninchoji, Tomohiko Yamamura, Hiroyuki Machida, Yuko Shima, Ryojiro Tanaka, Hiroshi Kaito, Yoshinori Araki, Tamaki Morohashi, Naonori Kumagai, Yoshimitsu Gotoh, Yohei Ikezumi, Takuo Kubota, Koichi Kamei, Naoya Fujita, Yasufumi Ohtsuka, Takayuki Okamoto, Takeshi Yamada, Eriko Tanaka, Masaki Shimizu, Tomoko Horinochi, Akihide Konishi, Takashi Omori, Koichi Nakanishi, Kenji Ishikura, Shuichi Ito, Hidefumi Nakamura, Kandai Nozu* on behalf of Japanese Study Group of Kidney Disease in Children.(*共同筆頭著者、#責任著者)
- 掲載誌
- Journal of the American Society of Nephrology
お問い合わせ先
研究について
兵庫県立こども病院 院長、神戸大学大学院医学研究科内科系講座小児先端医療学分野
(連携大学院)客員教授 飯島一誠
報道担当
国立大学法人神戸大学総務部広報課
AMED事業に関すること
国立研究開発法人日本医療研究開発機構(AMED)
創薬事業部 規制科学推進課 臨床研究・治験推進研究事業