2022-02-09 理化学研究所
理化学研究所(理研)環境資源科学研究センターケミカルバイオロジー研究チームの吉岡広大特別研究員、室井誠専任研究員、長田裕之グループディレクターと理研-マックスプランク連携研究部門バイオプローブ応用研究ユニットの河村達郎研究員(研究当時)、渡邉信元ユニットリーダーらの国際共同研究グループは、「フェロトーシス[1]」と呼ばれる制御された細胞死を増強する新しい化合物を発見しました。
本研究成果は、フェロトーシスの分子メカニズムの解明や、薬剤耐性がんなどの疾患の治療法の開発に貢献すると期待できます。
フェロトーシスは、がんをはじめとするさまざまな疾患と関連があります。特に、既存の抗がん剤に耐性を持つがんはフェロトーシスに対して感受性が高いことから、フェロトーシスの誘導が新たながん治療戦略として期待されています。
今回、国際共同研究グループは、理研NPDepo化合物ライブラリー[2]を用いて、がん細胞の増殖阻害を指標とした化合物スクリーニングを行い、NPD4928という低分子化合物を発見しました。その作用解析から、NPD4928はフェロトーシス抑制タンパク質であるFSP1[3]の働きを阻害することが明らかになりました。
本研究は、科学雑誌『ACS Chemical Biology』オンライン版(2月7日付)に掲載されました。
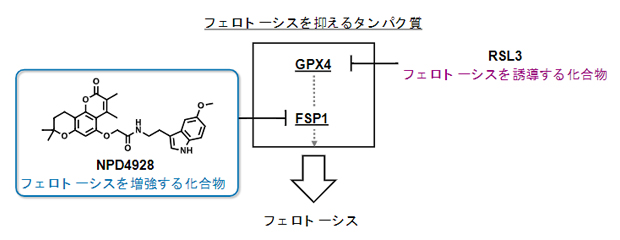
新しいFSP1阻害剤NPD4928とその作用機序
背景
「フェロトーシス」は制御された細胞死の一種であり、がんをはじめとするさまざまな疾患と関連があります。特に、既存の抗がん剤に耐性を持つがんはフェロトーシスに対して感受性が高いことから、フェロトーシスの誘導が新たながん治療戦略として期待されています。
フェロトーシスを誘導するには、細胞内でフェロトーシスを抑制しているタンパク質の機能を阻害する必要があります。それらのタンパク質のうち、主要な役割を担っているのがGPX4[4]と呼ばれる酵素です。GPX4に対する阻害剤の一つであるRSL3[5]はフェロトーシスを誘導する低分子化合物です。しかし、RSL3は一部のがん細胞にはフェロトーシスを誘導する活性が弱いことが知られています。そこで、国際共同研究グループは、RSL3による細胞毒性を増強させる化合物の探索に着手しました。
研究手法と成果
国際共同研究グループはまず、理研NPDepo化合物ライブラリーを用いて、GPX4阻害剤RSL3による細胞毒性を特異的に増強する化合物のスクリーニングを行いました。がん細胞を化合物単独で処理したときとRSL3と併用処理したときの毒性を比較し、併用時だけ細胞毒性が著しく増強される化合物に着目したところ、最も強力な化合物としてNPD4928を見いだしました(図1)。
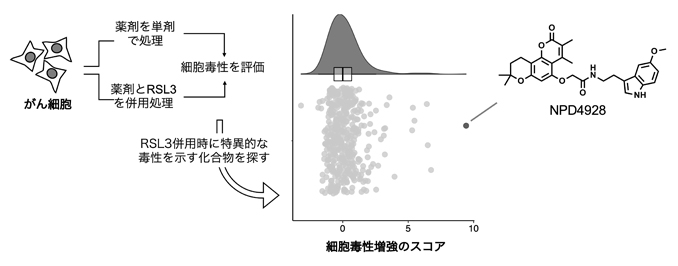
図1 RSL3による細胞毒性を特異的に増強する化合物のスクリーニング
がん細胞に理研NPDepo化合物ライブラリー中の薬剤(化合物)を単剤で処理、またはRSL3との併用処理を行い、毒性を評価した。RSL3併用時に著しい毒性を示す化合物を探したところ、最も効果のある化合物としてNPD4928が得られた。
次に、NPD4928がフェロトーシスを増強する仕組みを調べるため、NPD4928の標的タンパク質を解析しました。その結果、NPD4928はGPX4とともにフェロトーシスを抑えるタンパク質FSP1の活性を阻害することが分かりました。サーマルシフトアッセイ[6](図2A)や化合物ビーズ[7]により、NPD4928がFSP1に結合し、精製したFSP1の酵素活性を阻害することが示されました。また、前立腺がん細胞や肺がん細胞などさまざまながん細胞をNPD4928とRSL3で併用処理すると、フェロトーシスが増強されることが明らかになりました(図2B)。
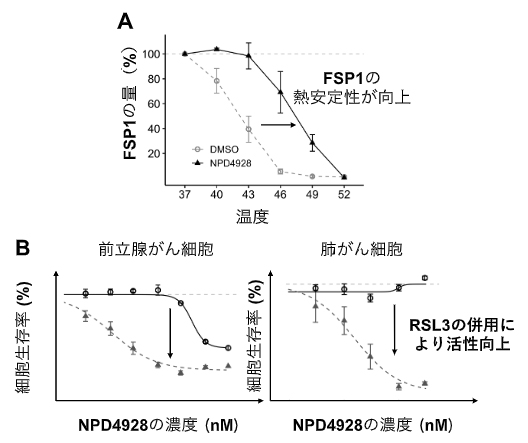
図2 NPD4928によるFSP1の熱安定性の向上とがん細胞への影響
A:NPD4928によって細胞内のFSP1の熱安定性が向上することをサーマルシフトアッセイで確認した。
B:前立腺がん細胞および肺がん細胞について、◯(NPD4928のみで単剤処理)と▲(NPD4928とRSL3で併用処理)を比較したところ、いずれのがん細胞においても併用処理時のみ特異的に細胞毒性が向上し、細胞生存率が低下した。
今後の期待
フェロトーシス誘導は、新たな抗がん剤治療として有望な戦略です。GPX4阻害剤だけでは効果が限られる場合、NPD4928のようなFSP1阻害剤は併用療法[8]において有用となる可能性があります。本研究で見いだしたNPD4928はより薬らしい化合物を合成する基になるリード化合物として、またフェロトーシスの分子メカニズムを理解するツールとしての応用が期待できます。
補足説明
1.フェロトーシス
細胞膜を構成するリン脂質の過酸化によって引き起こされる細胞死。
2.理研NPDepo化合物ライブラリー
理研が保有する天然化合物・合成化合物のライブラリー。放線菌や糸状菌などの微生物、植物の二次代謝化合物を精製単離するとともに、天然化合物の誘導体や類縁体、人工合成化合物などを収集して、約4万化合物をライブラリー化したもの。
3.FSP1
細胞内でユビキノンと呼ばれる電子伝達を担う化合物を還元する酵素。ユビキノンの還元体はリン脂質の過酸化を抑制する。
4.GPX4
細胞内で抗酸化物質グルタチオンを酸化し、過酸化リン脂質を還元する酵素。
5.RSL3
GPX4の阻害剤として働く低分子化合物。GPX4の活性部位に結合することで、その機能を阻害する。
6.サーマルシフトアッセイ
多くのタンパク質は熱を加えると不安定化するが、タンパク質に結合する化合物はその不安定化の度合いを変化させる。これを利用してタンパク質と化合物の相互作用を評価する手法。
7.化合物ビーズ
化合物を付着させたビーズ。細胞抽出液と混ぜて、化合物と結合するタンパク質の探索に用いる。
8.併用療法
一つの疾患をより効果的に治療するために、異なる仕組みで作用する薬を複数用いること。
国際共同研究グループ
理化学研究所 環境資源科学研究センター
ケミカルバイオロジー研究グループ
特別研究員 吉岡 広大(よしおか ひろまさ)
専任研究員 室井 誠(むろい まこと)
専任研究員 近藤 恭光(こんどう やすみつ)
専任研究員 川谷 誠(かわたに まこと)
テクニカルスタッフⅠ 本田 香織(ほんだ かおり)
テクニカルスタッフⅠ(研究当時) 青野 晴美(あおの はるみ)
グループディレクター 長田 裕之(おさだ ひろゆき)
理研-マックスプランク連携研究部門 バイオプローブ応用研究ユニット
研究員(研究当時) 河村 達郎(かわむら たつろう)
ユニットリーダー 渡邉 信元(わたなべ のぶもと)
マックスプランク分子生理学研究所(ドイツ)
Department of Chemical Biology
教授 ヘルベルト・ワルドマン(Herbert Waldmann)
研究支援
本研究は、日本学術振興会(JSPS)科学研究費補助金新学術領域研究(研究領域提案型)「プロテオミクスをベースにした化学シグナル解析技術開発(研究代表者:長田裕之)」「先端モデル動物支援プラットフォーム(研究支援分担者:長田裕之)」「ユビキチン機能制御のためのケミカルバイオロジー(研究分担者:近藤恭光)」、同基盤研究(A)「人工知能を活用した抗真菌剤の開発研究(研究代表者:長田裕之)」、同特別推進研究「フェアリー化合物の科学とその応用展開(研究分担者:室井誠)」、同基盤研究(C)「プロテオーム解析を用いた直接的アプローチ法による薬剤標的同定解析システムの開発(研究代表者:室井誠)」「酸化ストレス誘導化合物”ferroxin”を用いたフェロトーシス制御機構の解明(研究代表者:河村達郎)」、日本医療研究開発機構(AMED)次世代がん医療創生研究事業「ケミカルバイオロジーを基盤としたがん代謝制御薬剤の開発(研究代表者:長田裕之)」による支援を受けて行われました。
原論文情報
Hiromasa Yoshioka, Tatsuro Kawamura, Makoto Muroi, Yasumitsu Kondoh, Kaori Honda, Makoto Kawatani, Harumi Aono, Herbert Waldmann, Nobumoto Watanabe, and Hiroyuki Osada., “Identification of a small molecule that enhances ferroptosis via inhibition of FSP1.”, ACS Chemical Biology, 10.1021/acschembio.2c00028
発表者
理化学研究所
環境資源科学研究センター ケミカルバイオロジー研究グループ
特別研究員 吉岡 広大(よしおか ひろまさ)
専任研究員 室井 誠(むろい まこと)
グループディレクター 長田 裕之(おさだ ひろゆき)
理研-マックスプランク連携研究部門 バイオプローブ応用研究ユニット
研究員(研究当時) 河村 達郎(かわむら たつろう)
ユニットリーダー 渡邉 信元(わたなべ のぶもと)
報道担当
理化学研究所 広報室 報道担当