2022-03-18 東京大学
発表者
水内 良 (東京大学 大学院総合文化研究科 附属先進科学研究機構 特任助教/科学技術振興機構 さきがけ研究者)
古林 太郎(日本学術振興会 特別研究員PD)
市橋 伯一(東京大学 大学院総合文化研究科 広域科学専攻・附属先進科学研究機構 教授/東京大学 生物普遍性連携研究機構 教授)
発表のポイント
- 原始生命を模したRNA分子の自己複製システム(注1)を進化(注2)させたところ、次々に異なる性質をもつ新種が出現し、複雑な複製ネットワーク(注3)が生まれた。
- 少数の分子で構成される単純な自己複製システムが、より複雑なシステムへと段階的に進化していくことを実証した。
- 本研究により、原始的な自己複製システムが情報や機能を拡張して複雑化していく過程の一端が明らかになった。進化実験は現在進行形であり、将来的には私たちが知る複雑な生命の誕生に迫ることが期待される。
発表概要
東京大学大学院総合文化研究科附属先進科学研究機構の水内良特任助教と市橋伯一教授らは、人工的に構築したRNA分子の自己複製システムを試験管内でより複雑なシステムへと段階的に自発進化させることに成功しました。
原始地球で誕生した最初の生命は、自己複製という機能しかもたないRNAのような分子の自己複製システムであったと考えられています。しかし、その形跡は現存する生命にはなく、原始的な分子システムがどのように複雑な生命へと進化したのかは謎に包まれています。本研究では、人工的に構築したRNAの自己複製システムを試験管内で進化させることで、はじめ1種類だったRNAが最大で5種類の異なる性質をもつRNAへと分化し、さらにそれらが互いに複製し合うことで巨大な複製システム(ネットワーク)を形成することを見出しました。このような複製ネットワークの形成は、原始生命が情報や機能を拡張して複雑な生命へと進化するための第一歩であると理論的に予想されていました。今後、試験管内の進化実験を継続することで、単純な分子複製システムから複雑な生命が生まれる一連の過程の解明に繋がると考えられます。
本研究成果は、2022年3月18日(英国時間)に英科学誌「Nature Communications」のオンライン版に掲載されました。
発表内容
研究の背景・先行研究における問題点
生命の起源は一般に、複雑な生命が原始地球に突然現れたのではなく、単純な分子の自己複製システムが進化によって複雑化した結果であると考えられています。この自己複製システムは少数の情報分子(RNAなど)やタンパク質の集合体であったと想像されています。これまでの研究では、こうしたシステムをコンピュータ上でモデル化し、その進化をシミュレートすることで、有り得た進化の道筋が調べられてきました。しかし、この試みが50年にもわたる一方で、誰も分子システムが複雑化していく様子を実際に観察することはできていませんでした。このような直接的な進化の証拠を得るためには、実際に分子の自己複製システムを試験管内で構築し、その進化を自分たちの目で捉える必要があります。
研究内容
そこで本研究では、独自開発したRNAの自己複製システムを用いてこの進化過程を明らかにすることを試みました。本システムには自身を複製するために必要な情報(複製酵素(注4)の遺伝子)だけをもつRNAと、その情報を翻訳する(複製酵素を生産する)ために必要な無細胞翻訳系(注5)が混合されています。つまりたった一つの遺伝子と自己複製という機能しかもたない原始的なシステムです。本システムを油中水滴に封入し、一連の実験サイクル(培養、希釈、栄養供給)を繰り返すと、RNAが複製し続け、自発的に進化していきます(図1)。この進化実験では、RNA複製のミスにより突然変異(注6)が起き、より複製しやすい形質を獲得したRNAが分子集団における割合を増やすことで進化していきます。また、分子複製システムにおいては、複製ミスが遺伝子の欠損を引き起こし、寄生的な性質をもつRNA(寄生体RNA)が生じることもあります(図2)。寄生体RNAは複製酵素を翻訳できませんが、元のRNA(宿主RNA)が生産する複製酵素を利用することで複製し、その進化に影響していたと考えられています。
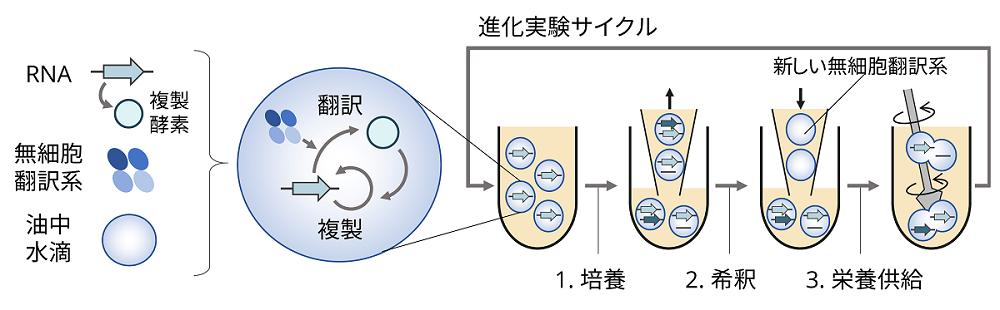
図1.RNAの自己複製システムを用いた進化実験
本システムを培養、希釈、栄養(無細胞翻訳系)供給を繰り返して継代すると、突然変異が生じ、より多く複製してたくさんの子孫を残せるようになったRNAが集団を占める。すなわち進化が起きる。なお、培養は37℃で5時間行い、希釈は5倍希釈で行った。
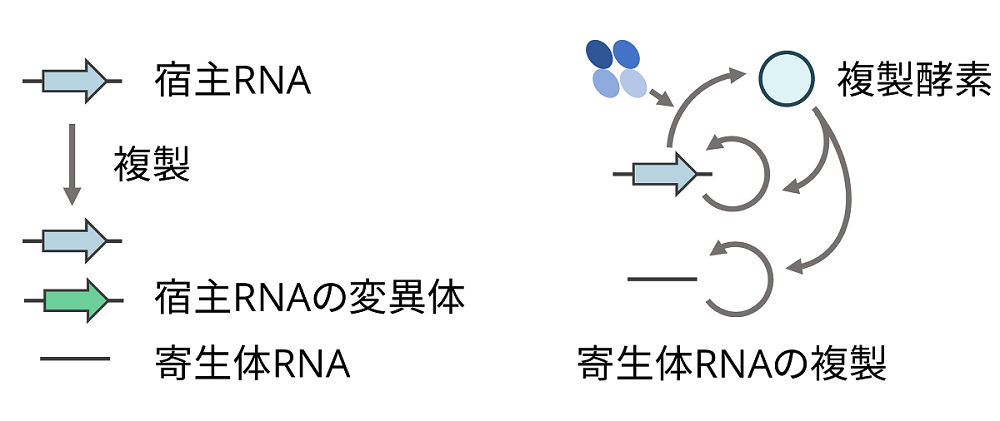
図2.寄生体RNAの出現
RNA複製時に突然変異が生じることで、複製酵素の遺伝子をもつ宿主RNAの変異体や寄生体RNAが出現する。寄生体RNAは複製酵素の遺伝子を欠損しているため、その複製は周囲の宿主RNAが生産する複製酵素に依存する。
今回、本研究グループは「分子の自己複製システムを進化させ続けると自発的に複雑化していくのか?」という疑問に答えるため、上記の進化実験を行いました。240回の実験サイクルを行った結果、RNA集団は約600世代にわたり進化し続け、現在も絶滅する様子はありません。次に、どのようなRNAが進化したかを調べたところ、最初は1種類の宿主RNAであった集団は、異なる突然変異セットを獲得した3種類の宿主RNA系列と3種類の寄生体RNA系列へと分化したことを見出しました(図3)。さらに解析を進めたところ、それぞれのRNA系列は進化実験の前半では互いに排他的であり、集団中の頻度が大きく変動していたのに対し、後半では5種類のRNA系列が安定的に共存する状態へと遷移したことを見出しました(図4)。この結果は、RNAの新種が次々に現れただけでなく、それらがもはや独立には複製しておらず、1つの大きなシステムとして複製するように進化した可能性を示唆しています。
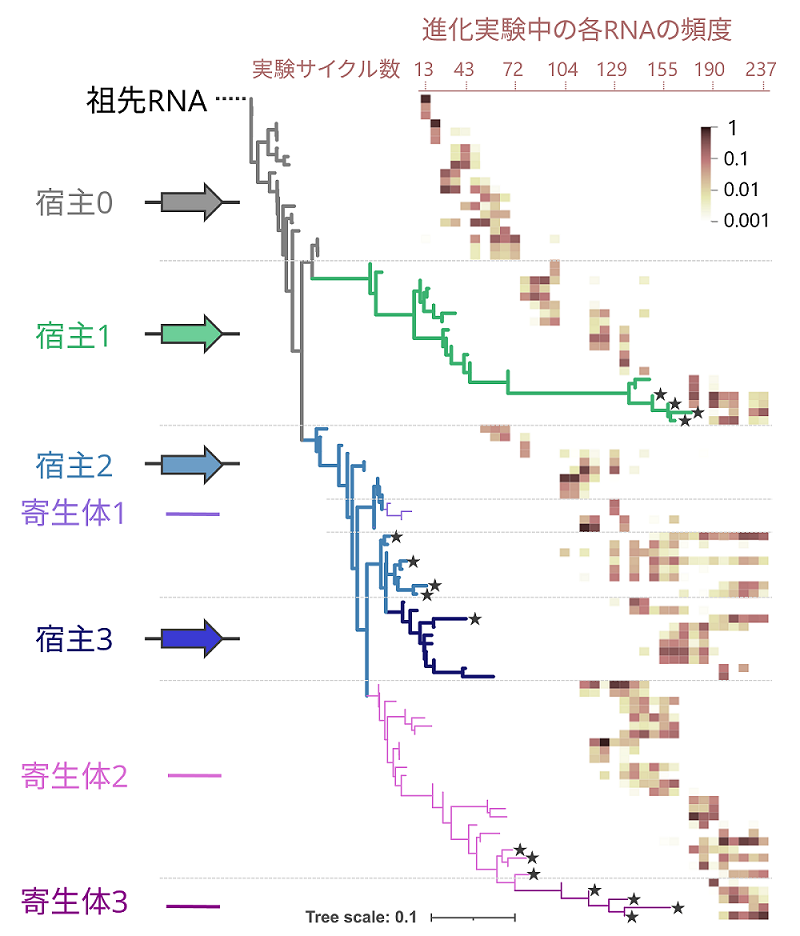
図3.RNAの進化の道筋
1種類の祖先RNA(宿主RNA)が辿った進化の軌跡を示す系統樹。進化実験サイクル約30回毎にRNA集団の組成を解析し、特に頻度が高かったRNAについて示した。各枝先が異なるRNA配列に対応しており、枝が右方向に伸びるほど配列が大きく異なっている。共通の突然変異セットをもつRNAを示す枝は同色で色付けされており、それぞれ4種類の宿主RNA系列(祖先型を含む)と3種類の寄生体RNA系列に対応する。星印は進化実験の最後に生存していたRNAを示す。ヒートマップは進化実験中の各RNAの頻度を示す。
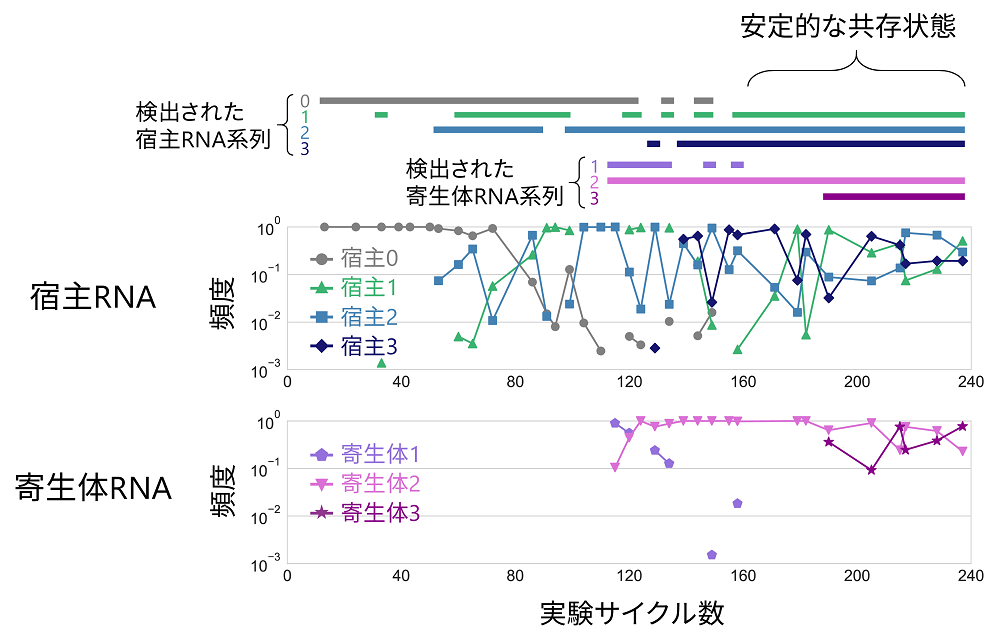
図4.進化実験における各宿主・寄生体RNA系列の集団内頻度
進化実験の前半では(160サイクル以前)では、徐々に新たな宿主・寄生体RNAが出現するものの、それらの頻度は大きく振動しており、検出されない場合も多くあった。一方で、進化実験の後半(160サイクル以降)では、3種類の宿主RNA系列と2種類の寄生体RNA系列の頻度が安定化し、安定的な共存状態へと遷移した。
そこでさらに研究を進めてこの仮説を確かめました。その結果、5種類のRNA系列は進化によって徐々に異なるRNAを複製する機能を獲得し、確かにそれぞれのRNAが互いに複製し合う複雑なネットワークを形成していることを突き止めました(図5)。このネットワーク構造と各RNA系列の生存の関係性を調べたところ、それぞれのRNAが別のRNAの絶滅を防いでいることもわかりました。特に興味深いことに、元来は宿主RNAにとっては複製の資源を横取りして邪魔をするだけの寄生体RNAも、もはや宿主RNAの生存に欠かせないことが示唆されました。単純なRNAの自己複製システムは複雑になり、元には戻れなくなったのです。
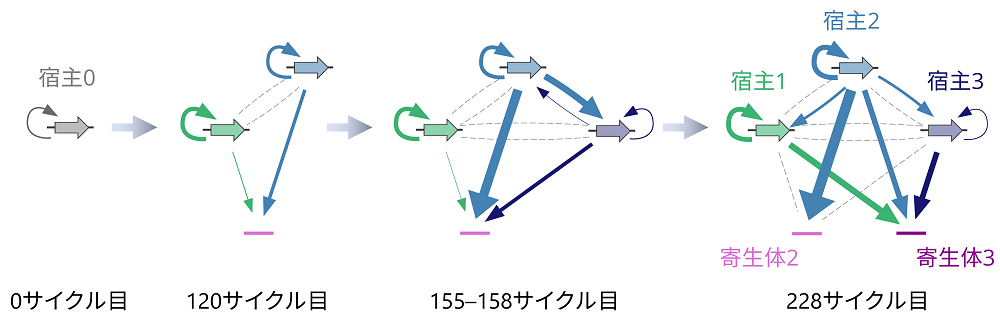
図5.複製ネットワークの進化
矢印は複製能力を示す。最初は単に自己複製していただけのRNAから進化によって徐々に新たなRNA種と相互作用(別のRNAを複製する関係性)が生まれた。RNAの種数と相互作用の数は進化に従って多くなり、最終的には5種類のRNA系列で構成される複製ネットワークへと進化した。このネットワークでは、宿主1や宿主3は特定のRNAしか複製しない一方で、宿主2は全てのRNAを複製する。また寄生体2は宿主2への寄生に特化しており、寄生体3はどの宿主RNAにでも少しずつ寄生できる万能型である。このように、5種類のRNAがそれぞれ異なる複製戦略を進化させ、複雑なネットワークを形成した。
社会的意義・今後の展開
本研究は、原始的な分子の自己複製システムが徐々に複雑化していく様を初めて実験で捉えました。この結果は、原始生命にありえた進化の道筋の証拠を与えたことに加え、これまで理論研究が先行していた同分野に実験で切り込む先例を確立しました。本研究グループは今後、進化実験をさらに継続することで、例えば代謝といった生物学的に重要な新機能が出現し、より複雑な生命システムに近づいていくのではないかと期待しています。
加えて本研究では、分子システムを用いた600世代もの進化実験に初めて成功しました。これほど長期的な進化実験は今まで微生物を用いた研究でしか達成されていませんでしたが、微生物は構成要素が多く、進化によって何が起きたかを詳細に解き明かすのは困難でした。一方で、本研究で用いた分子の自己複製システムは少数の要素で構成されるため、その進化をつぶさに調べることができます。そのため、本研究は生命の起源の理解を推し進めるだけでなく、進化生物学における新たな実験基盤になることが期待されます。
本研究は主に、「科学研究費助成事業(課題番号:JP19K23763、JP21H05867、JP15KT0080、JP18H04820、JP20H04859)」、「JST さきがけ(課題番号:JPMJPR19KA)」、「アストロバイオロジーセンタープロジェクト研究(課題番号:AB021005)」の支援により実施されました。
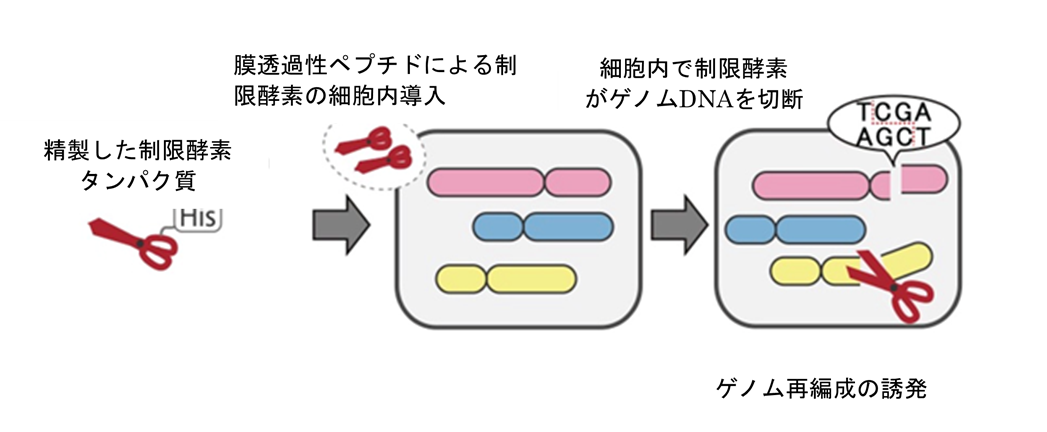
図1. TAQing2.0システムの概要
従来のTAQingシステムでは制限酵素遺伝子をもつプラスミドDNAを細胞に導入して細胞内で発現し、DNAの切断を細胞内で部分的に誘導します。TAQing2.0では精製した制限酵素タンパク質を膜透過性ペプチドと混合し、細胞内に直接送致します。そのため、外来DNAの取り込みを行わずにゲノム再編成を誘発することができます。また、遺伝子発現系が確立していない生物にも容易に適用できるため、適用範囲が広がります。
用語解説
(注1)RNA分子の自己複製システム
RNAはリボ核酸(Ribonucleic acid)のことであり、遺伝情報を記録可能な分子である。DNA(デオキシリボ核酸、Deoxyribonucleic acid)も同様の役割を担うことができるが、原始生命はRNAを遺伝子の担体として利用していたと考えられている。本自己複製システムでは、RNAが自身を複製する酵素(複製酵素)の遺伝子をコードしており、遺伝子が読み出されて複製酵素が生産されると、RNAが複製する。このように、RNAがたった一つの遺伝子をもって自己複製する原始的なシステムである。
(注2)進化
進化の定義は研究分野によって曖昧であるが、本研究では一般的にダーウィン進化とよばれる進化について扱う。例えば、RNAが複製する際に突然変異が起き、複製しやすくなったRNAが出現する。するとこのRNAは周りのRNAよりも速く複製することで、RNA集団における割合を増やしていく。このように、突然変異が起き、性質が変わったRNAが集団内に広まっていくことを進化とよぶ。
(注3)複製ネットワーク
進化が進むと様々なRNA種が生まれることになる。この時、あるRNAが別のRNAの複製を助けるなど、複雑な相互作用を示すRNAのセットを複製ネットワークとよぶ。これは自然界における生態系、すなわち各生物種が周りの種と相互作用して生育しているのと同じである。理論的には、分子の自己複製システムは複製ネットワークを拡張していくことで複雑化していったのではないかと考えられている。
(注4)複製酵素
本研究ではRNAを複製する分子を指す。本研究で用いたRNAがコードしている複製酵素はQβファージとよばれるウイルスに由来する。正確には、RNAはβサブユニットとよばれる複製酵素の触媒サブユニットをコードしており、それが反応液に含まれる2種類の翻訳伸長因子と複合体を形成することで活性をもつ複製酵素となる。
(注5)無細胞翻訳系
翻訳反応に必要な全ての成分(翻訳タンパク質、RNA、アミノ酸、核酸など)が含まれている反応液で、細胞の抽出液を指すことが多い。本研究では大腸菌から個別に因子を精製して混合した独自の反応液を用いている。RNA自己複製システムには本反応液が含まれており、RNAから複製酵素を翻訳する。
(注6)突然変異
DNAやRNA配列の一部が変化することであり、本研究においては複製反応のミスによって起こる。RNAは4種類の核酸塩基(A/G/C/Uで表現される)が繋がった分子であるが、突然変異によって、特定の塩基が別の塩基に置き換わる、塩基が欠損してRNAが短くなる、逆に挿入されてRNAが伸びるといった変化が生じる。
論文情報
Ryo Mizuuchi*, Taro Furubayashi, Norikazu Ichihashi*, “Evolutionary transition from a single RNA replicator to a multiple replicator network,” Nature Communications: 2022年3月18日, doi:10.1038/s41467-022-29113-x.
論文へのリンク (掲載誌)