2022-03-25 分子科学研究所
研究成果のポイント
・抗原が結合したときに抗体の複数箇所に構造変化が生じる
・生じた構造変化によって、抗体の免疫細胞上のFc受容体に対する結合の強さが変化することを発見
・生体内では、抗原が抗体に結合した後、抗原に結合した抗体とFc受容体が結合することによって免疫機能が誘導されるが、その詳細なメカニズムは未解明であった
・抗体が介する免疫機能の理解に繋がり、抗体を主な有効成分とする抗体医薬品の治療効果と安全性の向上に貢献する
概要
大阪大学大学院工学研究科の大学院生の山口祐希さん(博士後期課程)、内山進教授(兼任 自然科学研究機構生命創成探究センター客員教授)らの研究グループは、加藤晃一教授、谷中冴子助教(自然科学研究機構生命創成探究センター/分子科学研究所)と共同で、抗原の結合が抗体に構造変化を引き起こすことで、抗体と免疫細胞上のFc受容体の結合が強くなることを発見しました。
生体内に細菌やウイルスなどの異物が侵入した際には、これらを排除するように抗体を介した免疫機能が働きます。この免疫機能が誘導されるためには、第一段階として、異物すなわち抗原に抗体が結合することと、第二段階として抗体とFc受容体が結合することの、2つの結合が必要です。しかし、2つの結合は順番に起こって免疫機能の誘導が引き起こされるにも関わらず、それらの関係性はこれまで解明されていませんでした。
今回、内山進教授らの研究グループは、抗原が抗体に結合すると、結合していないときと比較して、抗体のFc受容体との結合が強くなり、強くなる度合いは抗原の種類によって異なることを示しました。また、結合を強める度合いの違いは、抗原が抗体に結合したときに、抗原との結合部位以外で生じる抗体の構造変化と関係していることを明らかにしました。抗体とFc受容体の結合の強さは、そのまま免疫機能の効果の強さと関係します。以上より、抗原は抗体に構造変化を引き起こし、Fc受容体との結合を強めることによって、免疫機能を制御していることがわかりました。これは、免疫機能を誘導するための、抗原、抗体、Fc受容体の結合の関係性について包括的に明らかにした初めての研究です。
本研究成果は、米国科学誌「mAbs」に、3月16日(水)午後2時(日本時間)に公開されました。
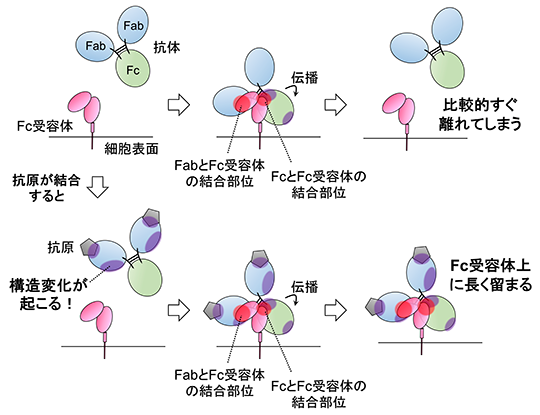
図1. 本研究の概要
研究の背景
抗体は、生体内に細菌やウイルスなどの異物が侵入した際に、これらを排除するような免疫機能を引き起こすタンパク質で、主に血液中に存在しています。抗体は、異物すなわち抗原と結合するFab部分と免疫細胞上の受容体であるFc受容体と結合するFc部分を持っています。これまではそれぞれの結合は独立した現象であると考えられてきました。しかし、抗原と抗体の結合は免疫機能を発揮するための最初のステップであり、その後のFc受容体との結合を促進する可能性があります。しかしながら、これまでこうした仮説を実験的に証明した研究結果はありませんでした。
研究の内容
本研究では、抗原の抗体への結合が抗体とFc受容体との結合を促進するかを確かめるために、バイオレイヤー干渉法(BLI)※1を用いて、抗原が結合した際の抗体と結合していないときの抗体について、Fc受容体との結合の強さを比較しました。その結果、抗原が結合すると、抗原に結合していないときよりも抗体のFc受容体に対する結合が大幅に強くなる場合と、わずかに強くなる場合の2つのパターンがあることがわかりました。次に、この違いを解明するために抗体の構造に着目し、水素/重水素交換質量分析(HDX-MS)※2を用いて抗体と抗原の結合を解析しました。その結果、抗体のFc受容体に対する結合を大幅に強くする抗原が結合すると、抗原との結合部位以外に抗体のFab部分の2箇所に構造変化が引き起こされることが明らかになりました。一方で、結合をわずかに強くする抗原が結合した場合は Fab部分の1箇所のみで構造変化が引き起こされることが示されました。さらに水素/重水素交換質量分析とクロスリンク質量分析(XL-MS)※3を用いて抗体とFc受容体との空間配置を解析したところ、抗原の結合によって構造変化が生じた Fabの領域は2箇所ともFc受容体との結合部位であることがわかりました。
以上の結果より、(1)抗原が結合すると、抗体のFab部分に1箇所もしくは2箇所の構造変化が生じること、そして(2)Fab部分に生じた構造変化は抗体の構造をFc受容体の結合を強くするように働くことが明らかになりました。抗体とFc受容体の結合が強いほど、その後に誘導される免疫機能の効果が高くなることから、抗原の結合は、抗体の構造変化を通して、抗体とFc受容体の結合の強さを調節することによって、免疫機能を制御していることが明らかになりました。
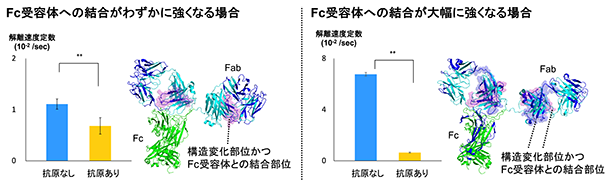
図2. 抗原に結合時の解離速度定数とFab部分の構造変化
解離速度定数の値が小さいほどFc受容体に対する結合が強いことを表す。
青色で示した構造中の領域は抗原の結合時に重水素の取り込み率が変化した領域である。
本研究成果の意義
本研究により、世界で初めて、抗原、抗体、Fc受容体の結合が包括的に解析され、従来独立した現象と考えられていた「抗原と抗体の結合」と「抗体とFc受容体の結合」は密接に関連していることが明らかになりました。この成果は、抗体が生体内で免疫機能を誘導するメカニズムの解明に進展をもたらし、抗体が介する免疫機能に対する理解に繋がることが期待でき、さらには、抗体を主な有効成分とする抗体医薬品の治療効果と安全性の向上に貢献します。
特記事項
本研究成果は、2022年3月16日(水)午後2時(日本時間)に米国科学誌「mAbs」(オンライン)に掲載されました。
タイトル:“The Fab portion of immunoglobulin G has sites in the CL domain that interact with Fc gamma receptor IIIa”
著者名:Yuki Yamaguchi, Natsumi Wakaizumi, Mine Irisa, Takahiro Maruno, Mari Shimada, Koya Shintani, Haruka Nishiumi, Rina Yogo, Saeko Yanaka, Daisuke Higo, Tetsuo Torisu,
Koichi Kato and Susumu Uchiyama
DOI:https://doi.org/10.1080/19420862.2022.2038531
なお、本研究は、日本医療研究開発機構(AMED)「創薬基盤推進研究事業 次世代医薬品の効率的実用化推進のための品質評価技術基盤の開発」および日本学術振興会「科学研究費助成事業」の支援を受けて行われました。
用語説明
※1 バイオレイヤー干渉法(BLI)
センサー表面に固定した分子に対する他の分子の結合と解離を、光の波長の変化によって検出することで、分子同士の結合の強さを観察できる。
※2 水素/重水素交換質量分析(HDX-MS)
軽水素と重水素の質量の違いを利用し、複合体形成に伴う重水素の取り込み率を測定することで、結合部位や構造変化等を捉えることができる。
※3 クロスリンク質量分析(XL-MS)
タンパク質のアミノ酸同士を一定の長さを持つ低分子化合物によって架橋し、その長さをもとにタンパク質同士の空間配置を決定することができる。
【内山進教授のコメント】
バイオテクノロジーを利用して製造されるバイオ医薬品や遺伝子治療製品の発展には最先端かつ信頼性の高い分析が不可欠です。一方で、分析手法の開発は条件検討が多く、創薬と比べると地味かもしれません。本成果は筆頭著者の山口さんを中心に、サンプル自動処理、測定自動化、網羅的解析に精力的に取り組み、他の共著者が的確に分担を遂行した結果で、様々なノウハウが蓄積されました。今後も、医薬品の有効性と安全性を確実なものとするために継続して研究に取り組みます。
本件に関する問い合わせ先
(研究に関すること)
大阪大学 大学院工学研究科 教授 内山 進(うちやますすむ)
(報道に関すること)
大阪大学 工学研究科 総務課 評価・広報係
自然科学研究機構 生命創成研究センター 研究連携推進室
自然科学研究機構 分子科学研究所 研究力強化戦略室 広報担当