炎症性脳細胞を標的とした治療が、タウタンパク質が関係する脳疾患に有効である可能性 Targeting inflammatory brain cell may be effective for brain diseases linked to tau protein
2022-03-18 ワシントン大学セントルイス
・ワシントン大学医学部(セントルイス)の研究者らは、アストロサイト(脳内の炎症細胞)を標的とすることで、タウに関連する脳の損傷と炎症が軽減されることをマウスで示しました。
・アストロサイトは正常な非神経系脳細胞だが、反応性の形態では脳組織を保護するどころか、むしろ害を与える可能性がある。
・脳にタウの絡まりがあるマウスは、ジゴキシンという薬で治療した場合、治療していないマウスに比べて、脳内の反応性アストロサイトの数が減っている。
・この発見は、アルツハイマー病および関連するタウ障害のより良い治療法につながる可能性があります。
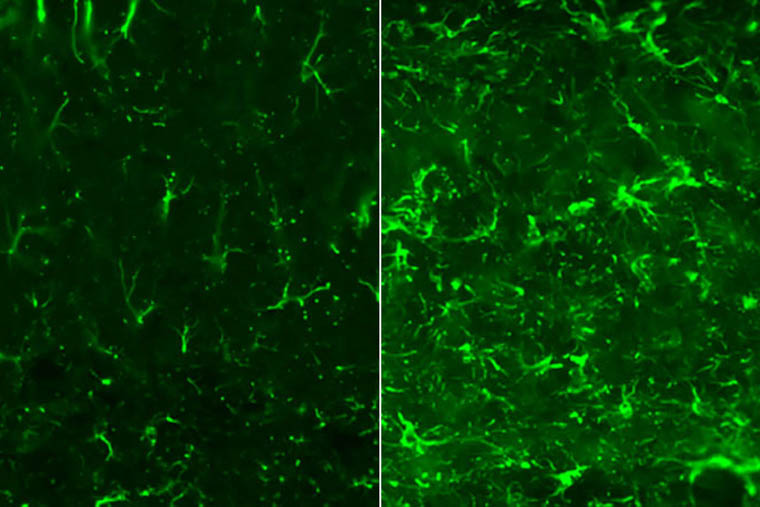
脳にタウの絡まりがあるマウスは、ジゴキシンという薬で治療した場合(左)、治療していないマウス(右)に比べて、脳内の反応性アストロサイト(緑色)の数が減っている。 (Image: Carolyn Mann/School of Medicine)
<関連情報>
- https://source.wustl.edu/2022/03/new-strategy-reduces-brain-damage-in-alzheimers-and-related-disorders-in-mice/
- https://www.science.org/doi/10.1126/scitranslmed.abm4107
アストロサイトのα2-Na+/K+ ATPase阻害は、タウオパチーマウスモデルにおいてアストロサイトの反応性を抑制し、神経変性を軽減させることが明らかになった Astrocytic α2-Na+/K+ ATPase inhibition suppresses astrocyte reactivity and reduces neurodegeneration in a tauopathy mouse model
CAROLYN N. MANN ,SHAMULAILATPAM SHREEDARSHANEE DEVI,COREY T. KERSTING,AMBER V. BLEEM,CELESTE M. KARCH, DAVID M. HOLTZMAN AND GILBERT GALLARDO
SCIENCE TRANSLATIONAL MEDICINE • 16 Feb 2022 • Vol 14, Issue 632 DOI: 10.1126/scitranslmed.abm4107
Abstract
Alzheimer’s disease (AD) is the most dominant form of dementia characterized by the deposition of extracellular amyloid plaques and intracellular neurofibrillary tau tangles (NFTs). In addition to these pathologies, an emerging pathophysiological mechanism that influences AD is neuroinflammation. Astrocytes are a vital type of glial cell that contribute to neuroinflammation, and reactive astrocytes, or astrogliosis, are a well-known pathological feature of AD. However, the mechanisms by which astrocytes contribute to the neurodegenerative process in AD have not been fully elucidated. Here, we showed that astrocytic α2-Na+/K+ adenosine triphosphatase (α2-NKA) is elevated in postmortem human brain tissue from AD and progressive nuclear palsy, a primary tauopathy. The increased astrocytic α2-NKA was also recapitulated in a mouse model of tauopathy. Pharmacological inhibition of α2-NKA robustly suppressed neuroinflammation and reduced brain atrophy. In addition, α2-NKA knockdown in tauopathy mice halted the accumulation of tau pathology. We also demonstrated that α2-NKA promoted tauopathy, in part, by regulating the proinflammatory protein lipocalin-2 (Lcn2). Overexpression of Lcn2 in tauopathy mice increased tau pathology, and prolonged Lcn2 exposure to primary neurons promoted tau uptake in vitro. These studies collectively highlight the contribution of reactive astrocytes to tau pathogenesis in mice and define α2-NKA as a major regulator of astrocytic-dependent neuroinflammation.